Similar presentations:
Урок 19. Практична робота №1. Реакції йонного обміну між електролітами у водних розчинах
1. Урок 19 Практична робота №1. Тема: Реакції йонного обміну між електролітами у водних розчинах.
2.
Мета:- дослідити умови перебігу реакцій йонного обміну ;
- навчитися складати повні йонні та скорочені йонні
рівняння
3.
Увага!Реакції йонного обміну відбуваються до кінця
в трьох випадках:
якщо утворюється
якщо утворюється
осад
якщо виділяється
вода
газ
В інших випадках реакції обміну є оборотні
4. Обладнання:
таблиця розчинності солей, кислот і основ;пробірки, штатив;
реактиви: розчини - MgCI2; AgNO3; Na2CO3; CuSO4 ;
Н2SO4 , NaOH ; HCI, фенолфталеїн.
5.
Хід роботи:Завдання 1. Повторити правила техніки безпеки
при роботі з реактивами
6.
7.
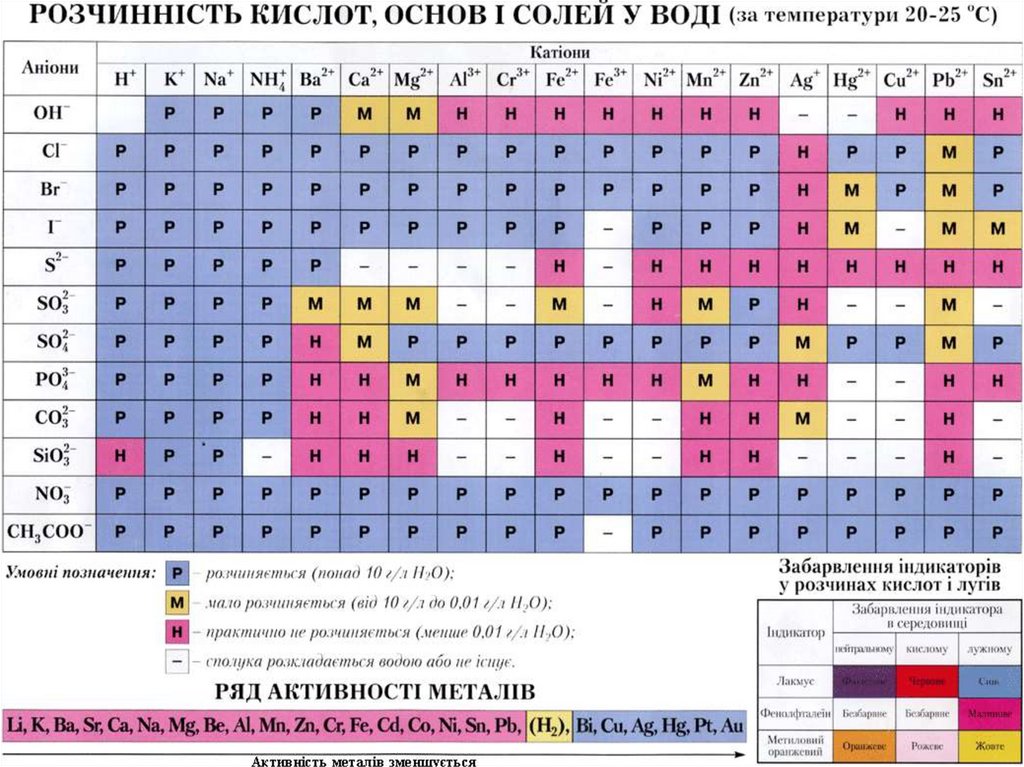
Завдання 2.Користуючись таблицею розчинності і рядом кислот
за силою, звернути увагу, як будуть проходити
реакції в розчині
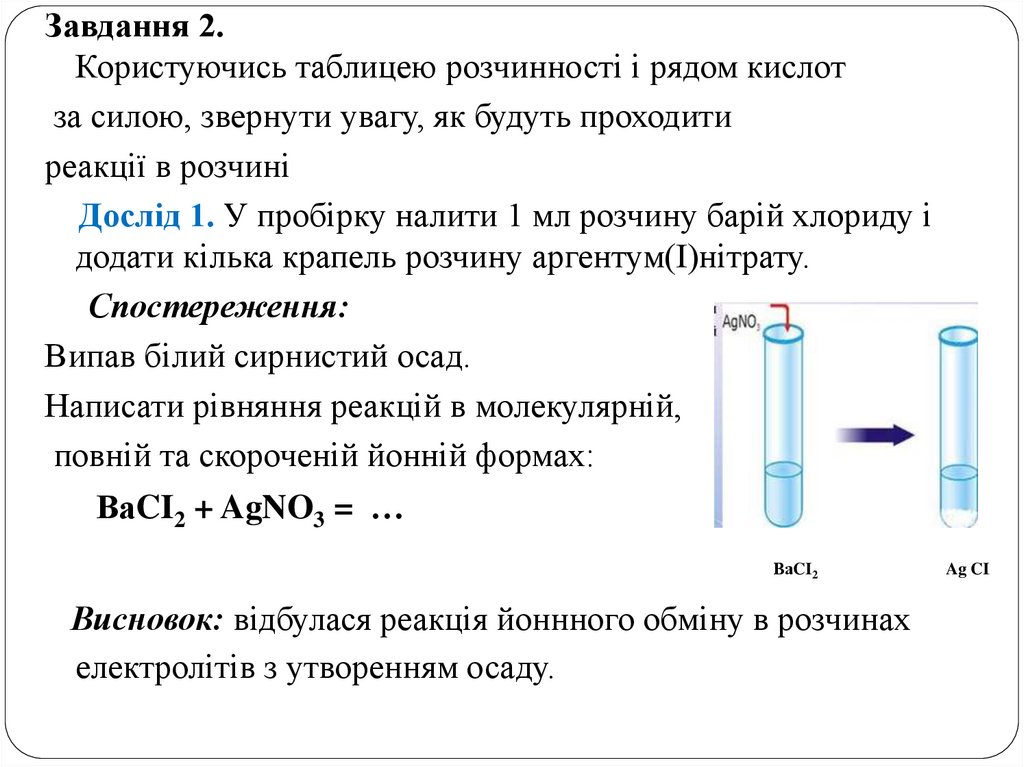
Дослід 1. У пробірку налити 1 мл розчину барій хлориду і
додати кілька крапель розчину аргентум(І)нітрату.
Спостереження:
Випав білий сирнистий осад.
Написати рівняння реакцій в молекулярній,
повній та скороченій йонній формах:
ВаCI2 + AgNO3 = …
ВаCI2
Висновок: відбулася реакція йоннного обміну в розчинах
електролітів з утворенням осаду.
Ag CI
8.
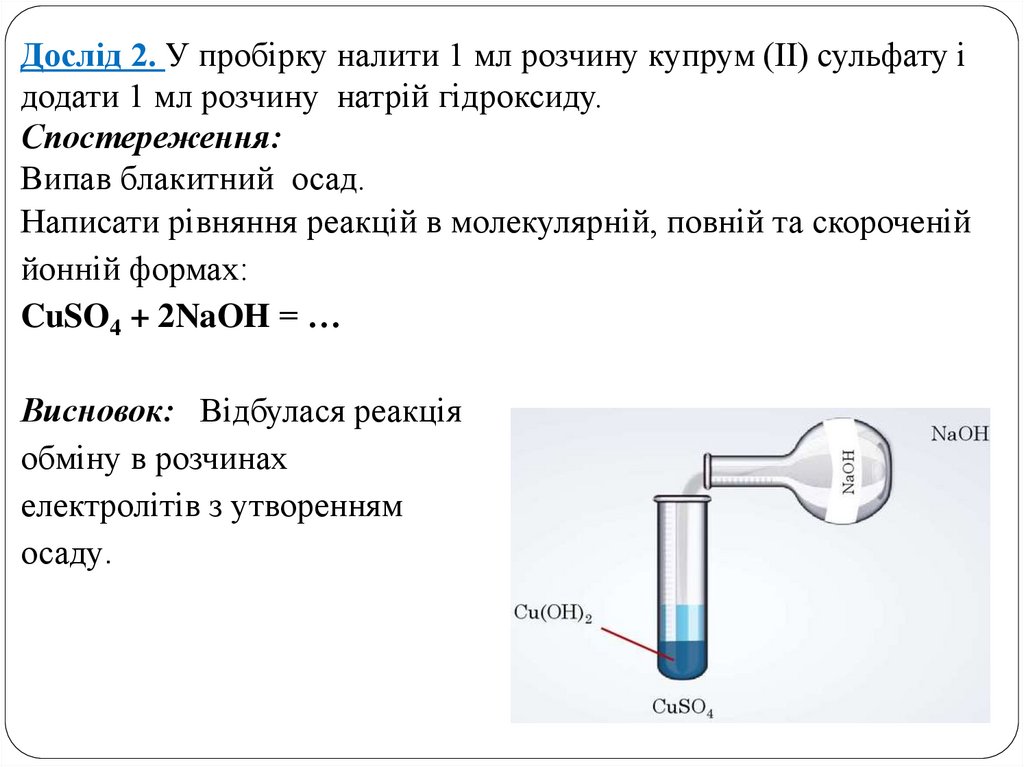
Дослід 2. У пробірку налити 1 мл розчину купрум (ІІ) сульфату ідодати 1 мл розчину натрій гідроксиду.
Спостереження:
Випав блакитний осад.
Написати рівняння реакцій в молекулярній, повній та скороченій
йонній формах:
CuSO4 + 2NaOH = …
Висновок: Відбулася реакція
обміну в розчинах
електролітів з утворенням
осаду.
9.
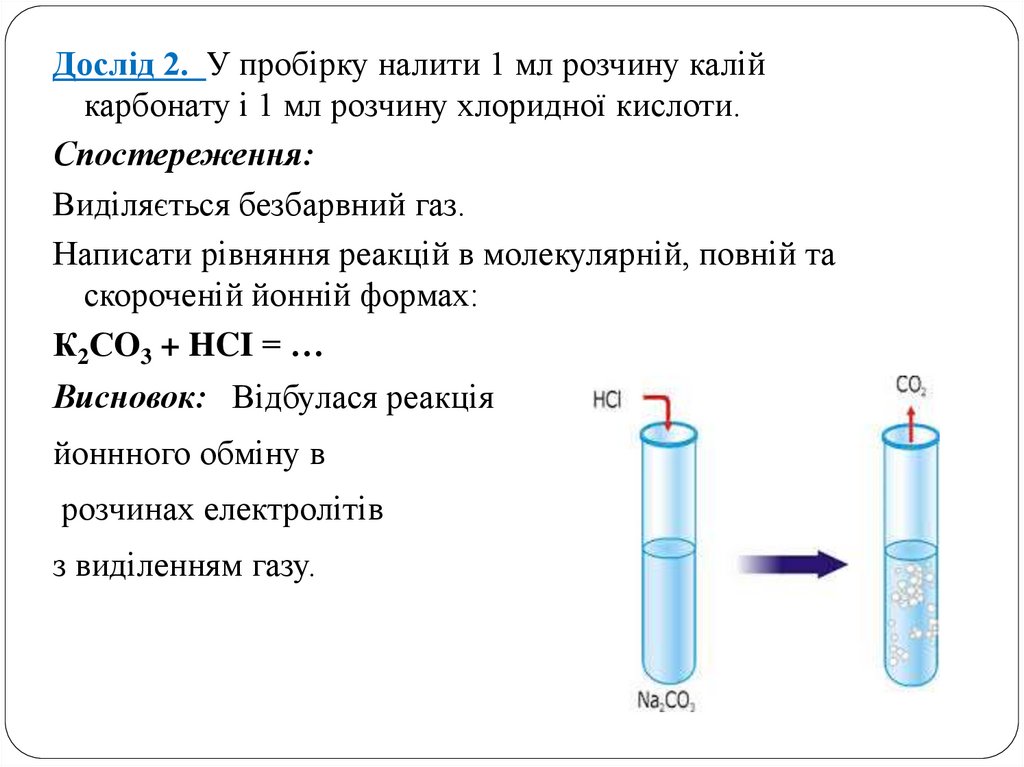
Дослід 2. У пробірку налити 1 мл розчину калійкарбонату і 1 мл розчину хлоридної кислоти.
Спостереження:
Виділяється безбарвний газ.
Написати рівняння реакцій в молекулярній, повній та
скороченій йонній формах:
К2СO3 + HCI = …
Висновок: Відбулася реакція
йоннного обміну в
розчинах електролітів
з виділенням газу.
10.
Завдання 3. Реакції нейтралізаціїДослід1.
У пробірку налити 1 мл розчину калій гідроксиду, додати 1-2
краплі розчину фенолфталеїну і додати 1 мл розчину
сульфатної кислоти.
Спостереження:
У розчині лугу розчин фенолфталеїну набув малинового
забарвлення, яке при додаванні розчину кислоти зникло.
Написати рівняння реакцій в молекулярній, повній та
скороченій йонній формах:
КOH + Н2SO4 = …
Висновок: Відбулася реакція йоннного обміну в розчинах
електролітів з утворенням малодисоційованої речовини води.
11.
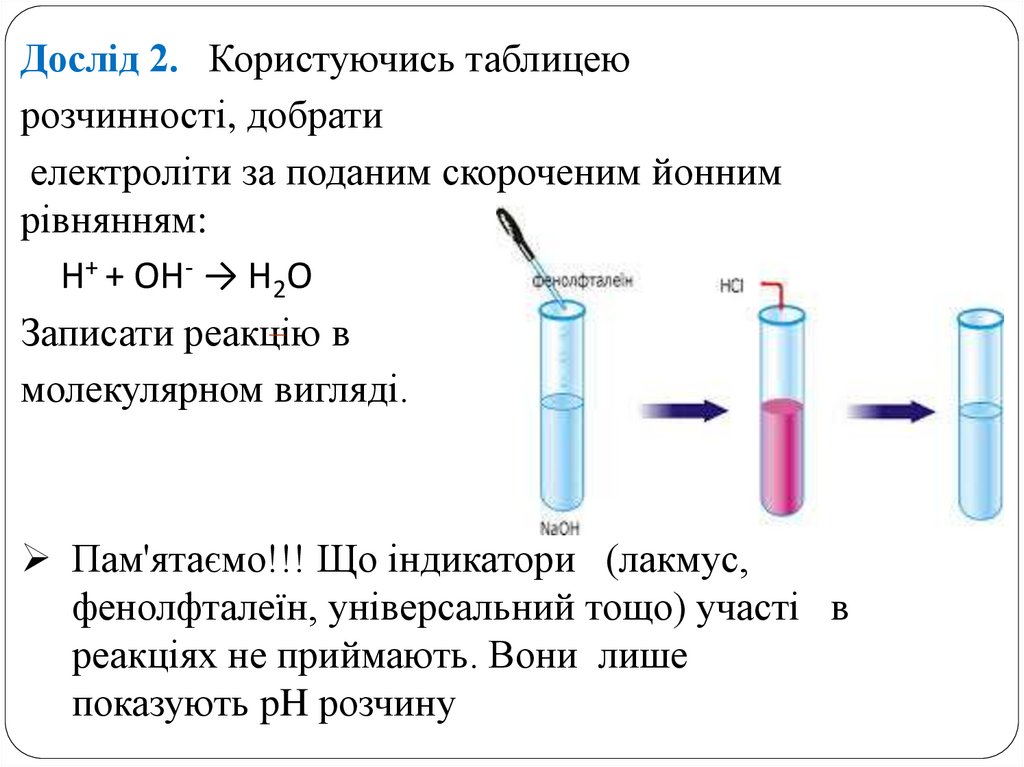
Дослід 2. Користуючись таблицеюрозчинності, добрати
електроліти за поданим скороченим йонним
рівнянням:
H+ + OH- → H2O
Записати реакцію в
молекулярном вигляді.
Пам'ятаємо!!! Що індикатори (лакмус,
фенолфталеїн, універсальний тощо) участі в
реакціях не приймають. Вони лише
показують pH розчину
12.
13.
Домашнє завдання:Виконати практичну роботу в
зошитах і вислати на перевірку








 chemistry
chemistry








