Similar presentations:
Компьютерная грамотность для работников системы образования
1.
Работа выполнена слушателем программы«Компьютерная грамотность для работников системы
образования» Соболевой Татьяной Николаевной
Санкт-Петербург 2012 г.
2.
1. Характеристика элемента по положению в системе2.
3.
4.
5.
6.
7.
8.
и строению атома
Распространение в природе
Физические свойства Аллотропия
Химические свойства
Способы получения
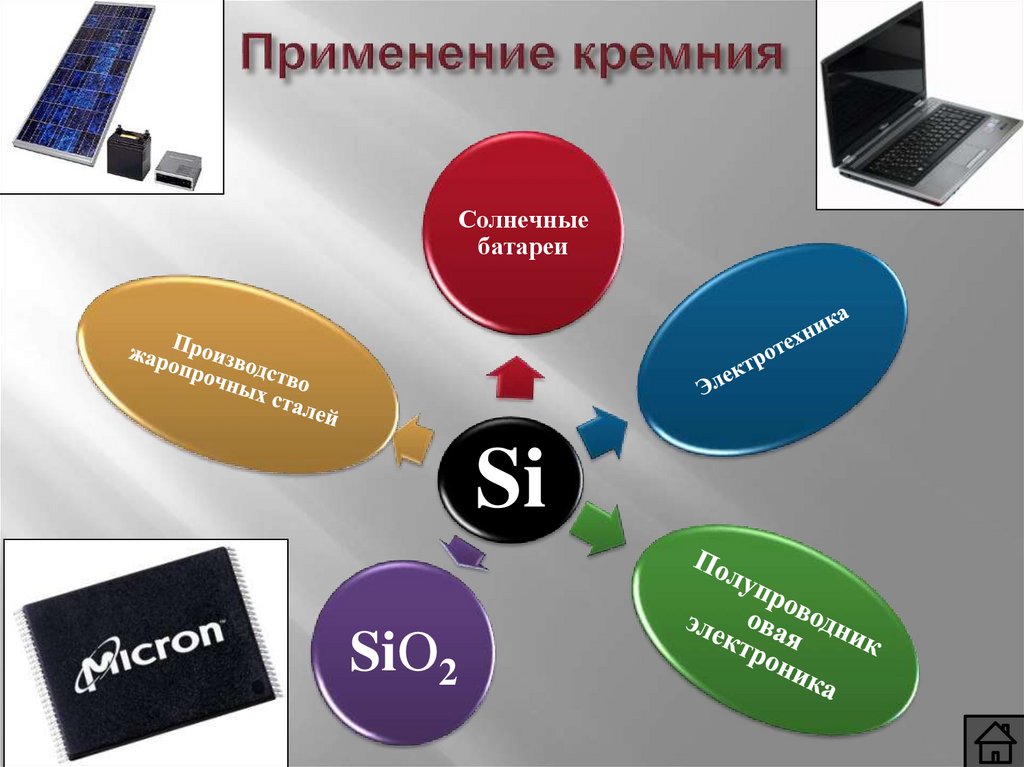
Применение кремния и его соединений
Оксид кремния IV
Кремниевая кислота
3.
Si - элемент №14, 3 период, IV А группа, Ar(Si)=28.1s22s22p63s23p23d0 – стационарное состояние
1s22s22p63s13p33d0 – возбуждённое состояние
3d
3d
3p
3s
3p
3s
Возможные степени окисления: -4; 0; +2; +4
4.
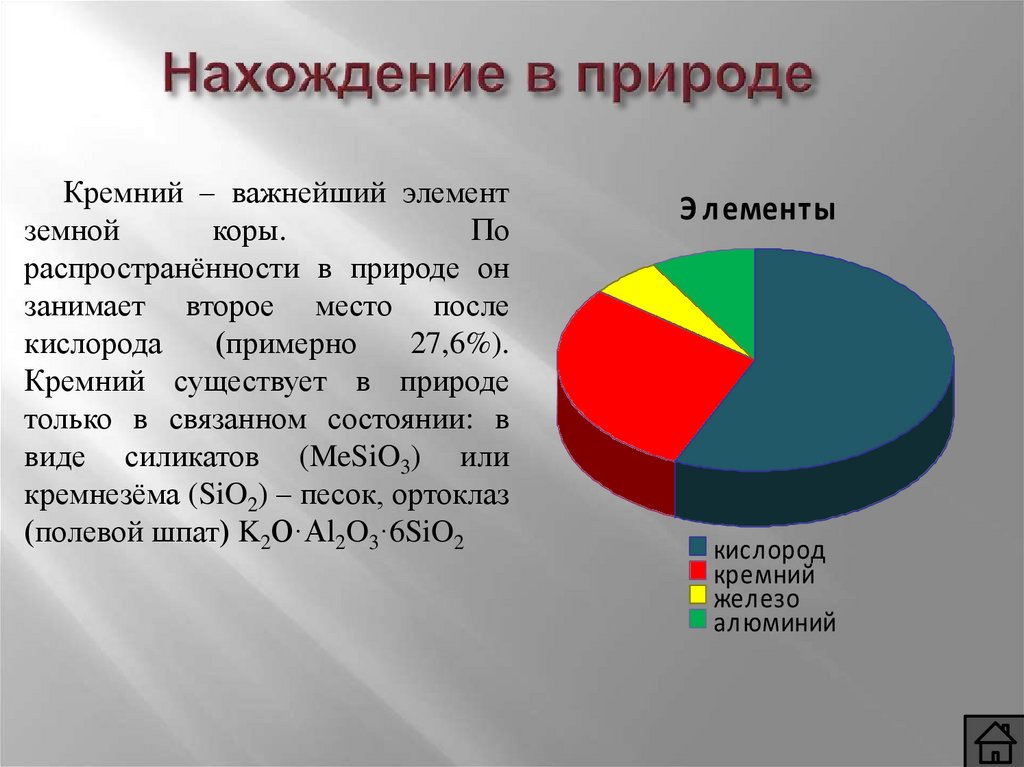
Кремний – важнейший элементземной
коры.
По
распространённости в природе он
занимает второе место после
кислорода
(примерно
27,6%).
Кремний существует в природе
только в связанном состоянии: в
виде силикатов (MeSiO3) или
кремнезёма (SiO2) – песок, ортоклаз
(полевой шпат) K2O·Al2O3·6SiO2
Э лементы
кислород
кремний
железо
алюминий
5.
ЯшмаАгат
6.
КремнийКристаллический кремний
Тёмно-серого цвета, имеет
металлический блеск,
полупроводниковые свойства
Химически инертен. Плотность
2,33 г/см3
Температура плавления = 1415⁰С
Аморфный кремний
Бурый порошок
Более активен, чем
кристаллический
Алмазоподобная структура
Плотность 2 г/см3
7.
Типичный неметалл, инертен. Реагирует с сильными окислителями иливосстановителями при очень высокой температуре.
Как восстановитель
1) Взаимодействует с галогенами
Si + 2F2 → SiF4 (фторид кремния)
∆
Si + 2Cl2 → SiCl4 (хлорид кремния)
2) Кремний сгорает в кислороде
∆
Si + O2 →
SiO2 (оксид кремния)
3) Кремний взаимодействует с азотом и углеродом
∆
Si + C → SiС (карборунд)
3Si + 2N2∆→ Si3N4 (нитрид кремния)
4) Кремний растворяется в щелочах при нагревании
∆
Si + 2NaOH + H2O → Na2SiO3 + 2H2↑
5) С водородом не взаимодействует
Si + H2 →
8.
Как окислительПри сплавлении кремния с металлами могут образоваться
силициды
∆
(Силицид магния)
Si + 2Mg →
Mg2Si
Силициды – малоустойчивые соединения. В присутствии
воды или кислот они разлагаются:
Mg2Si + 4H2O ∆→ 2Mg(OH)2 + SiH4↑ (силан)
∆
Ca2Si + 4HCl →
2CaCl2 + SiH4↑ (силан)
9.
1) В промышленности∆
SiO2 + 2C →
Si + 2CO↑
2) В лаборатории – восстановлением
SiO2 + 2Mg ∆→ Si + 2MgO
3SiO2 + 4Al ∆→ 3Si + 2Al2O3
3) Наиболее чистый кремний получают из
тетрахлорида кремния
∆
SiCl4 + 2H2 → Si + 4HCl
∆
SiCl4 + 2Zn → Si + 2ZnCl2
10.
Солнечныебатареи
Si
SiO2
11.
В природе 2 вида кремнезёма: Кристаллический и аморфный.Твёрдое, кристаллическое вещество, атомная кристаллическая решётка,
немолекулярного строения. Тпл = 1728⁰С, Ткип = 2590⁰С, инертен.
(SiO2)n
Кварц
Кристобалит
Коусит
Горный хрусталь
Агат
Яшма
опал
Кварцевый песок
12.
Кислотный оксид1. Со щелочами при t⁰
SiO2 + 2NaOH → Na2SiO3 + H2O
2. С солями
SiO2 + CaCO3 → CaSiO3 + CO2 ↑
3. С основными оксидами
SiO2 + CaO → CaSiO3
4. Не реагирует с водой
SiO2 + H2O ≠
5. Особое свойство (Травление стекла)
SiO2 + 4HF → SiF4 ↑ + 2H2O
6. С металлами при t⁰
SiO2 + 2Mg → 2MgO + Si
13.
nSiO2 ∙ mH2O поликремниевые кислотыN = 1, m = 1 SiO2 ∙ H2O или H2SiO3 – кремниевая кислота.
Слабая, непрочная, в воде малорастворима (образует
коллоидный раствор), нет кислого вкуса.
Получение: Na2SiO3 + 2HCl → 2NaCl + H2SiO3
Свойства:
1. При нагревании разлагается
H2SiO3 → H2O + SiO2
2. Со щелочами
H2SiO3 +2NaOH → 2H2O + Na2SiO3
Na2SiO3 и K2SiO3 – жидкое стекло
Студенистый осадок












 informatics
informatics chemistry
chemistry








