Similar presentations:
Тренировочный вариант экзаменационной работы по химии для подготовки к ГИА для учащихся 9 классов
1. Тренировочный вариант экзаменационной работы по химии для подготовки к ГИА для учащихся 9 классов
Выполнил: Ксендзов Олег, ученик 10 классаМОУ ССОШ№2 РМЭ
Руководитель: Мухамедзянова С.Д.
2. Инструкция по выполнению работы Часть 1 При выполнении заданий этой части (А1-А15) из четырёх предложенных вариантов выберите
один верный.Желаем успеха!
3. А1. Атомы одного и того же элемента различаются
1)Зарядомядра еще!
Подумай
2)Числом нейтронов
Молодец!в ядре
3)Числом
протоновеще!
в ядре
Подумай
4)Числом электронов в
Подумай еще!
электронной оболочке
4. А2.Неметаллические свойства в ряду элементов Be->B->C->N
А2.Неметаллические свойства вряду элементов Be->B->C->N
1)Не изменяются
Подумай еще!
2)Усиливаются
Молодец!
3)Ослабевают
Подумай еще!
4)Изменяются
периодически
Подумай
еще!
5. А3.В силане SiH4 химическая связь
Подумай1)Ионная
еще!
2)Ковалентная
Подумайнеполярная
еще!
3)Металлическая
Подумай
еще!
4)Ковалентная
полярная
Молодец!
6. А4. Вещество в котором степень окисления фосфора +5, имеет формулу
1)P205Молодец!
2)Р203еще!
Подумай
3)РН3еще!
Подумай
4)PCI3еще!
Подумай
7. А5. Вещество, формула которого Н3РО4, имеет название
1)Фосфорнаякислота
Молодец!
2)Фосфат
Подумайнатрия
еще!
3)Оксид
фосфора
Подумай
еще!
4)Фосфин
Подумай
еще!
8. А6. Реакцию, уравнение которой 2NaOH + CuCl2 = Cu(OH)2 + 2NaCl, относят к реакциям
1)РазложенияПодумай
еще!
2)Соединения
Подумай
еще!
3)Замещения
Подумай
еще!
4)Обмена
Молодец!
9. А7.Гидроксид-ионы образуются в процессе электролитической диссоциации
А7.Гидроксид-ионыобразуются в процессе электролитической диссоциации
1)Гидроксида
калия
Молодец!
2)Гидроксида
железа
Подумай
еще! (III)
3)Гидроксида
меди
(II)
Подумай
еще!
4)Гидроксида
алюминия
Подумай
еще!
10. А8.Практически до конца протекает реакция
1)Na2SO4 + KCI
Подумай
еще!->
2)H2SO
4 + BaCL2->
Молодец!
3)NaNO
3 + KOH
Подумай
еще! ->
4)NaCI
+ KNO
3 ->
Подумай
еще!
11. А9. Какое из перечисленных ниже свойств характерно для соединения NH3?
1)Жидкость при 20°С, растворяетсяПодумай еще!
в воде, имеет резкий запах, легче воды
2)Газ при 20°С, не растворяется в воде,
Подумай
имеет резкий
запах, легчееще!
воздуха
3) Газ при 20°С, растворяется в воде,
Молодец!
имеет резкий запах,
легче воздуха
4)Газ при 20°С, растворяется в воде,
Подумай еще!
имеет резкий запах, тяжелее воздуха
12. А10. Водород не вступает в химическую реакцию с
1)Оксидомуглерода (IV)
Молодец!
2)Кислородом
Подумай
еще!
3)Хлором
Подумай
еще!
4)Оксидом
Подумаймеди
еще!(II)
13. А11. Верны ли следующие высказывания о свойствах кислот
А.Все кислоты взаимодействуют с основаниямиБ.Соляная кислота взаимодействует с медью с
выделением водорода
1)Верно
только А
Молодец!
2)Верно
только
Подумай
еще!Б
3)ОбаПодумай
сужденияеще!
неверны
4)Оба суждения
верны
Подумай еще!
14. А12.Формула предельного углеводорода
1)С2Н4еще!Подумай
2)С2Н6
Молодец!
3)С2Н2еще!
Подумай
4)С3Н6еще!
Подумай
15. А13.Верны ли суждения о том, что увеличение относительного содержания углекислого газа в атмосфере Земли может стать одной из
причинА.Увеличения количества озона в атмосфере
Б.Потепления климата
1)Верно
только
Подумай
еще!А
2)Верно
только Б
Молодец!
3)ОбаПодумай
сужденияеще!
неверны
4)Оба суждения
верны
Подумай еще!
16. А14. Скорость реакции железа с соляной кислотой увеличится, если
1)ПовыситьПодумайдавление
еще!
2)Повысить концентрацию
Молодец!
хлороводорода
3)Понизить температуру
Подумай еще!
раствора
4)Добавить
в раствор
Подумай
еще!лакмус
17. А15.Массовая доля азота в калийной селитре равна
1)13,9 %Молодец!
2)19,3 %
Подумай
еще!
3)27,0 %
Подумай
еще!
4)39,7 %
Подумай
еще!
18. Инструкция по выполнению работы Часть 2 Ответом к заданиям этой части (В1-В4) является последовательность цифр. При выполнении
заданий В1—В2 из предложенного перечняответов выберите два правильных и запишите
цифры, под которыми они указаны.
Желаем успехов!
19. В1.Для ряда химических элементов магний -> кальций -> стронций -> барий характерны следующие закономерности изменения
В1.Для ряда химических элементовмагний -> кальций -> стронций -> барий характерны
следующие закономерности изменения характеристик
1)Уменьшение числа электронов
Подумай
во внешнемеще!
слое
2)Увеличение числа
Молодец!
электронных
слоев
3)Увеличение восстановительной
Молодец!
способности
4)Увеличение значения
Подумай еще!
электроотрицательности
5)Увеличение значения высшей
Подумай
еще!
степени окисления
20. В2. Оксид фосфора (V) реагирует с
1)водойМолодец!
2)оксидом
кремния
Подумай
еще! (IV)
3)магнием
Подумай
еще!
4)гидроксидом
Молодец!натрия
5)хлороводородом
Подумай еще!
21. В3. Установите соответствие между схемой превращения и веществом восстановителем в ней
Схема реакцииА)2Na + 2H2О ->2NaOH + H2.
Восстановитель
1)Na
2) H2
Б)2Pb(NО3)2 ->2РbО + 4NO2 + О2
В)MnО2 + НСl -> MnСl2 + Сl2 + H2О
3) Pb(NО3)2
4) MnО2
5) НСl
Ответ
135
22. В 4. Установите соответствие между исходными веществами и продуктами реакции
ИСХОДНЫЕ ВЕЩЕСТВАПРОДУКТЫ
РЕАКЦИИ
1)Fe + CO2
А) CuO + H2SO4 ->
2) Fe(NO3)3 + NO + H2O
Б) Fe2O3 + С ->
3) Fe(NO3)3 + H2
В) Fe + HNO3 ->
4) CuSO4 + H2O.
Ответ
412
5) FeO + CO2
23. Инструкция по выполнению работы
Часть 3Для ответов на задания этой части
(С1—СЗ) запишите сначала номер задания (С1 и
т. д.), затем развёрнутый ответ к нему.
Желаем успехов!
24.
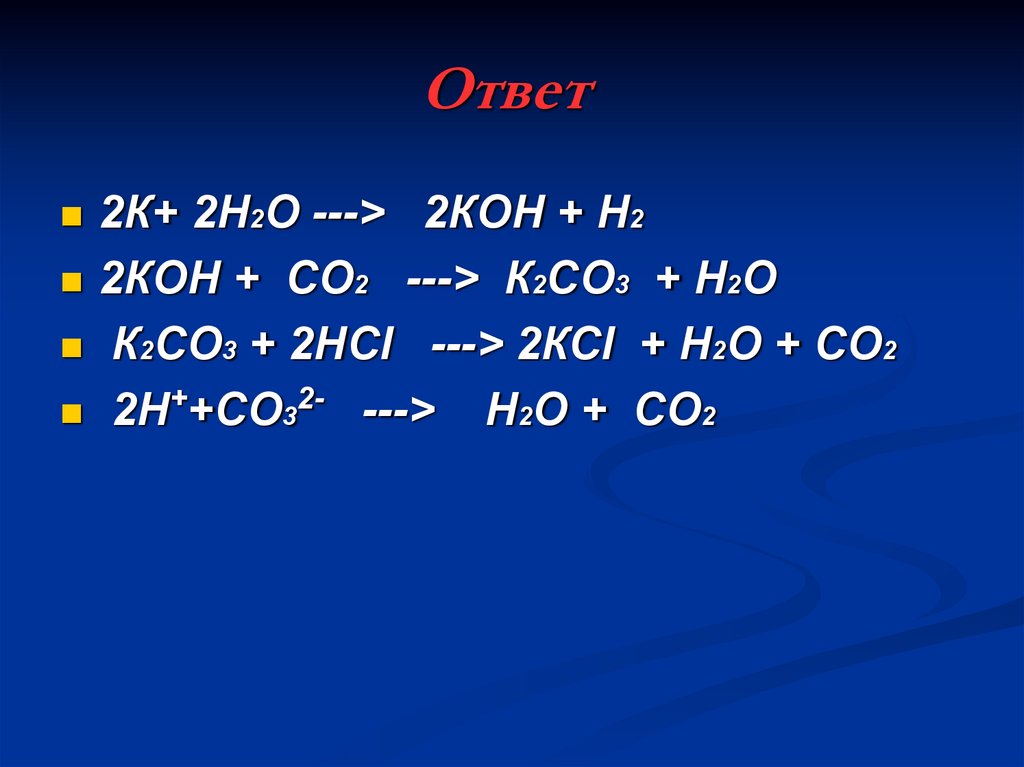
С1.Дана схема превращений:
+ H2O
К ---> Х ---> К2СО3 ---> CO2
Напишите молекулярные уравнения реакций, с
помощью которых можно осуществить указанные
превращения. Для третьего превращения составьте
сокращенное ионное уравнение реакции.
25. Ответ
2К+ 2H2O ---> 2КOH + H22КOH + CO2 ---> К2СО3 + H2O
К2СО3 + 2НСl ---> 2КСl + H2O + CO2
2Н++СO32- ---> H2O + CO2
26.
С2. В раствор хлорида железа (III)с массовой долей 12% прилили
раствор гидроксида калия.
Образовалось 5,6 г осадка.
Вычислите массу,
использованного раствора
хлорида железа (III).
27. Ответ
1) уравнение реакции:FeCl3 +3 KOH = Fe(OH)3↓ + 3KCl
2) количество вещества гидроксида железа (III),
n Fe(OH)3 = m (Fe(OH)3)/ M (Fe(OH)3) = 5,6: 107 = 0,052 моль
по уравнению реакции n Fe(OH)3 = n FeCl3= 0,052 моль,
тогда m (FeCl3)= n (FeC13) · M(FeCl3) =0,052 · 162,5 = 8,45 г
масса раствора m(p-pa) (FeCl3)= m (FeCl3) : ω · 100% = 8,45:12·
100 = 70,4 г
28.
С3.На практической работе учащимся был выданбесцветный раствор неорганического
соединения. Содержимое пробирки разделили
на две части. К одной добавили раствор
хлорида кальция - выпал белый осадок, а к
другой добавили раствор иодида натрия, также
образовался осадок, но жёлтого цвета.
Запишите химическую формулу и название
вещества в выданном растворе. Составьте два
уравнения реакций, которые были проведены в
процессе его распознавания.
29. Ответ
1) химическая формула и название выданноговещества в растворе:
AgNO3 – нитрат серебра
2) уравнения реакций, которые были проведены в
процессе его распознавания:
2AgNO3 + CaCl2 = Ca (NO3)2 + 2AgCl↓ -белый
осадок
AgNO3 + NaI = NaNO3 + AgI↓ - жёлтый
осадок
30.
Вы довольнысвоим
результатом?
31.
Используемая литература:Корощенко А.С. Химия. Задания с
выбором ответа 8-9 кл. – 2-е изд.,
испр. и доп. – М.: Гуманитар.
Изд. центр ВЛАДОС, 2007г






























 chemistry
chemistry








