Similar presentations:
Электронное и пространственное строение алканов
1. Тема урока: Электронное и пространственное строение алканов
2.
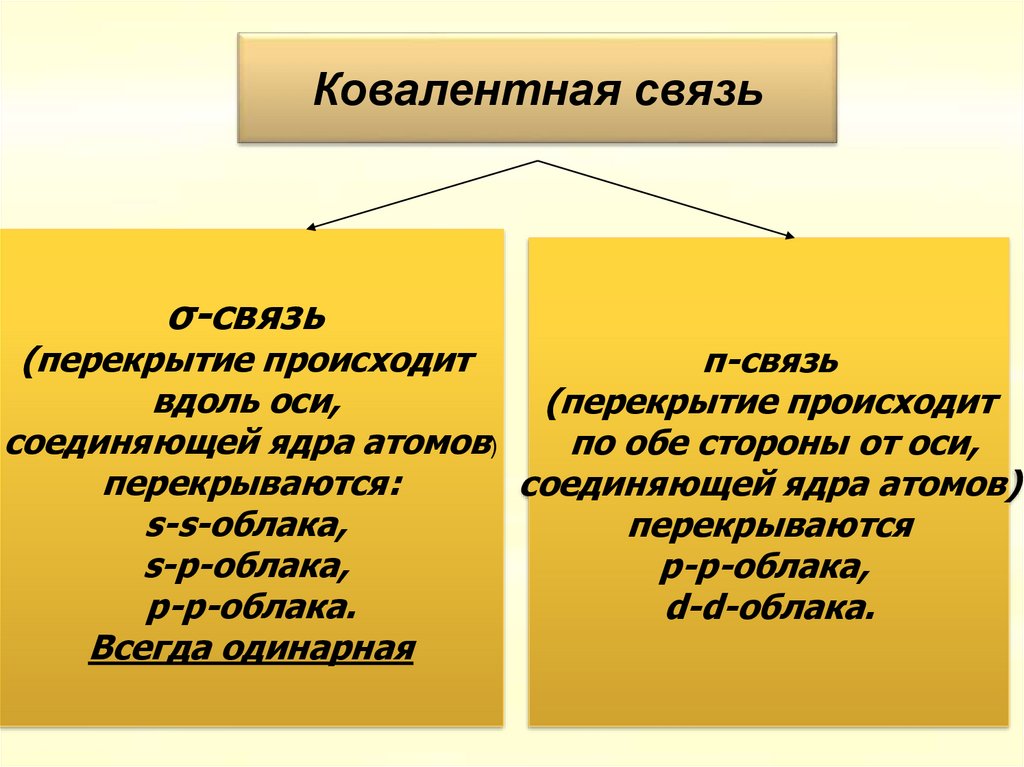
Ковалентная связьσ-связь
(перекрытие происходит
π-связь
вдоль оси,
(перекрытие происходит
соединяющей ядра атомов)
по обе стороны от оси,
перекрываются:
соединяющей ядра атомов)
s-s-облака,
перекрываются
s-p-облака,
р-р-облака,
p-p-облака.
d-d-облака.
Всегда одинарная
3. Атом углерода в нормальном состоянии.
6С+6 )2)4
C
s
1s22s22p2
px
py
pz
4. Атом углерода в возбужденном состоянии.
C*s
C*
px
1s22s12p3
py
pz
5. Гибридизация - это
процесс усреднения(выравнивания)
электронных облаков по
форме и энергии.
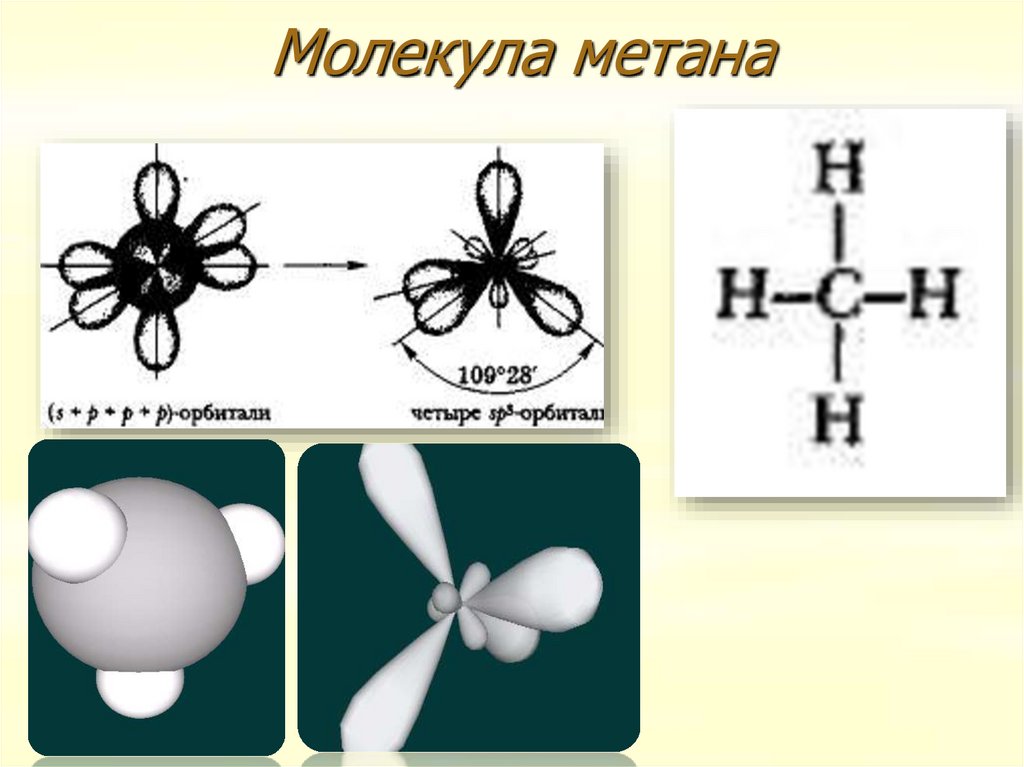
6. Молекула метана
7.
SР3 – гибридизацияВалентный угол -109о28
Тетраэдр
Длина углерод – водородной связи:
0,109 нм
8.
0,154 нм9. Молекула этана
10. Характеристики связей
В молекуле этана два атома углероданаходятся в состоянии sp3гибридизации.
Образуется семь ковалентных σ-связей,
из них одна С-С, а шесть других – это
связи С-Н.
Как и в молекуле метана валентный
угол равен 109°28´, длина связи С-С –
0,154нм.
Связь С-С – неполярная, связь С-Н –
слабополярная.
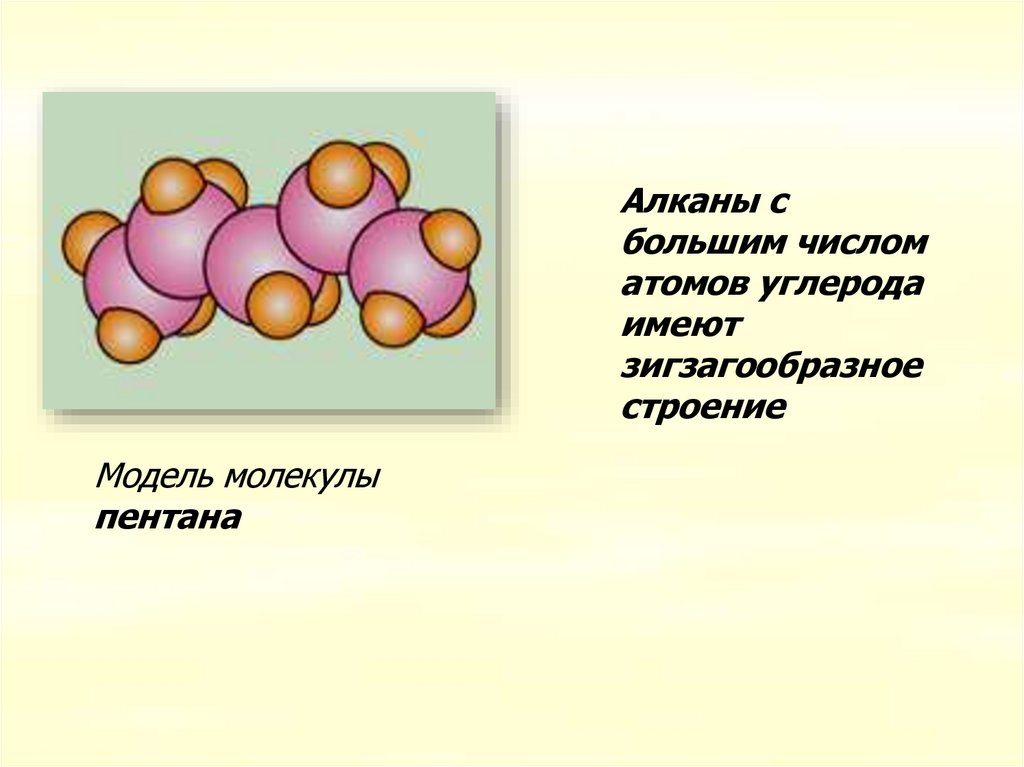
11.
Алканы сбольшим числом
атомов углерода
имеют
зигзагообразное
строение
Модель молекулы
пентана
12.
Число гибридных орбиталей равночислу исходных.
Гибридные обитали образуют только
σ-связи.
Гибридизации подвергаются
электронные орбитали с близкими
значениями энергии.
Гибридизация характерна для
элементов 2 периода Ι - VΙ групп.










 chemistry
chemistry








