Similar presentations:
Подготовка материала для исследования. Техника безопасности при проведении иммунологических исследований. Лекция №9
1.
Лекция №9Подготовка материала для
исследования.
Техника безопасности при проведении
иммунологических исследований
2.
План:1. Клинический материал для
исследования и способы его
подготовки к работе.
2. Приготовление клеточных
суспензий.
3. Соблюдение правил техники
безопасности, охраны труда и
инфекционной безопасности при
проведении иммунологических
исследований.
3.
1.Клинический материал для иммунологических исследования испособы его подготовки к работе.
Лабораторная диагностика инфекционных болезней
человека основана на обнаружении в организме
пациента микроба, вызвавшего болезнь, микробных
антигенов или продуктов их жизнедеятельности
(токсинов).
Материалом для исследований служат:
- в клинической микробиологии и иммунологии –
биологические и патологические жидкости
организма и выделения (кровь, ликвор, моча, кал,
мокрота, гной, экссудаты, рвотные массы и др.) и
ткани ( биоптаты, материал для аутопсии).
- в санитарной микробиологии и иммунологии – воздух,
вода, почва, продукты питания, смывы с объектов
окружающей среды, рук персонала, образцы
различных объектов ( шовный , перевязочный
материалы, готовые лекарственные формы и пр.)
4.
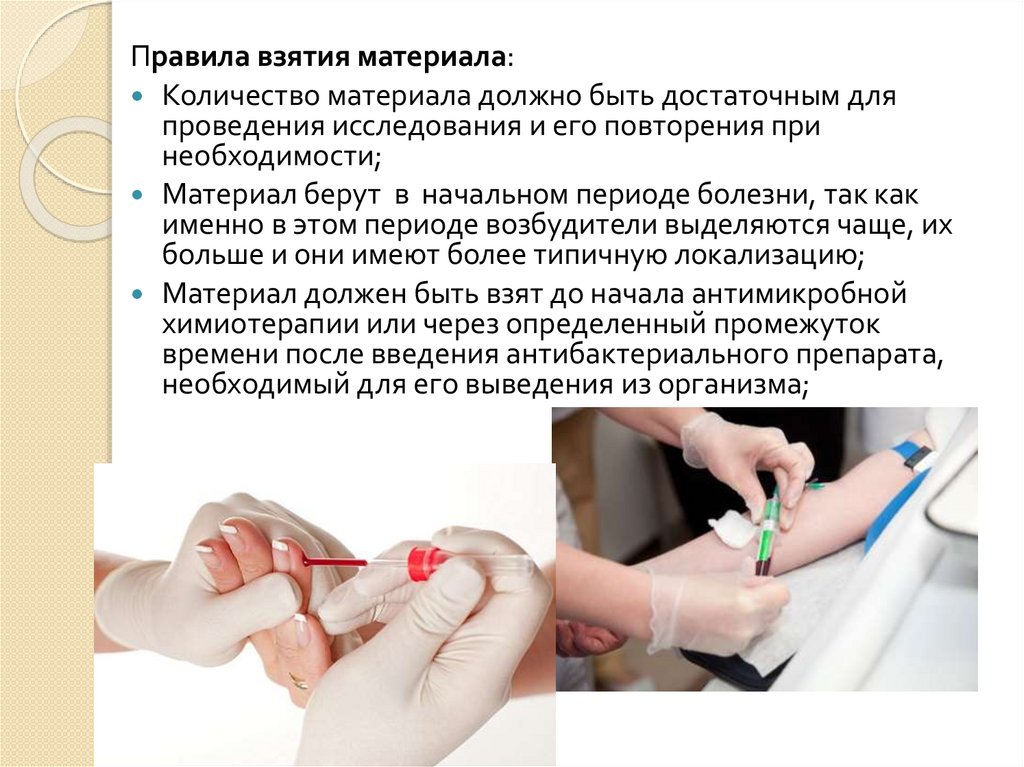
Правила взятия материала:Количество материала должно быть достаточным для
проведения исследования и его повторения при
необходимости;
Материал берут в начальном периоде болезни, так как
именно в этом периоде возбудители выделяются чаще, их
больше и они имеют более типичную локализацию;
Материал должен быть взят до начала антимикробной
химиотерапии или через определенный промежуток
времени после введения антибактериального препарата,
необходимый для его выведения из организма;
5.
2.Приготовление клеточных суспензий2.1. Суспензия лимфоидных клеток
Концентрация лимфоидных клеток в суспензии
должна быть такой, чтобы в наносимом объеме
содержалось 100 АОК (антителообразующих
клеток) в расчете на 1 камеру Каннингема, 150 — на 1
предметное стекло и 400 — на 1 чашку Петри.
Если содержание АОК в образце неизвестно, его
определяют в предварительных опытах.
На одну пробу удобнее всего брать сотую часть
селезенки и двадцатую часть клеток, содержащихся
в 1 мл культуры.
Лимфоидные клетки дважды отмывают,
центрифугируя при 500 § и 4°С в течение 10 мин,
ресуспендируют в холодном СР и до внесения в
суспензию эритроцитов держат в ледяной бане.
6.
Количество клеток можно определить двумяспособами:
а) подсчитывают в счетной камере клетки с ядрами
после разведения суспензии в растворе Тюрка (не
менее 100 клеток);
б) подсчитывают живые клетки по исключению
трипанового синего (каплю клеточной суспензии
при комнатной температуре.
Смешивают с каплей раствора трипанового синего
и через 1—3 мин подсчитывают число погибших, т.
е. окрашенных, клеток).
7.
2.2. Индикаторные клетки. В качестве индикаторныхклеток используют эритроциты, выдержанные в
течение недели в растворе Олсвера, поскольку
свежие эритроциты менее чувствительны к
иммунному гемолизу.
Перед приготовлением суспензии эритроциты трижды
отмывают, центрифугируя по 10 мин при 2500 § при
комнатной температуре. Затем клетки
ресуспендируют в ЗФР или СР до концентрации 20%
(по объему) для работы в агаровом геле и 8—10%
—Для методики Каннингема 45°С, затем смешивают с
равным объемом подогретого до 45°С двойного
концентрата среды Игла.
Затем агар разливают по 10—15 мл в чашки Петри
(100X15 мм); в таком виде его можно хранить при 4°С
2—3 недели.
В день опыта перевернутые вверх дном чашки без
крышек помещают на 1,5 ч в термостат при 37°С,
чтобы из агара испарилось по 1—2 мл воды.
8.
1.3.Агаровый гель для верхнего слоя.Гель готовится в день опыта. Раствор агара (1,4%-ный) в
дистиллированной воде автоклавируют, охлаждают на
водяной бане до 45°С и смешивают с равным объемом
подогретого до 45°С двойного концентрата среды Игла.
Конечная концентрация агара в верхнем слое составляет 0,7%.
Процедуру можно ускорить, заменив автоклавирование
кипячением.
В этом случае суспензию агара нужно кипятить до появления
пены, после чего уменьшить подогрев и, когда пена опадет,
продолжать кипячение.
Такую обработку нужно повторять до тех пор, пока не
перестанет образовываться пена или по крайней мере будут
только крупные пузыри. Обычно этого удается достичь за 5
мин.
9.
2.4.Получение зон гемолиза1.В вассермановские пробирки ( 5 мл) наливают по 0,1 мл
раствора ДЭАЭ-декстрана и помещают их в водяную баню
при 45°С.
2.Нагретой пипеткой в каждую пробирку с ДЭАЭ-декстраном
наливают по 2 мл агарового геля.
3.Держа пробирки с агаром в водяной бане (45°С), быстро
вносят в них последовательно по 0,1 мл суспензии
индикаторных клеток и 0,01—0,5 мл суспензии лимфоидных
клеток.
4.Смесь быстро выливают в чашку Петри на нижний слой агара.
Чтобы гель застыл равномерно, чашки ставят на
горизонтальную поверхность.
10.
После того как верхний слой застынет, чашкиинкубируют 3 ч при 37°С. Затем на поверхность
агара наливают по 2 мл комплемента морской
свинки, разведенного 1 : 10 в ЗФР, и инкубируют
еще 30 мин.
Зоны гемолиза видны теперь как мелкие круглые
просветления на матовом фоне целых эритроцитов.
Чашки оставляют при комнатной температуре еще на
1—2 ч, затем сливают комплемент; теперь их можно
хранить при 4°С.
Зоны гемолиза можно считать и невооруженным
глазом, но лучше воспользоваться малым
увеличением стереоскопического микроскопа.
В центре каждой зоны гемолиза под микроскопом
можно рассмотреть антителообразующую клетку
(АОК), которую можно зафиксировать, прибавив в
чашку 2 мл 0,25% раствора глутаральдегида.
11.
12.
2.5.Реакция на предметных стеклах1.Предметное стекло покрыть тонким слоем 0,1—0,2%- ной агарозы и
высушить.
2.0,5%-й раствор расплавленной агарозы в сбалансированном солевом
растворе разливают по 0,5 мл в подогретые пробирки, помещенные
в водяную баню (45°С).
3.Прибавляют по 50 мкл 15%-ной суспензии БЭ и па 10—100 мкл взвеси
лимфоидных клеток; с
4.Смесь переносят на предметные стекла, покрытые пленкой агарозы,
и равномерна распределяют по их поверхности, выравнивая слой
боковой поверхностью пробирки.
5.Стекла оставляют на горизонтальной поверхности, пока не застынет
гель, затем их кладут слоем геля вниз в специальные лотки из
люцита с небольшим углублением (21,5X4,7X0,1 см).
6.Пространство между предметными стеклами и дном лотка
заполняют комплементом морской свинки, разведенным СР 1 : 10.
7.Лотки ставят друг на друга и помещают в пластиковые коробки, на
дно которых для создания влажной атмосферы кладут мокрую
фильтровальную бумагу, и инкубируют 3 ч при 37°С.
Для подсчета АОК стекла погружают в физиологический раствор,
затем тыльную поверхность их вытирают насухо и просматривают
препараты в ярком отраженном свете.
Наилучшие результаты получаются в тех случаях, когда на одном
стекле появляется от 40 до 100 зон гемолиза.
13.
2.6. Методика КаннингемаВ 1965 г. Каннингем предложил инкубировать лимфоидные клетки и
индикаторные эритроциты в виде монослоя в камере с жидкой
средой.
Этот метод прост, чувствителен и позволяет быстро подсчитать АОК.
Он дает возможность манипулировать с живыми
неповрежденными клетками и изучать их в световом микроскопе.
Камеры для инкубации приготовляют, наклеивая на предметное
стекло (75X25 мм) три узкие полоски двусторонней липкой ленты
так, чтобы поделить поверхность на две равные части.
Сверху плотно накладывают второе предметное стекло, под
которым благодаря полоскам ленты создается узкая щель.
Общий объем двух получившихся камер равен приблизительно 180—
200 мкл.
14.
В лунках микротитратора готовят смесь лимфоидных клеток сэритроцитами следующего состава:
100 мкл СР,
50 мкл суспензии лимфоидных клеток,
20 мкл 8— 10%-ной суспензии бараньих эритроцитов и
20 мкл комплемента морской свинки, предварительно
истощенного бараньими эритроцитами в разведении 1 : 2.
Полученную суспензию перемешивают и с помощью
пастеровской пипетки помещают в обе камеры , которые
затем герметизируют, осторожно погружая края стекол е
расплавленную смесь парафина и воска (1 : 1).
Затем камеры помещают на лоток, инкубируют 2 ч при 37°С и
подсчитывают зоны гемолиза в стереоскопическом
микроскопе.
Подсчет удобнее вести, когда на предметном стекле
появляется не более 100— 200 зон гемолиза. Подсчет зон
следует провести в первые 4 ч после их появления, так как
со временем зоны становятся нечеткими.
15.
3. Правила ТБ при работе в иммунологическойлаборатории
К самостоятельной работе допускаются лица:
не моложе 18 лет,
с законченным высшим или средним
специальным образованием,
прошедшие предварительный медицинский
осмотр
не имеющие противопоказаний,
прошедшие вводный инструктаж по охране
труда и пожарной безопасности, первичный
инструктаж на рабочем месте.
Для работы с электроприборами работник должен
иметь первую группу по электробезопасности.
Два раза в год работник должен пройти
повторный инструктаж по охране труда в объеме
и в сроки, утвержденные приказом директора.
16.
Персонал должен знать правила оказания первоймедицинской помощи при поражении
электрическим током и других несчастных случаях и
при необходимости ее оказывать.
При обнаружении неисправного оборудования или
отсутствии средств индивидуальной защиты
сообщить зав. лабораторией или старшей мед.
сестре лаборатории.
Необходимо соблюдать правила личной гигиены,
санитарно-гигиенический и противоэпидемический
режим.
При подъеме и перемещении тяжести предельно
допустимые нагрузки для женщин – 10 кг, для
мужчин – 50 кг.
Лица, допустившие нарушение инструкций по охране
труда:
подвергаются дисциплинарному взысканию,
внеочередной проверке знания вопросов охраны
труда,
внеплановому инструктажу.
17.
3.1. Требования безопасности перед началомработы
1.При входе в помещение лаборатории сотрудники
обязаны оставлять верхнюю одежду, сумки и др.
личные вещи в отведенном для этого месте.
2.Надеть установленную действующими нормами
спец. одежду и проверить наличие СИЗ.
3.Запрещается хранить в карманах булавки,
стеклянные, режущие, колющие предметы.
4. Убедитесь в исправности вентиляции, проверьте
освещенность рабочего места. Приточновытяжную вентиляцию во всех помещениях
лаборатории необходимо включать не позднее,
чем за 5 мин до начала работы.
18.
3.2. Требования безопасности во время работы1.Рабочее место должно содержаться в чистоте и
порядке, иметь достаточное освещение.
2.При работе необходимо применять положенные
средства индивидуальной защиты. Во избежание
травм не носить обувь на высоком каблуке и
скользящей подошве.
3.Выход из лаборатории в спец. одежде запрещен.
4.Пить воду, хранить и принимать пищу,
пользоваться книгами, хранить личные вещи
разрешается только в специально отведенном
месте.
5.При микроскопировании необходимо обеспечить
правильное освещение поля зрения,
предусмотренное для данного микроскопа , не
закрывать неработающий глаз, работать
попеременно то одним, то другим глазом и
делать перерывы в работе при утомлении глаз.
19.
Требования ТБ при мытье лабораторной посуды1.Стеклянную посуду моют различными способами:
очищают механически с помощью ершей, затем обрабатывают
химическим путем.
погружают в мыльный содовый раствор.
2.Перед мытьем посуды хромовой смесью ее необходимо
промыть водой во избежание взрыва и выбрасывания
продукта реакции. При мытье пипеток хромовой смесью,
она набирается в них при помощи резиновой груши.
Меры безопасности при мытье посуды кислотой или щелочью
такие же как и при работе с кислотами и щелочами.
1.После мытья посуду необходимо промыть большим
количеством воды, так как моющие растворы могут дать при
смешивании опасные соединения.
2.Лабораторную посуду, содержащую растворы едких
веществ, во избежание ожогов пальцев рук следует мыть в
резиновых перчатках.
3.Отобранные горячие жидкости (отходы) собирают в
герметически закрывающуюся тару и передают для
регенерации или уничтожения. Спуск в канализацию
запрещается.
20.
Требования безопасности при проведении исследований синфекционным материалом.
Личные вещи хранить только в специально отведенных для
этого местах, использовать СИЗ.
Тщательно выполнять правила личной гигиены:
дезинфицировать и мыть руки с мылом всякий раз при
выходе из помещений, перед едой и смене работы.
(Дезинфицирующие растворы: 2% раствор перекиси
водорода, 70 о этиловый спирт).
При работе с кровью пациентов пользоваться только
автоматическими пипетками.
При загрязнении кровью спецодежды или рабочего места,
надо застирать одежду, вымыть стол и руки 3% перекисью
водорода.
Для дезинфекции различных лабораторных объектов в
работе пользоваться 1 – 3% раствором хлорамина или
аналитом, автоклавированием и кипячением.
Текущую уборку помещений лаборатории проводить только
с применением дез. растворов.
Воздух в помещении боксов периодически должен
подвергаться дезинфекции с помощью бактерицидных ламп.
21.
В целях безопасности в помещениилаборатории запрещается:
Оставлять без присмотра зажженные спиртовки
и включенные электронагревательные приборы,
держать вблизи горящих спиртовок вату,
марлю, спирт и др. легковоспламеняющиеся
вещества.
Убирать случайно пролитые огнеопасные
жидкости при зажженных горелках и
включенных электронагревательных приборах.
Наливать в горящую спиртовку спирт,
пользоваться спиртовкой, не имеющей
металлической трубки и шайбы для фитиля.
Держать голову под тягой при работе в
вытяжном шкафу.
Пробовать на вкус и вдыхать неизвестные
вещества.
22.
Наклонять голову над сосудом, в которомналита или кипит какая-либо жидкость.
Хранить и использовать реактивы без этикеток.
Хранить запасы сильнодействующих,
взрывоопасных веществ и растворов на рабочих
столах и стеллажах.
Хранить личную одежду в помещениях
лаборатории, а также уносить спец. одежду
домой.
Работать без специальной санитарной одежды и
установленных предохранительных
приспособлений.
Выполнять работы, не связанные с заданием и
не предусмотренные рабочими инструкциями.
23.
Требования безопасности в аварийныхситуациях
При пожаре действовать по инструкции
При прекращении подачи электроэнергии
выключить все включенное в сеть
электрооборудование. Пользоваться
электрическими фонарями.
При внезапном появлении на корпусе
электромедицинского изделия или другого
электроприбора электрического тока
необходимо его немедленно выключить и
сообщить зав. лабораторией.
24.
Домашнее задание:Конспект лекции №9.
Теоретический материал учебника под
ред. А.А.Воробьева, В.В.Зверева
Основы микробиологии, вирусологии,
иммунологии, стр. 137-138.
Спасибо за внимание!























 medicine
medicine








