Similar presentations:
Общая характеристика щелочных металлов. 9 класс
1.
Казенноеучреждение
Казенноеобщеобразовательное
общеобразовательное учреждение
Ханты-Мансийского
автономного
округа
- Югры
Ханты-Мансийского автономного
округа
- Югры
«Вечерняя(сменная)
(сменная) общеобразовательная
школа»
«Вечерняя
общеобразовательная
школа»
«Общая
«Общаяхарактеристика
характеристика
щелочных
щелочныхметаллов».
металлов».
9 9класс
класс
По
По программе
программе Габриеляна
Габриеляна О.С.
О.С.
Сургут-2016
Сургут-2013
2.
3.
4.
5.
11.
2.
2
3
4
3.
5
4.
5.
Процесс
отдачи
электрона.
Бинарное
соединение,
состоящее из атомов двух
химических
элементов,
один
из
которых
кислород.
Простые
вещества,
обладающие
общими
физическими свойствами:
электропроводность,
теплопроводность,
ковкость, пластичность.
Положительно
заряженный ион.
Химический
элемент,
существование которого
предсказал
Д.И.
Менделеев, назвав его
экасилицием.
6.
1 О К И С Л Е Н И Е1.
2.
2
3
4
3.
5
4.
5.
Процесс
отдачи
электрона.
Бинарное
соединение,
состоящее из атомов двух
химических
элементов,
один
из
которых
кислород.
Простые
вещества,
обладающие
общими
физическими свойствами:
электропроводность,
теплопроводность,
ковкость, пластичность.
Положительно
заряженный ион.
Химический
элемент,
существование которого
предсказал
Д.И.
Менделеев, назвав его
экасилицием.
7.
1 О К И С Л Е Н И Е2 О К С И Д
1.
2.
3
4
3.
5
4.
5.
Процесс
отдачи
электрона.
Бинарное
соединение,
состоящее из атомов двух
химических
элементов,
один
из
которых
кислород.
Простые
вещества,
обладающие
общими
физическими свойствами:
электропроводность,
теплопроводность,
ковкость, пластичность.
Положительно
заряженный ион.
Химический
элемент,
существование которого
предсказал
Д.И.
Менделеев, назвав его
экасилицием.
8.
1 О К И С Л Е Н И Е2 О К С И Д
1.
2.
3 М Е Т А Л Л Ы
4
3.
5
4.
5.
Процесс
отдачи
электрона.
Бинарное
соединение,
состоящее из атомов двух
химических
элементов,
один
из
которых
кислород.
Простые
вещества,
обладающие
общими
физическими свойствами:
электропроводность,
теплопроводность,
ковкость, пластичность.
Положительно
заряженный ион.
Химический
элемент,
существование которого
предсказал
Д.И.
Менделеев, назвав его
экасилицием.
9.
1 О К И С Л Е Н И Е2 О К С И Д
1.
2.
3 М Е Т А Л Л Ы
4 К А Т И О Н
3.
5
4.
5.
Процесс
отдачи
электрона.
Бинарное
соединение,
состоящее из атомов двух
химических
элементов,
один
из
которых
кислород.
Простые
вещества,
обладающие
общими
физическими свойствами:
электропроводность,
теплопроводность,
ковкость, пластичность.
Положительно
заряженный ион.
Химический
элемент,
существование которого
предсказал
Д.И.
Менделеев, назвав его
экасилицием.
10.
1 О К И С Л Е Н И Е2 О К С И Д
1.
2.
3 М Е Т А Л Л Ы
4 К А Т И О Н
3.
5 Г Е Р М А Н И Й
4.
5.
Процесс
отдачи
электрона.
Бинарное
соединение,
состоящее из атомов двух
химических
элементов,
один
из
которых
кислород.
Простые
вещества,
обладающие
общими
физическими свойствами:
электропроводность,
теплопроводность,
ковкость, пластичность.
Положительно
заряженный ион.
Химический
элемент,
существование которого
предсказал
Д.И.
Менделеев, назвав его
экасилицием.
11.
Цель урока:- дать общую
характеристику
щелочных металлов;
- повторить основные
закономерности
изменения свойств
элементов в
Периодической системе
по вертикали.
12.
ЗАДАЧАЗАДАЧА
ЗАДАЧА
ЗАДАЧА
ЗАДАЧА
ЗАДАЧА
№1:
№2:
№3:
№4:
№5:
№6:
13.
ЗАДАЧА № 1: рассмотретьстроение атомов
ЗАДАЧА №2: рассмотреть
нахождение в природе
ЗАДАЧА №3: рассмотреть
физические свойства
ЗАДАЧА №4: рассмотреть
химические свойства
ЗАДАЧА №5: рассмотреть
историю открытия
ЗАДАЧА №6: рассмотреть
применение
14.
заряд ядра15.
заряд ядраколичество
электронов
16.
номер периода17.
количествоэнергетических
уровней
номер периода
18.
+3Li 1s- 2s↑↓
↑
+--
Na 1s- 2s-
+--
К
2e
2p-
-
…e
-
2p-
...e
-
3s- 3p-
...e
-
?
19.
2Li
1s
+3
2s1
↑↓
↑
2
Na
1s
+11
2s2
2p6
↑↓
↑↓
↑↓
+19
2p0
3s1
↑↓
К
2e
-
8e
-
8e
-
1e
-
↑↓
↑
3p0
20.
LiNa
К
Rb
Cs
Fr
155 пм*
190 пм
235 пм
248 пм
267 пм
290 пм
*1 пикометр = 10-12 м ( одна трилионная часть метра)
21.
ИССЛЕДОВАТЕЛЬСКИЕ ГРУППЫГЕОЛОГИ
БИОЛОГИ
ФИЗИКИ
ИСТОРИКИ
22.
Цель: выяснить областираспространения
щелочных металлов
Порядок действий.
1.
2.
Прочитайте тексты.
В инструкции по проведению исследования
обозначьте количественные характеристики
распространенности и мирового производства
щелочных металлов.
23.
Цель: выяснить содержаниещелочных металлов
в живой природе
Порядок действий.
1.
2.
3.
Прочитайте тексты.
В инструкции по проведению исследования внесите
сведения о содержании щелочных металлов в живых
организмах и о применении щелочных металлов
человеком.
Подготовьте устный отчет.
24.
Цель: смоделировать металлическуюкристаллическую решетку
и показать физические свойства металлов
Распределение ролей среди участников группы:
-
узлы кристаллической решетки – 6 человек;
электроны – 2 человека;
катод, огонь – 1 человек;
анод, молоток – 1 человек.
Порядок действий.
1. «Постройте» металлическую кристаллическую решетку.
2. Продемонстрируйте физические свойства металлов:
а) электропроводность;
б) теплопроводность;
в) ковкость.
3. Подготовьте устный отчет об особенностях физических свойств щелочных металлов.
25.
Цель: подготовить историческуюсправку об открытии
щелочных металлов
Порядок действий.
1.
2.
3.
Прочитайте тексты.
В инструкции по проведению исследования внесите
сведения об открытии щелочных металлов.
Подготовьте устный отчет.
26.
27.
28.
ЧТО ОБЩЕГО В СТРОЕНИИ АТОМОВЩЕЛОЧНЫХ МЕТАЛЛОВ?
29.
Строение электронных оболочек+3 Li
2s1
2p0
↑
+11
Na
3s1
3p0
↑
+19
К
4s1
4p0
↑
+37Rb
5s1
↑
5p0
30.
КАК ЭТО ОТРАЖАЕТСЯ НА ИХХИМИЧЕСКИХ СВОЙСТВАХ?
31.
Ме – е- = Ме+АКТИВНЫЕ
ВОССТАНОВИТЕЛИ!
Cs
Rb
K
Na
Li
32.
ЩЕЛОЧНЫЕ МЕТАЛЛЫоксиды (пероксиды), гидриды, хлориды, фториды,
сульфиды, нитриды, фосфиды, гидроксиды
НЕМЕТАЛЛЫ (О2, Н2, Сl2, F2,S, N2, Р)
Li
Na
K
ВОДА (Н2О)
Rb
Cs
33.
1. Взаимодействие с неметаллами:А) водородом;
Б) галогенами;
В) серой;
Г) азотом;
Д) фосфором.
Д) кислородом.
2. Взаимодействие с водой.
34.
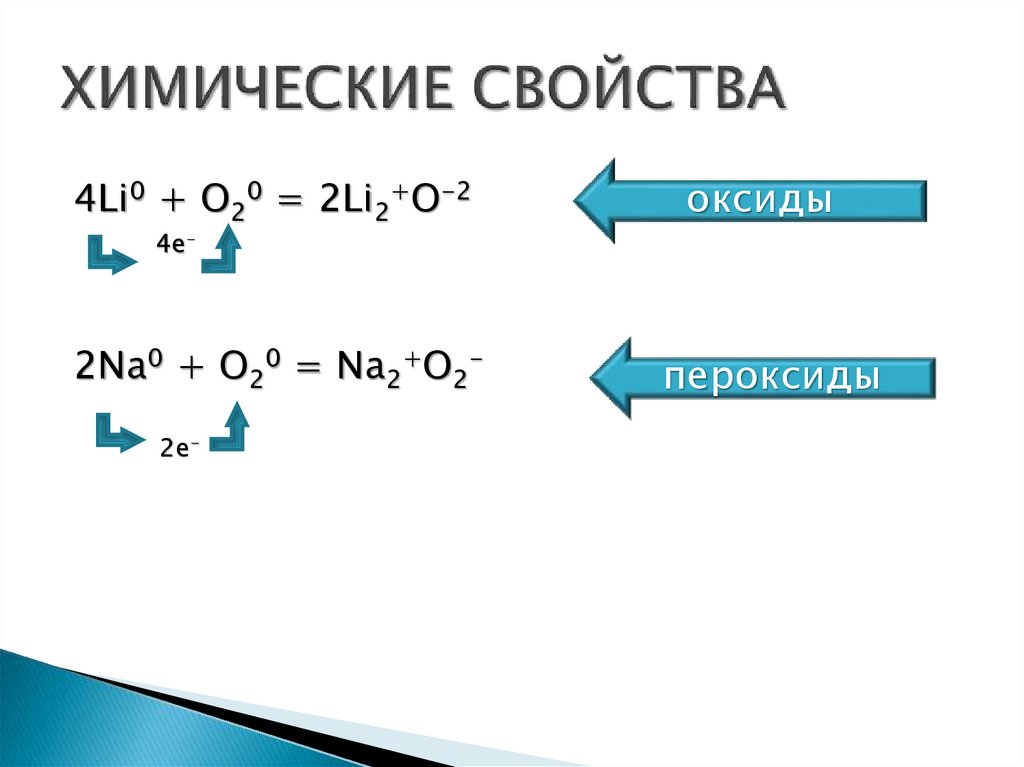
4Li0 + O20 = 2Li2+O-2оксиды
4е-
2Na0 + O20 = Na2+O22е-
пероксиды
35.
ХИМИЧЕСКИЕ СВОЙСТВАLi0 + Сl20 = ?
галогениды
?
Na0 + Н20 = ?
гидриды
?
К0 + S 0 = ?
сульфиды
?
Na0 + P0 = ?
?
фосфиды
36.
ХИМИЧЕСКИЕ СВОЙСТВА2Li0 + Сl20 = 2Li+Сl-
галогениды
2е-
2Na0 + Н20 = 2Na+H-
гидриды
2е-
2К0 + S0 = K2+S-2
сульфиды
2e-
3Na0 + P0 = Na3+P-3
3e-
фосфиды
37.
Na0 + Н+2О -2 = ??
гидроксид
38.
2Na0 + Н+2О -2 = 2Na+ОН- + Н20↑2е-
39.
Ме – е- = Ме+Fr
Cs
Rb
K
Na
Li
40.
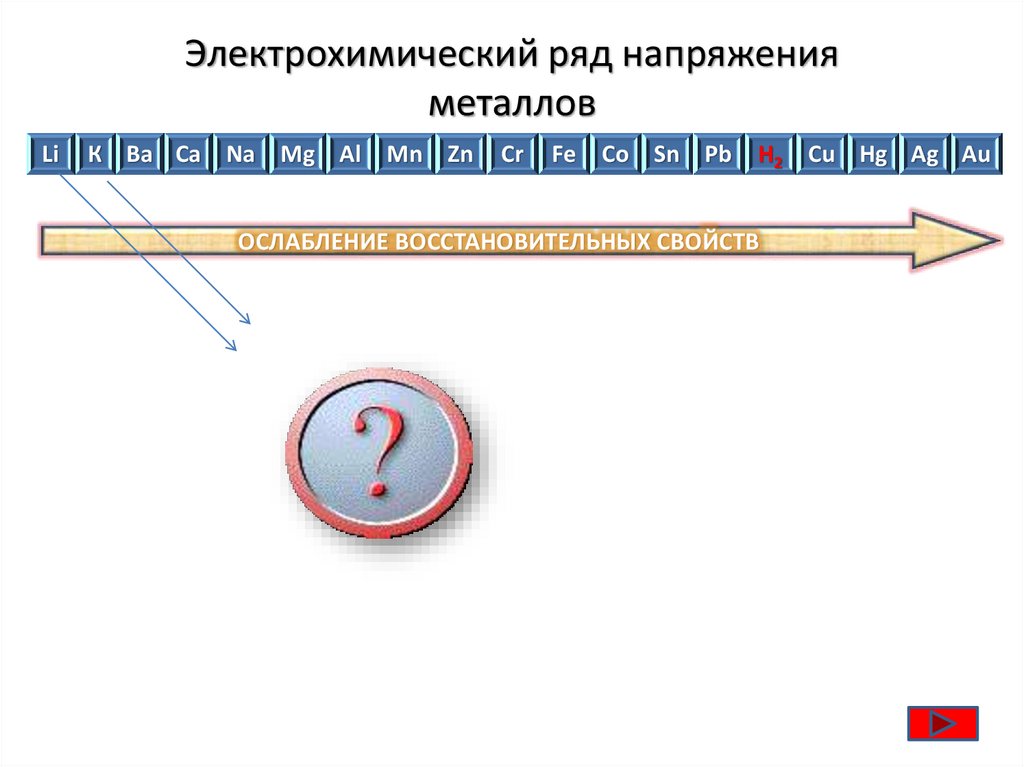
Электрохимический ряд напряженияметаллов
Li
К Ba Ca Na Mg Al Mn Zn
Cr
Fe
Co Sn Pb H2 Cu Hg Ag Au
ОСЛАБЛЕНИЕ ВОССТАНОВИТЕЛЬНЫХ СВОЙСТВ
41.
Электрохимический ряд напряженияметаллов
Li
К Ba Ca Na Mg Al Mn Zn
Cr
Fe
Co Sn Pb H2 Cu Hg Ag Au
ОСЛАБЛЕНИЕ ВОССТАНОВИТЕЛЬНЫХ СВОЙСТВ
ПРИ ОПРЕДЕЛЕНИИ ПОЛОЖЕНИЯ МЕТАЛЛА В
РЯДУ НАПРЯЖЕНИЙ УЧИТЫВАЮТ НЕ ТОЛЬКО
ЭНЕРГИЮ ОТРЫВА ЭЛЕКТРОНА ОТ АТОМА, НО И
ЭНЕРГИЮ, ЗАТРАЧИВАЕМУЮ НА РАЗРУШЕНИЕ
КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ, А ТАКЖЕ ЭНЕРГИЮ,
ВЫДЕЛЯЮЩУЮСЯ ПРИ ГИДРАТАЦИИ ИОНОВ.
42.
Знакхимического
элемента
Q*, кДж
tпл., 0С
ρ, г/см2
Атомный радиус,
пм
Электроотрицательность
по Полингу
Li
223
180,5
0,54
155
0,98
Na
184
98
0,97
190
0,93
К
197
63,5
0,86
235
0,82
Rb
180
39,5
1,52
248
0,82
Cs
190
28
1,90
267
0,79
43.
1)атомный номер
2) атомный радиус
3) электроотрицательность
4) число валентных электронов
44.
1)2,
2) 2,
3) 2,
4) 2,
8,
8,
8,
8,
8, 2
18, 1
8, 1
18, 2
45.
1)электронных энергетических
уровней
2) протонов и нейтронов
3) электронов на втором
энергетическом уровне
4) валентных электронов
46.
1)не изменяется
2) возрастает
3) изменяется
периодически
4) ослабевает
47.
1)оксид металла и водород
2) гидроксид металла и
водород
3) гидроксид металла
4) гидрид металла и кислород
48.
1)Li
2) Na
3) K
4) Rb
49.
1)водой и углекислым газом
2) хлором и водой
3) хлоридом калия и серой
4) водородом и диоксидом
серы
50.
1)разложением оксида калия
2) взаимодействием хлорида
калия с железом
3) электролизом расплавов
хлорида или гидроксида
калия
4) термическим разложением
нитрата калия
51.
8тестов «+» - 5 баллов;
7 – 6 тестов «+» - 4 балла;
5 – 4 теста «+» - 3 балла.
52.
Правильныеварианты
ответов
Тест
№
1
2
3
4
5
6
7
8
3
3
4
2
2
1
3
3
53.
Верно ли, что:… все щелочные металлы были открыты в XIX
веке?
… название цезия произошло от латинского
слова «изумрудно-зеленый»?
… франций – единственный щелочной металл,
не существующий в естественных условиях?
… от строения кристаллической решетки
зависят физические свойства металлов?
… для живых организмов особое значение имеет
калий?
54.
Реконструктивная форма: выучить материал поучебнику – параграф 11 (стр. 44-45). Выполнить
упражнение №1, решить задачу №2 (стр. 48, 49).
Исследовательская форма: напишите «досье» на
любой щелочной металл, используя материалы
урока, учебник, любой дополнительный
источник информации.
55.
ВСЕМСПАСИБО
ЗА РАБОТУ!!!




















































 chemistry
chemistry








