Similar presentations:
Комплексные соединения
1.
КОМПЛЕКСНЫЕСОЕДИНЕНИЯ
2.
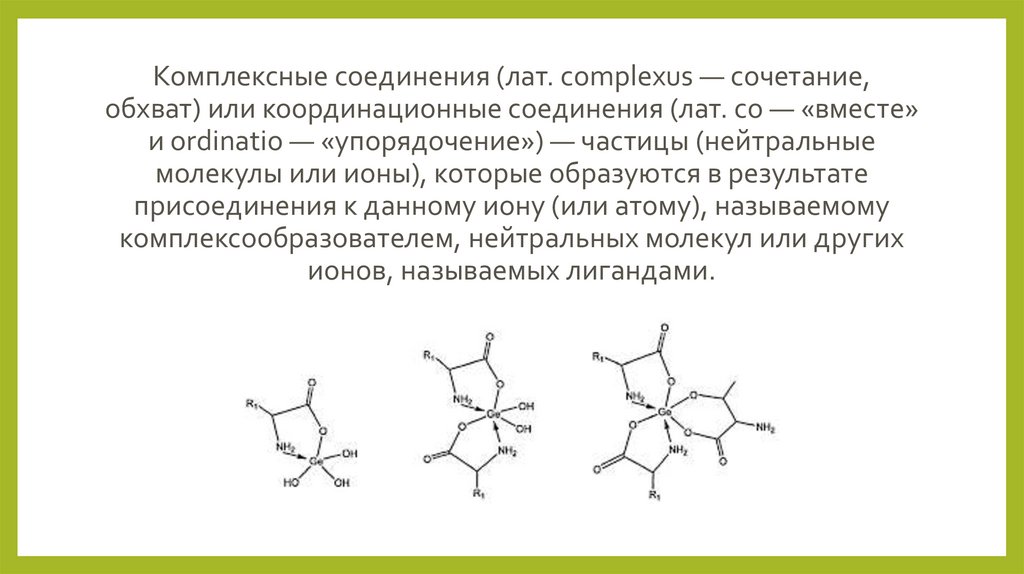
Комплексные соединения (лат. complexus — сочетание,обхват) или координационные соединения (лат. co — «вместе»
и ordinatio — «упорядочение») — частицы (нейтральные
молекулы или ионы), которые образуются в результате
присоединения к данному иону (или атому), называемому
комплексообразователем, нейтральных молекул или других
ионов, называемых лигандами.
3.
4.
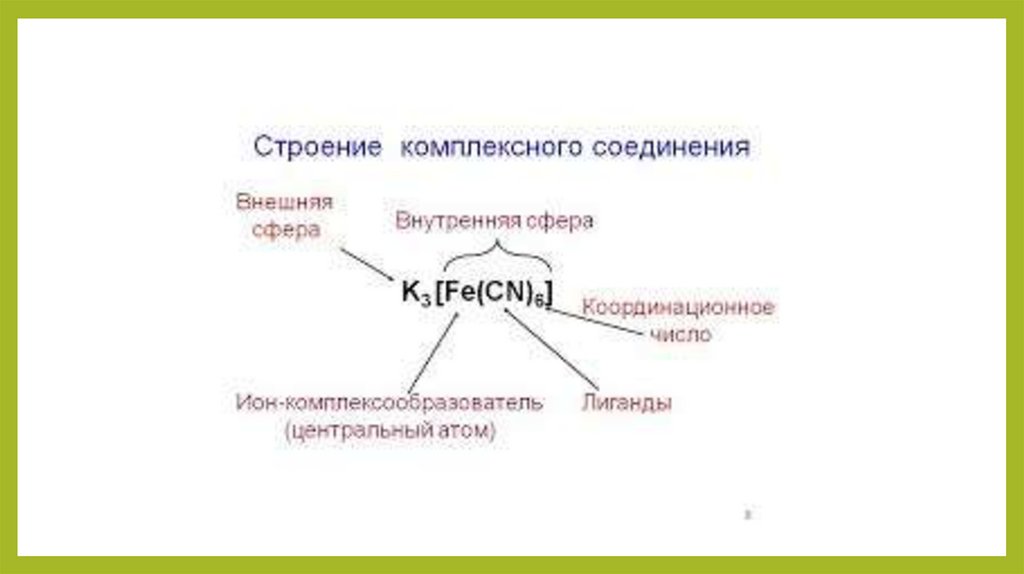
Основные терминыЛиганды — атомы или изолированные группы атомов,
располагающиеся вокруг комплексообразователя.
Внутренняя сфера — центральный атом со связанными с ним
лигандами, то есть, собственно, комплексная частица.
Внешняя сфера комплексного соединения — остальные частицы,
связанные с комплексной частицей ионной
или межмолекулярными связями, включая водородные.
Координационное число — число связей, образуемых
центральным атомом с лигандами.
Комплексообразователь — центральный атом комплексной
частицы.
5.
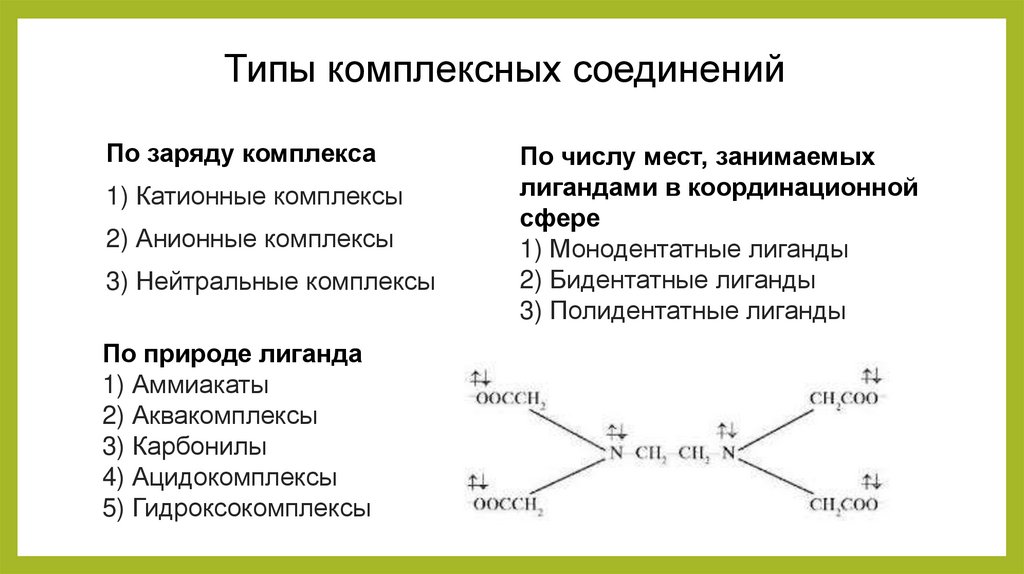
Типы комплексных соединенийПо заряду комплекса
1) Катионные комплексы
2) Анионные комплексы
3) Нейтральные комплексы
По природе лиганда
1) Аммиакаты
2) Аквакомплексы
3) Карбонилы
4) Ацидокомплексы
5) Гидроксокомплексы
По числу мест, занимаемых
лигандами в координационной
сфере
1) Монодентатные лиганды
2) Бидентатные лиганды
3) Полидентатные лиганды
6.
Номенклатура• 1) В названии кс первым указывают отрицательно заряженную часть — анион,
затем положительную часть — катион.
• 2) Название комплексной части начинают с указания состава внутренней
сферы. Во внутренней сфере прежде всего называют лиганды — анионы,
прибавляя к их латинскому названию окончание «о».
• 3) Число монодентатных лигандов : 1 — моно , 2 — ди, 3 — три, 4 — тетра, 5 —
пента, 6 — гекса. Для полидентатных лигандов используют бис-, трис-,
тетракис- и т. д.
• 4) Затем называют комплексообразователь, используя корень его латинского
названия и окончание -ат, после чего римскими цифрами указывают (в
скобках) степень окисления комплексообразователя.
• 5) После обозначения состава внутренней сферы называют внешнюю сферу.
• 6) В названии нейтральных комплексных частиц комплексообразователь
указывается в именительном падеже, а степень его не указывается, так как она
однозначно определяется, исходя из электронейтральности комплекса.
7.
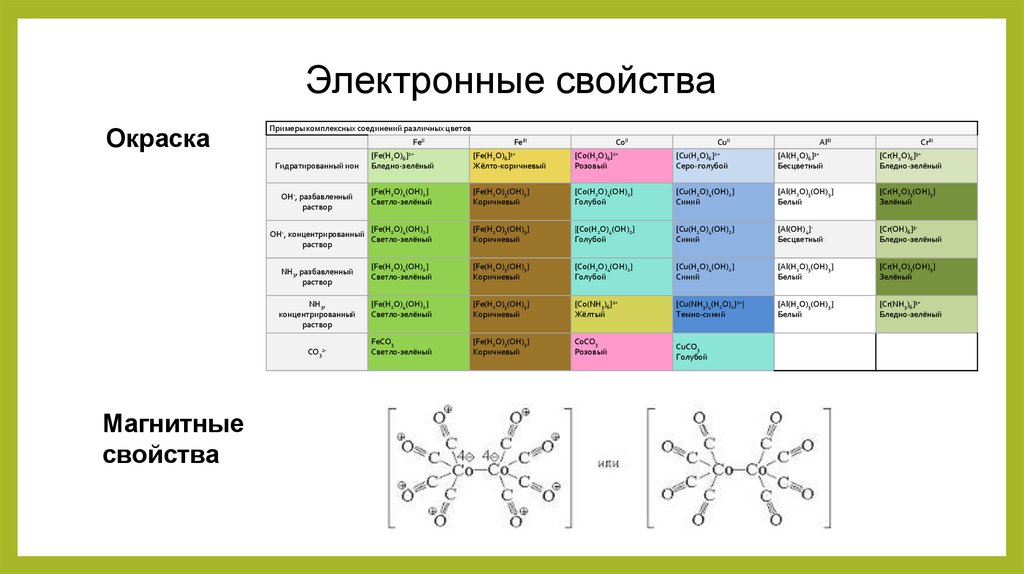
Электронные свойстваОкраска
Примеры комплексных соединений различных цветов
FeII
CoII
CuII
AlIII
CrIII
[Fe(H2O)6]3+
[Co(H2O)6]2+
[Cu(H2O)6]2+
[Al(H2O)6]3+
[Cr(H2O)6]3+
Бледно-зелёный
Жёлто-коричневый
Розовый
Серо-голубой
Бесцветный
Бледно-зелёный
[Fe(H2O)4(OH)2]
Светло-зелёный
[Fe(H2O)3(OH)3]
Коричневый
[Co(H2O)4(OH)2]
Голубой
[Cu(H2O)4(OH)2]
Синий
[Al(H2O)3(OH)3]
Белый
[Cr(H2O)3(OH)3]
Зелёный
[Fe(H2O)4(OH)2]
OH-, концентрированный
Светло-зелёный
раствор
[Fe(H2O)3(OH)3]
Коричневый
|[Co(H2O)4(OH)2]
Голубой
[Cu(H2O)4(OH)2]
Синий
[Al(OH)4]Бесцветный
[Cr(OH)6]3Бледно-зелёный
[Fe(H2O)4(OH)2]
Светло-зелёный
[Fe(H2O)3(OH)3]
Коричневый
[Co(H2O)4(OH)2]
Голубой
[Cu(H2O)4(OH)2]
Синий
[Al(H2O)3(OH)3]
Белый
[Cr(H2O)3(OH)3]
Зелёный
[Fe(H2O)4(OH)2]
Светло-зелёный
[Fe(H2O)3(OH)3]
Коричневый
[Co(NH3)6]2+
Жёлтый
[Cu(NH3)4(H2O)2]2+|
Темно-синий
[Al(H2O)3(OH)3]
Белый
[Cr(NH3)6]3+
Бледно-зелёный
FeCO3
Светло-зелёный
[Fe(H2O)3(OH)3]
Коричневый
CoCO3
Розовый
Гидратированный ион
OH-, разбавленный
раствор
NH3, разбавленный
раствор
NH3,
концентрированный
раствор
CO32-
Магнитные
свойства
FeIII
[Fe(H2O)6]2+
CuCO3
Голубой
8.
Применение• Комплексные соединения находят широкое применение в различных
отраслях промышленности.
• Широкое применение комплексные соединения получили
в аналитической химии в качестве индикаторов.
• Многие КС обладают каталитической активностью, поэтому их широко
используют в неорганическом и органическом синтезах.




 chemistry
chemistry








