Similar presentations:
Строение атома. Периодический закон и система элементов Д.И. Менделеева. Химическая связь. Гибридизация
1.
СТРОЕНИЕ АТОМА.ПЕРИОДИЧЕСКИЙ ЗАКОН И
СИСТЕМА ЭЛЕМЕНТОВ Д.И.
МЕНДЕЛЕЕВА. ХИМИЧЕСКАЯ
СВЯЗЬ. ГИБРИДИЗАЦИЯ.
Семинар подготовила: к.х.н. доцент Солодова Е.В.
2.
ЯДРО АТОМА СОСТОИТ ИЗ ПРОТОНОВИ НЕЙТРОНОВ
(ОБЩЕЕ НАЗВАНИЕ – НУКЛОНЫ)
3.
Нуклиды с одинаковым числом Z называются изотопы.12
14
6С и 6С
Нуклиды с одинаковым числом А называются изобары.
14
14
С
и
N
7
6
Нуклиды с одинаковым числом N называются изотоны
31
32
15 P и 16 S
4.
КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬАТОМА
n – главное квантовое число
Е
n = 1, 2, 3, 4 …
n=4
n=3
n=2
n=1
5.
l – орбитальное квантовое числоl = 0, 1, … n – 1
Значение l
0
1
2
3
4
Обозначение
(подуровень)
s
p
d
f
g
z
y
n = 1 l = 0 (1s-подуровень)
n = 2 l = 0 (2s-подуровень)
x
l = 1 (2p-подуровень)
s-орбиталь
6.
ML – МАГНИТНОЕ КВАНТОВОЕЧИСЛО
ML = L …0 …+L
l = 0 ml = 0
l = 1 ml = 1, 0, +1
z
y
z
z
px-орбиталь
y
x
x
x
pz-орбиталь
y
py-орбиталь
7.
MS – СПИНОВОЕ КВАНТОВОЕ ЧИСЛОMS= ½ ИЛИ + ½
электроны
Представление атомных орбиталей в
виде квантовых ячеек:
1s
2p
3d
8.
СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК АТОМОВПринцип Паули
В атоме не может быть двух электронов с одинаковым
набором четырех квантовых чисел
Следствия:
1) На одной орбитали не может находиться более двух электронов;
2) Общее число электронов на энергетическом уровне равно 2n2;
3) Максимальное число электронов, находящихся на
энергетическом подуровне, равно 2 (2l + 1)
9.
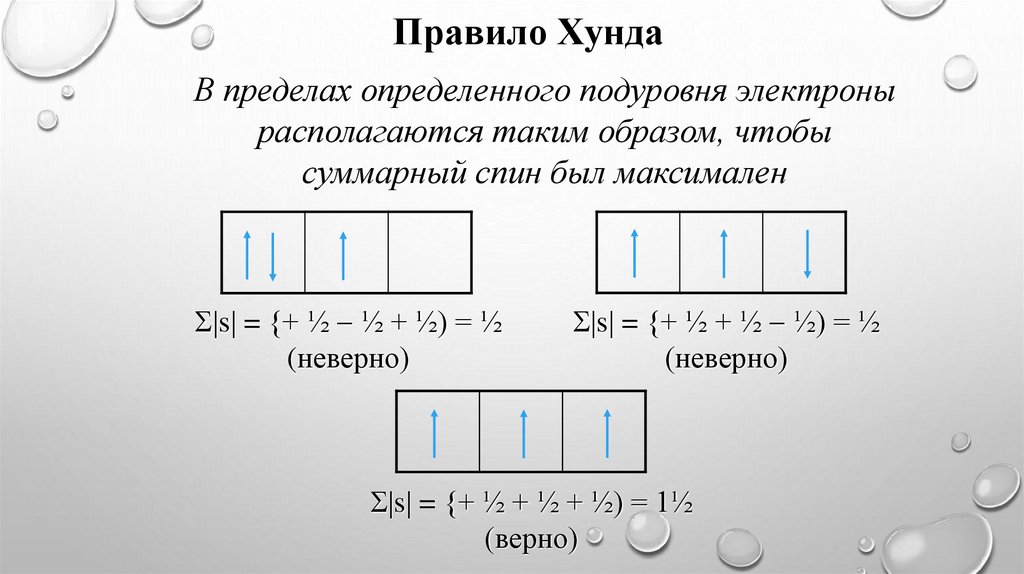
Правило ХундаВ пределах определенного подуровня электроны
располагаются таким образом, чтобы
суммарный спин был максимален
s = {+ ½ ½ + ½) = ½
(неверно)
s = {+ ½ + ½ ½) = ½
(неверно)
s = {+ ½ + ½ + ½) = 1½
(верно)
10.
Принцип наименьшей энергииКаждый электрон занимает свободную
орбиталь с самой низкой энергией
Е n+l
Правила Клечковского:
1) Атомные орбитали заполняются электронами в порядке
последовательного увеличения суммы n + l;
2) При одинаковом значении этой суммы заполнение электронных
уровней происходит в порядке последовательного увеличения n
1s < 2s < 2p < 3s < 3p < 4s 3d < 4p < 5s 4d <
< 5p < 6s 5d 4f < 6p < 7s 6d 5f < 7p
11.
1Hn = 1, l = 0, ml = 0, ms = ½
или 1s1
2He
n = 1, l = 0, ml = 0, ms = + ½
n = 1, l = 0, ml = 0, ms = ½
или 1s2
3Li
n = 2, l = 0, ml = 0, ms = ½
или 1s22s1
12.
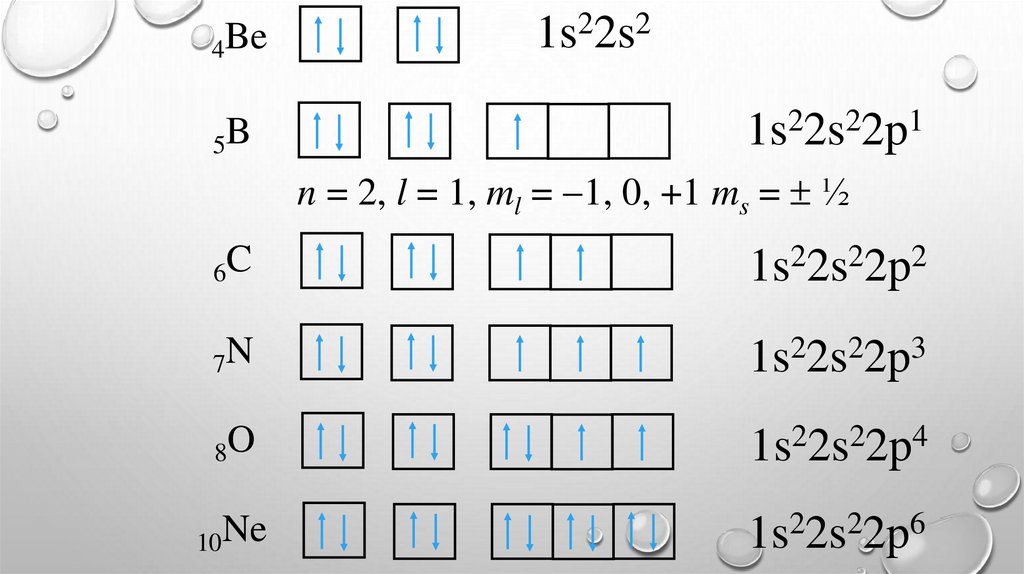
4Be5B
1s22s2
2
2
1
1s 2s 2p
n = 2, l = 1, ml = 1, 0, +1 ms = ½
6C
1s22s22p2
7N
2
2
3
1s 2s 2p
8O
1s22s22p4
10Ne
1s22s22p6
13.
1s22s22p63s23p6 ???3d: n + l = 3 + 2 = 5
4s: n + l = 4 + 0 = 4
19K
1s22s22p63s23p6 3d04s1 или [Ar]4s1
18Ar
20Ca
2
2
6
2
6
0
2
1s 2s 2p 3s 3p 3d 4s
21Sc
1s22s22p63s23p6 3d14s2
14.
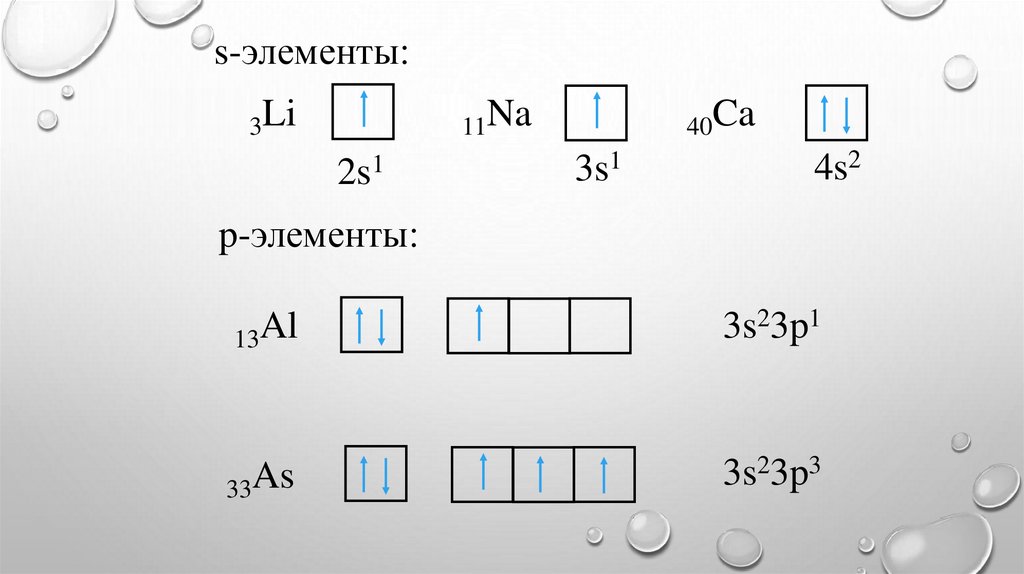
s-элементы:3Li
11Na
2s1
40Ca
3s1
4s2
p-элементы:
13Al
3s23p1
33As
3s23p3
15.
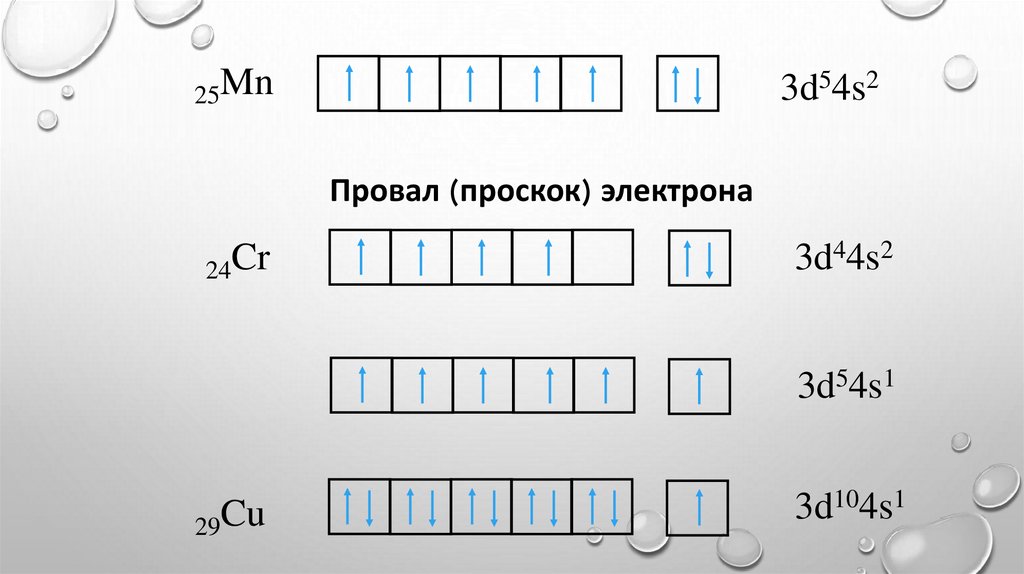
25Mn3d54s2
Провал (проскок) электрона
24Cr
3d44s2
3d54s1
29Cu
3d104s1
16.
ПЕРИОДИЧЕСКИЙ ЗАКОН (Д.И. МЕНДЕЛЕЕВ, 1869)• ХИМИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ, А
ТАКЖЕ СВОЙСТВА И ФОРМЫ СОЕДИНЕНИЙ
ЭЛЕМЕНТОВ НАХОДЯТСЯ В ПЕРИОДИЧЕСКОЙ
ЗАВИСИМОСТИ ОТ ЗАРЯДА ЯДРА АТОМОВ
ЭЛЕМЕНТОВ
17.
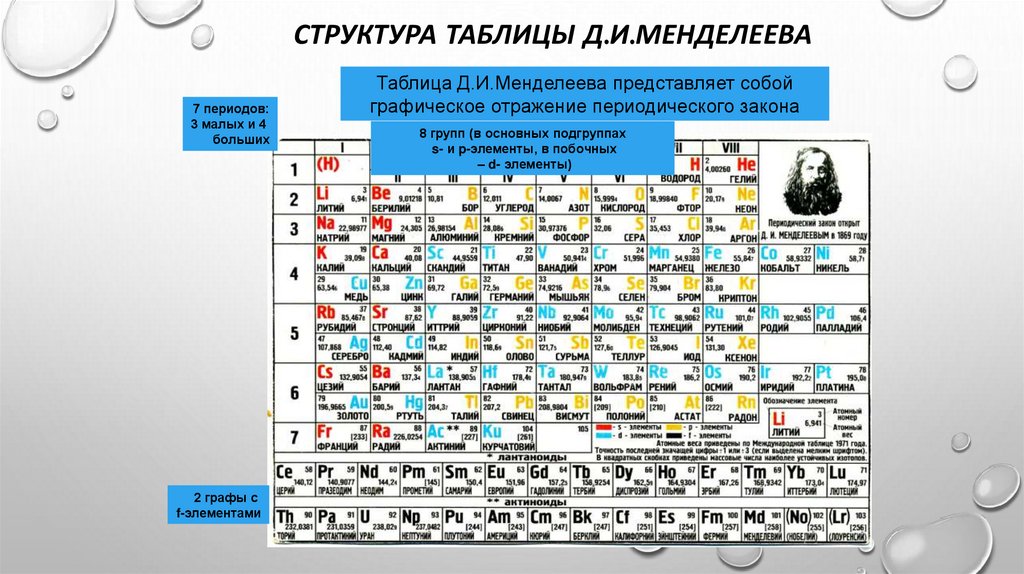
СТРУКТУРА ТАБЛИЦЫ Д.И.МЕНДЕЛЕЕВА7 периодов:
3 малых и 4
больших
Таблица Д.И.Менделеева представляет собой
графическое отражение периодического закона
8 групп (в основных подгруппах
s- и p-элементы, в побочных
– d- элементы)
2 графы с
f-элементами
17
18.
СТРУКТУРА ПЕРИОДИЧЕСКОЙ СИСТЕМЫХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
• ПЕРИОД – ГОРИЗОНТАЛЬНЫЙ РЯД ЭЛЕМЕНТОВ,
РАСПОЛОЖЕННЫХ В ПОРЯДКЕ ВОЗРАСТАНИЯ
ПОРЯДКОВОГО НОМЕРА ОТ ПЕРВОГО S-ЭЛЕМЕНТА (NS1)
ДО ШЕСТОГО P-ЭЛЕМЕНТА(NS2NP6)
• КАЖДЫЙ ПЕРИОД НАЧИНАЕТСЯ АКТИВНЫМ ЩЕЛОЧНЫМ
МЕТАЛЛОМ И ЗАКАНЧИВАЕТСЯ ИНЕРТНЫМ ГАЗОМ
19.
• ПЕРИОДЫ:• 1) МАЛЫЕ – 1-Й (2 ЭЛЕМЕНТА), 2-Й И 3-Й(8
ЭЛЕМЕНТОВ)
• 2) БОЛЬШИЕ – 4-Й, 5-Й (18 ЭЛЕМЕНТОВ) 6-Й
(32 ЭЛЕМЕНТА) 7-Й (19 ЭЛЕМЕНТОВ,
НЕЗАВЕРШЕННЫЙ)
• СОСТОЯТ ИЗ 2-Х РЯДОВ:
• ЧЕТНЫЙ СОДЕРЖИТ ТОЛЬКО МЕТАЛЛЫ;
• НЕЧЕТНЫЙ СОДЕРЖИТ МЕТАЛЛЫ И
НЕМЕТАЛЛЫ
20.
ГРУППЫ – ВЕРТИКАЛЬНЫЕ РЯДЫ.НОМЕР ГРУППЫ ОПРЕДЕЛЯЕТ МАКСИМАЛЬНУЮ
ВАЛЕНТНОСТЬ ЭЛЕМЕНТА, МАКСИМАЛЬНУЮ
ПОЛОЖИТЕЛЬНУЮ СТЕПЕНЬ ОКИСЛЕНИЯ, ЧИСЛО
ВАЛЕНТНЫХ ЭЛЕКТРОНОВ (ИСКЛЮЧЕНИЯ КИСЛОРОД И
ФТОР).
• ГРУППЫ ДЕЛЯТСЯ НА ПОДГРУППЫ.
• ПОДГРУППА – ЭТО ВЕРТИКАЛЬНЫЙ РЯД ЭЛЕМЕНТОВ,
ИМЕЮЩИХ ОДНОТИПНОЕ ЭЛЕКТРОННОЕ СТРОЕНИЕ И
ЯВЛЯЮЩИХСЯ ЭЛЕКТРОННЫМИ АНАЛОГАМИ.
21.
КЛАССИФИКАЦИЯ АТОМОВ1. ПО СПОСОБУ ЗАСТРАИВАНИЯ ЭЛЕКТРОННОЙ ОБОЛОЧКИ:
S-ЭЛЕМЕНТЫ. ЗАПОЛНЯЕТСЯ S-ПОДУРОВЕНЬ НАРУЖНОГО СЛОЯ.
ВНУТРЕННИЕ ЭЛЕКТРОННЫЕ СЛОИ ОСТАЮТСЯ НЕИЗМЕННЫМИ.
ЭТО ДВА ПЕРВЫЕ ЭЛЕМЕНТА ЛЮБОГО ПЕРИОДА
P-ЭЛЕМЕНТЫ. ЗАПОЛНЯЕТСЯ Р-ПОДУРОВЕНЬ НАРУЖНОГО СЛОЯ.
ВНУТРЕННИЕ ЭЛЕКТРОННЫЕ СЛОИ ОСТАЮТСЯ НЕИЗМЕННЫМИ.
ЭТО ШЕСТЬ ПОСЛЕДНИХ ЭЛЕМЕНТОВ ПЕРИОДА (КРОМЕ 7-ГО)
22.
• D – ЭЛЕМЕНТЫ. ЗАСТРАИВАЕТСЯ СОСЕДНИЙ С НАРУЖНЫМ УРОВЕНЬ.В НАРУЖНОМ СЛОЕ ЭТИХ ЭЛЕМЕНТОВ НА S-ПОДУРОВНЕ НАХОДИТСЯ
ЧАЩЕ 2 РЕЖЕ 1 ЭЛЕКТРОН. ТАКИХ ЭЛЕМЕНТОВ ПО 10 В КАЖДОМ
БОЛЬШОМ ПЕРИОДЕ (КРОМЕ 7-ГО)
• F – ЭЛЕМЕНТЫ. В АТОМАХ ЭТИХ ЭЛЕМЕНТОВ ЗАПОЛНЯЕТСЯ FПОДУРОВЕНЬ ТРЕТЬЕГО УРОВНЯ, СЧИТАЯ ОТ ВНЕШНЕГО. СЕЙЧАС
ИЗВЕСТНО 28 ТАКИХ ЭЛЕМЕНТОВ. ОНИ ДЕЛЯТСЯ НА ДВА СЕМЕЙСТВА
ЛАНТАНОИДОВ (ЗАПОЛНЯЕТСЯ 4F-ПОДУРОВЕНЬ) И АКТИНОИДЫ
(ЗАПОЛНЯЕТСЯ 5F-ПОДУРОВЕНЬ.
23.
ИЗМЕНЕНИЕ НЕКОТОРЫХ ХАРАКТЕРИСТИК АТОМОВ И СВОЙСТВЭЛЕМЕНТОВ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Д.И. МЕНДЕЛЕЕВА
• УМЕНЬШЕНИЕ РАДИУСА АТОМА
• УВЕЛИЧЕНИЕ ЗНАЧЕНИЙ ЭНЕРГИЙ ИОНИЗАЦИИ, СРОДСТВА К
ЭЛЕКТРОНУ, ОЭО
• УСИЛЕНИЕ НЕМЕТАЛЛИЧЕСКИХ И ОКИСЛИТЕЛЬНЫХ СВОЙСТВ
ЭЛЕМЕНТОВ
• ОСЛАБЛЕНИЕ ОСНОВНЫХ СВОЙСТВ ОКСИДОВ
• УМЕНЬШЕНИЕ ТЕМПЕРАТУР КИПЕНИЯ И ПЛАВЛЕНИЯ ПРОСТЫХ
ВЕЩЕСТВ.
24.
ПРИМЕРЫДАЙТЕ ХАРАКТЕРИСТИКУ ЭЛЕМЕНТА № 56 ПО ПОЛОЖЕНИЮ В П.С.
ЭЛЕМЕНТ №56 – БАРИЙ 56ВА. ВА НАХОДИТСЯ В 6 ПЕРИОДЕ ВО ВТОРОЙ ГРУППЕ ГЛАВНОЙ
ПОДГРУППЫ.
2) Z=+56, N(11P)=56, N(E)=56,
N(10N)=A-N(11P)=137-56=81
ЭЛЕКТРОННАЯ ФОРМУЛА: 1S22S22P63S23P64S23D104P65S24D105P66S2
25.
ОСНОВНОЕ СОСТОЯНИЕ: …6S26Р0 В(ВА)=0ВОЗБУЖДЕННОЕ СОСТОЯНИЕ …6S16Р1 ВАЛЕНТНОСТЬ = II
Ва – s-элемент, металл, ОЭО=0,9.
Высший оксид ВаО – основный.
Ва(ОН)2-основание
ВаО+Н2О = Ва(ОН)2
ВаО+SО3 = ВаSО4
ВаО+2HCl = BaCl2+ Н2О
26.
Современная теория химической связиВозникновение химической связи обусловлено стремлением
атомов приобрести устойчивую восьмиэлектронную (октет)
или двухэлектронную (дублет) оболочку.
При достраивании электронных оболочек происходит
перераспределение электронной плотности между двумя или
несколькими центрами атомов элементов и возникновение
общей для этих центров области повышенной электронной
плотности, которая притягивается к соответствующим
центрам и удерживает их друг с другом
27.
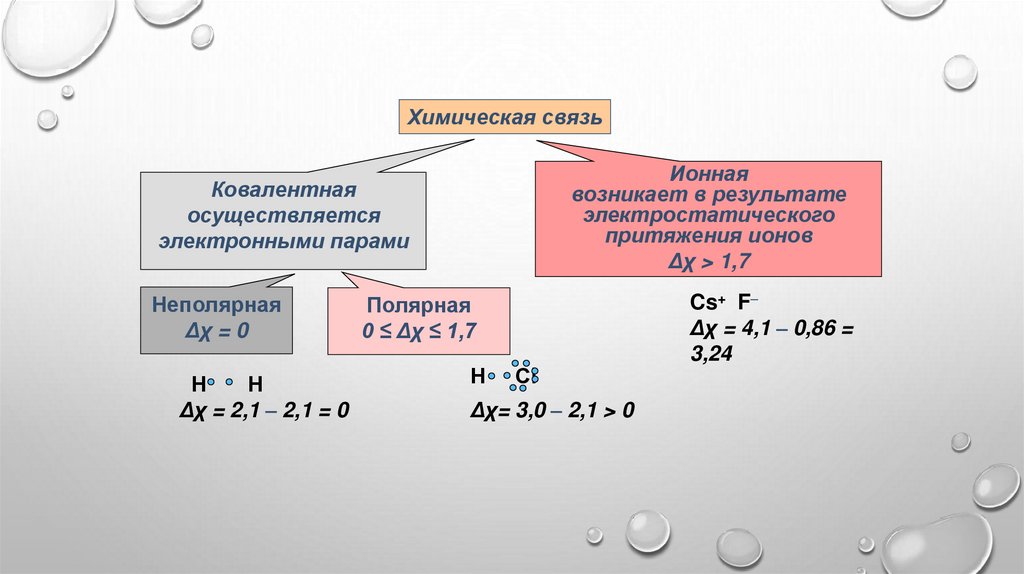
Химическая связьИонная
возникает в результате
электростатического
притяжения ионов
Δχ > 1,7
Ковалентная
осуществляется
электронными парами
Неполярная
Δχ = 0
Н
Н
Δχ = 2,1 ⎼ 2,1 = 0
Полярная
0 ≤ Δχ ≤ 1,7
Н
Сl
Δχ= 3,0 ⎼ 2,1 > 0
Cs+ F⎼
Δχ = 4,1 ⎼ 0,86 =
3,24
28.
По обменному механизму вобразовании химической
связи принимают участие
неспаренные валентные
электроны с
противоположными спинами
По донорно-акцепторному
механизму в образовании
химической связи принимают
участие свободная орбиталь
одного атома и неподеленная
пара электронов другого
29.
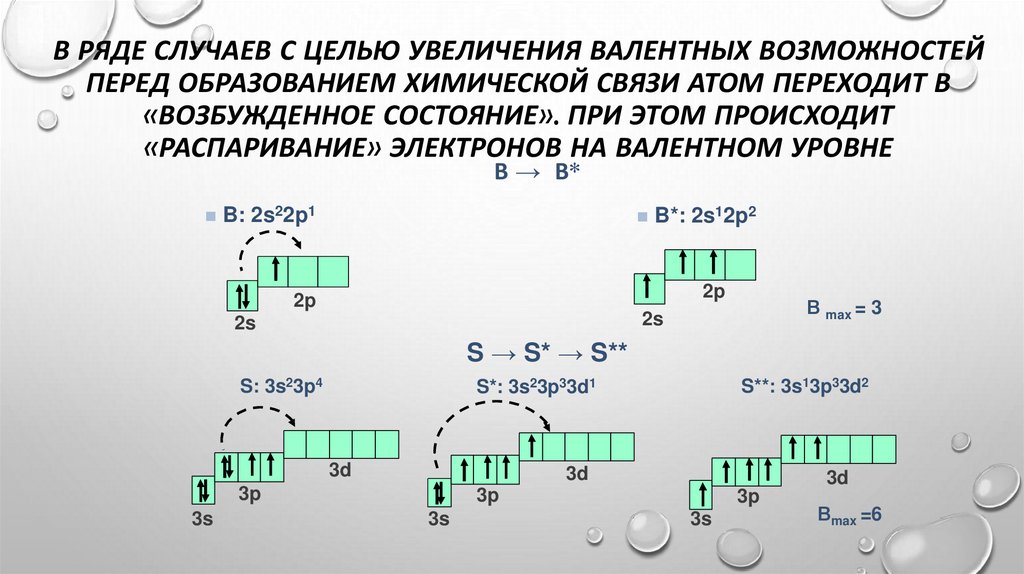
В РЯДЕ СЛУЧАЕВ С ЦЕЛЬЮ УВЕЛИЧЕНИЯ ВАЛЕНТНЫХ ВОЗМОЖНОСТЕЙПЕРЕД ОБРАЗОВАНИЕМ ХИМИЧЕСКОЙ СВЯЗИ АТОМ ПЕРЕХОДИТ В
«ВОЗБУЖДЕННОЕ СОСТОЯНИЕ». ПРИ ЭТОМ ПРОИСХОДИТ
«РАСПАРИВАНИЕ» ЭЛЕКТРОНОВ НА ВАЛЕНТНОМ УРОВНЕ
В → В*
B: 2s22p1
B*: 2s12p2
2p
2p
В max = 3
2s
2s
S → S* → S**
S: 3s23p4
3d
3d
3p
3s
S**: 3s13p33d2
S*: 3s23p33d1
3d
3p
3s
3p
3s
Вmax =6
30.
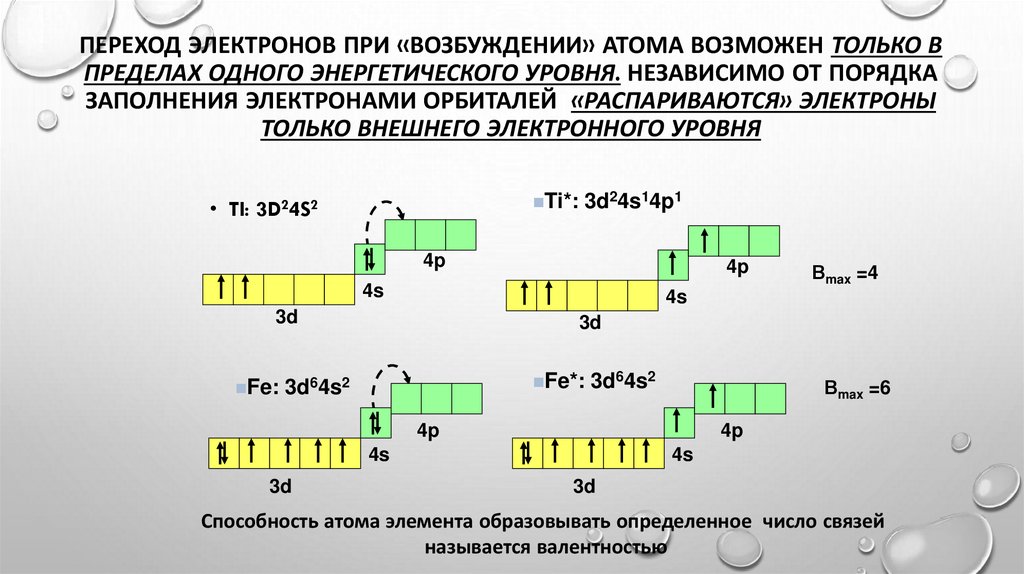
ПЕРЕХОД ЭЛЕКТРОНОВ ПРИ «ВОЗБУЖДЕНИИ» АТОМА ВОЗМОЖЕН ТОЛЬКО ВПРЕДЕЛАХ ОДНОГО ЭНЕРГЕТИЧЕСКОГО УРОВНЯ. НЕЗАВИСИМО ОТ ПОРЯДКА
ЗАПОЛНЕНИЯ ЭЛЕКТРОНАМИ ОРБИТАЛЕЙ «РАСПАРИВАЮТСЯ» ЭЛЕКТРОНЫ
ТОЛЬКО ВНЕШНЕГО ЭЛЕКТРОННОГО УРОВНЯ
Ti*: 3d24s14p1
• TI: 3D24S2
4p
4p
4s
4s
3d
3d
Fe: 3d64s2
Fe*: 3d64s2
Вmax =6
4p
4p
4s
3d
Вmax =4
4s
3d
Способность атома элемента образовывать определенное число связей
называется валентностью
31.
ГИБРИДИЗАЦИЯ АТОМНЫХОРБИТАЛЕЙ
32.
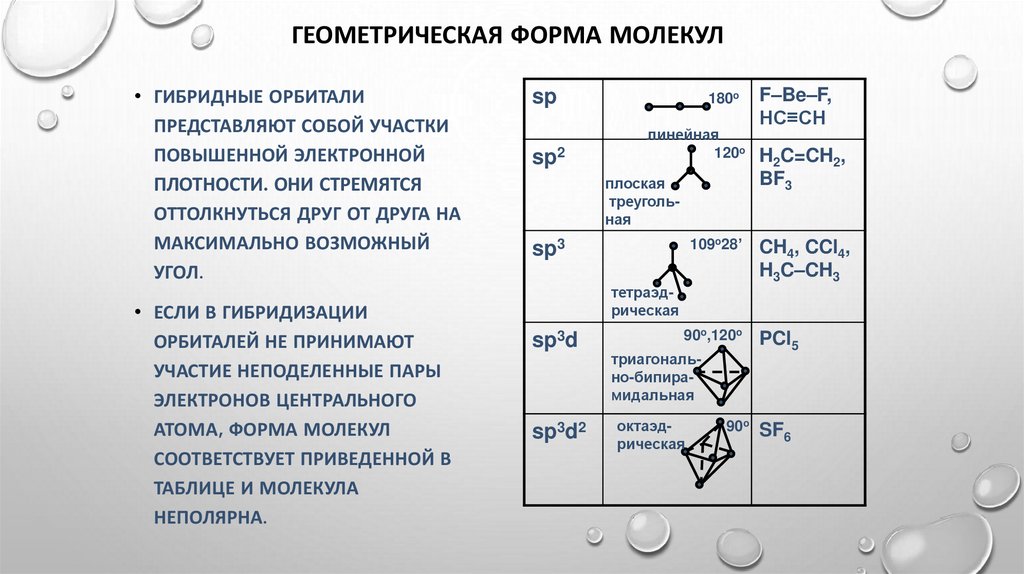
ГЕОМЕТРИЧЕСКАЯ ФОРМА МОЛЕКУЛ• ГИБРИДНЫЕ ОРБИТАЛИ
ПРЕДСТАВЛЯЮТ СОБОЙ УЧАСТКИ
ПОВЫШЕННОЙ ЭЛЕКТРОННОЙ
ПЛОТНОСТИ. ОНИ СТРЕМЯТСЯ
ОТТОЛКНУТЬСЯ ДРУГ ОТ ДРУГА НА
МАКСИМАЛЬНО ВОЗМОЖНЫЙ
УГОЛ.
• ЕСЛИ В ГИБРИДИЗАЦИИ
ОРБИТАЛЕЙ НЕ ПРИНИМАЮТ
УЧАСТИЕ НЕПОДЕЛЕННЫЕ ПАРЫ
ЭЛЕКТРОНОВ ЦЕНТРАЛЬНОГО
АТОМА, ФОРМА МОЛЕКУЛ
СООТВЕТСТВУЕТ ПРИВЕДЕННОЙ В
ТАБЛИЦЕ И МОЛЕКУЛА
НЕПОЛЯРНА.
sp
180o
sp2
линейная
120o
плоская
треугольная
F–Be–F,
HC≡CH
H2C=CH2,
BF3
109o28’
CH4, CCl4,
H3C–CH3
90o,120o
PCl5
sp3
тетраэдрическая
sp3d
sp3d2
триагонально-бипирамидальная
октаэдрическая
90o SF
6
33.
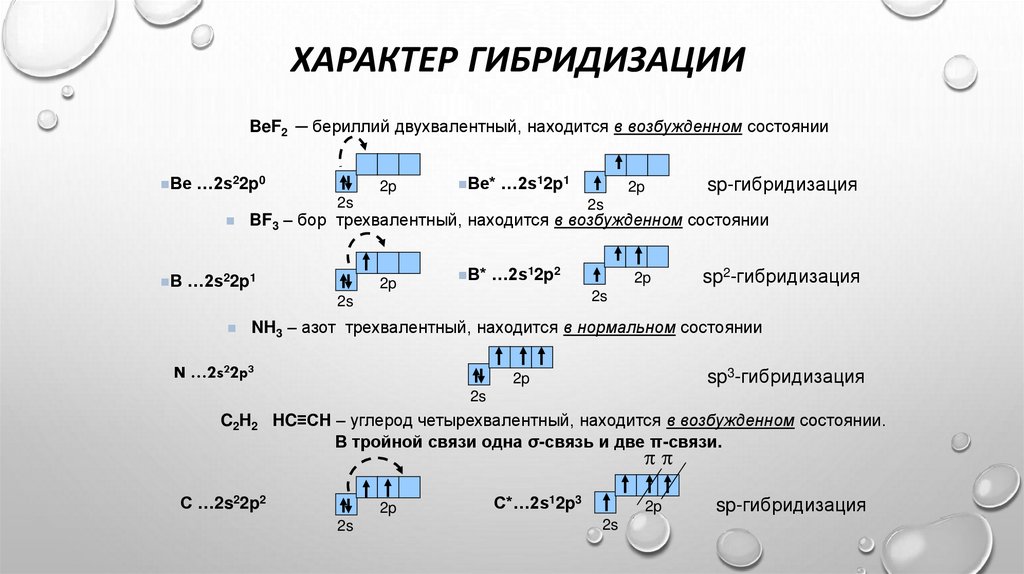
ХАРАКТЕР ГИБРИДИЗАЦИИBeF2 ─ бериллий двухвалентный, находится в возбужденном состоянии
Be …2s22p0
2p
Be* …2s12p1
2s
2s
BF3 – бор трехвалентный, находится в возбужденном состоянии
B …2s22p1
2p
B* …2s12p2
2p
sp2-гибридизация
2s
2s
sp-гибридизация
2p
NH3 – азот трехвалентный, находится в нормальном состоянии
N …2s22p3
sp3-гибридизация
2p
2s
C2H2 HC≡CH – углерод четырехвалентный, находится в возбужденном состоянии.
В тройной связи одна σ-связь и две π-связи.
С …2s22p2
2p
2s
C*…2s12p3
2p
2s
sp-гибридизация










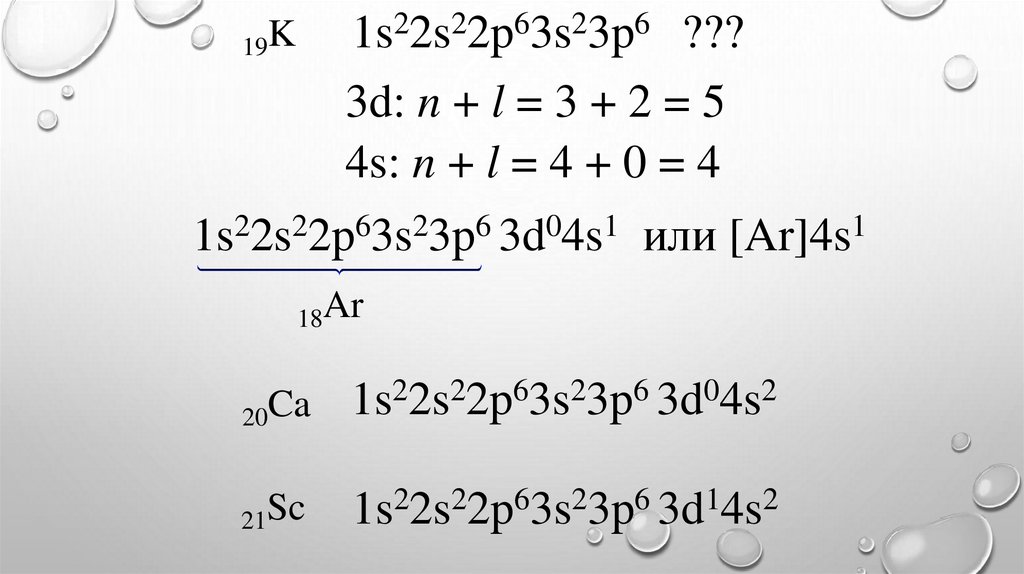












 chemistry
chemistry








