Similar presentations:
Алюминий. Особенности алюминия
1. Алюминий
2.
Порядковый номерХимический элемент III
группы главной
подгруппы 3-го периода
13
Число
протонов p+=13
электронов ē=13
нейтронов n0=14
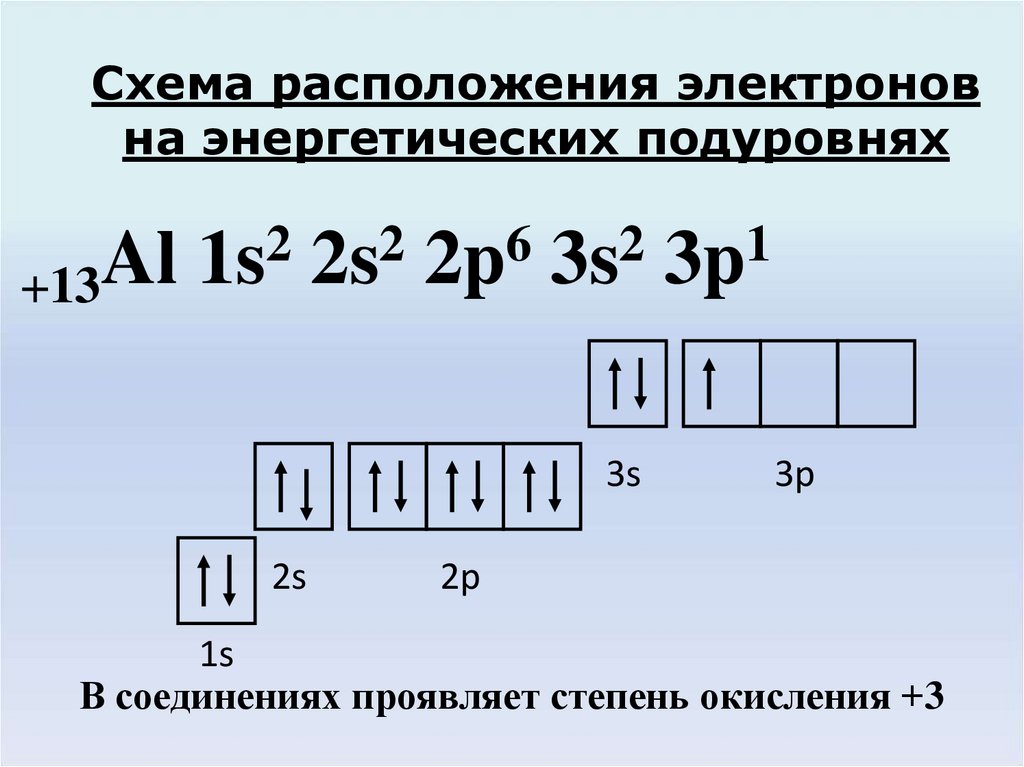
3. Схема расположения электронов на энергетических подуровнях
22
6
2
1
Al 1s 2s 2p 3s 3p
+13
3s
2s
3p
2p
1s
В соединениях проявляет степень окисления +3
4. Al – амфотерный элемент
• Восстановительные свойства0
+3
Al - 3ē
Al
• Тип химической связи металлическая
5. Особенности алюминия
• Аl - самый распространенныйметалл земной коры 1-е место
среди металлов и 3-е среди всех
элементов (после кислорода и
кремния)
• Его
ресурсы
практически
неисчерпаемы
6.
7. Физические свойства вещества
• Серебристо-белый металл• Пластичный
• Легкий
• Хорошо
проводит
тепло
электрический ток
• Обладает хорошей ковкостью
• = 2,7 г/см3
• tпл.= 6600С
и
8. Химические свойства Аl I. С простыми веществами
1) 4Al+3O2 = 2Al2O32) 2Al + 3Cl2 = 2 AlCl3
3) 2Al + 3S = Al2S3 - при нагревании
4) 4Al + 3С = Al4С3 - при нагревании
9. II. Со сложными веществами
1. Алюминий растворяется в растворахкислот
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(р) = Al2(SO4)3 + 3H2
10.
Холодные H2SO4 (к) и HNO3(к)пассивируют алюминий
При нагревании реагируют
2Al + 6H2SO4 (к) →Al2(SO4)3+3SO2↑ + 6H2O
Al + 6HNO3(к) → Al(NO3)3 + 3NO2↑ + 3H2O
11.
Al – амфотерный металл, реагирует срастворами щелочей
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
12.
Алюминий реагирует с растворамисолей менее активных металлов
2Al + 3СuCl2 = 2AlCl3 + 3Cu
13.
Аl при высокой t реагирует с оксидамименее активных металлов
(Алюминотермия – получение
металлов: Fe, Cr, Mn, Ti, W и других,
путем их восстановления алюминием)
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
14.
При удалении оксидной пленки с поверхностиалюминия, он реагирует с водой
2Al + 6H2O = 2Al(OH)3 +3H2
15.
16. Применение Al
17.
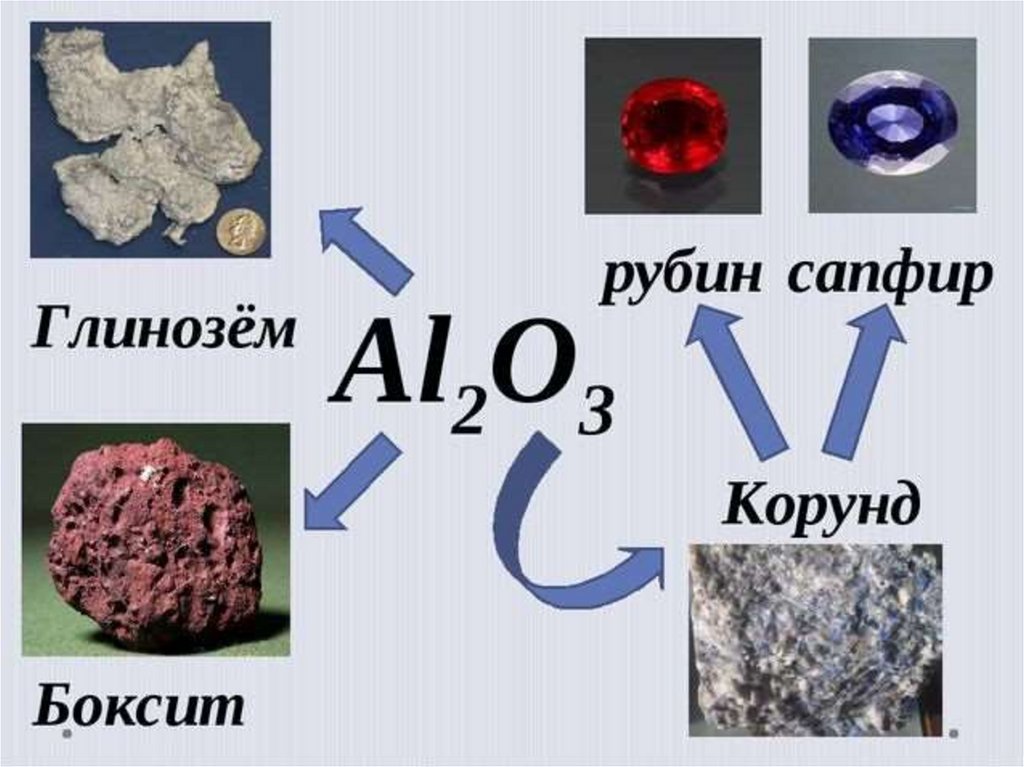
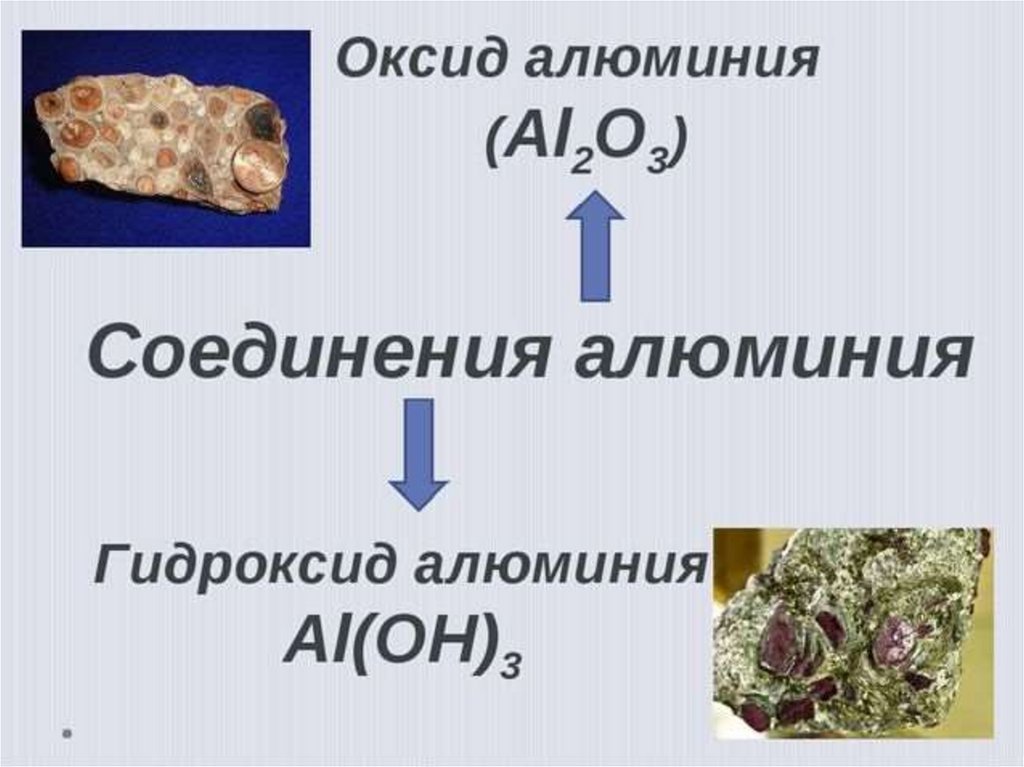
18. Оксид алюминия Al2О3
Очень твердый (корунд, рубин)вкристаллическом состоянии, порошок белого
цвета, тугоплавкий - 20500С.
Не растворяется в воде
Амфотерный оксид, взаимодействует:
а) с кислотами Al2O3 + 6HCl= 2AlCl3 + 3H2O
б) со щелочами при нагревании
Al2O3 + 2NaOH = 2NaAlO2 + H2O
19. Оксид алюминия Al2О3
Образуется:а) при окислении или горении алюминия на
воздухе
4Al + 3O2 = 2Al2O3
б) в реакции алюминотермии
2Al + Fe2O3 = Al2O3 + 2Fe
в) при термическом разложении гидроксида
алюминия 2Al (OH)3 = Al2O3 + 3H2O
20. Гидроксид алюминия Al(ОН)3
Белый нерастворимый в воде порошок.1) Проявляет амфотерные свойства
а) с кислотами Al (OH)3 + 3HCl = AlCl3 + 3H2O
б) со щелочами при сплавлении (t)
Al (OH)3 + Na OH = NaAlO2 + 2H2O
со щелочами в растворе
Al (OH)3 + Na OH = Na[Al(OH)4]
2) Разлагается при нагревании
2Al (OH)3 = Al2O3 + 3H2O
















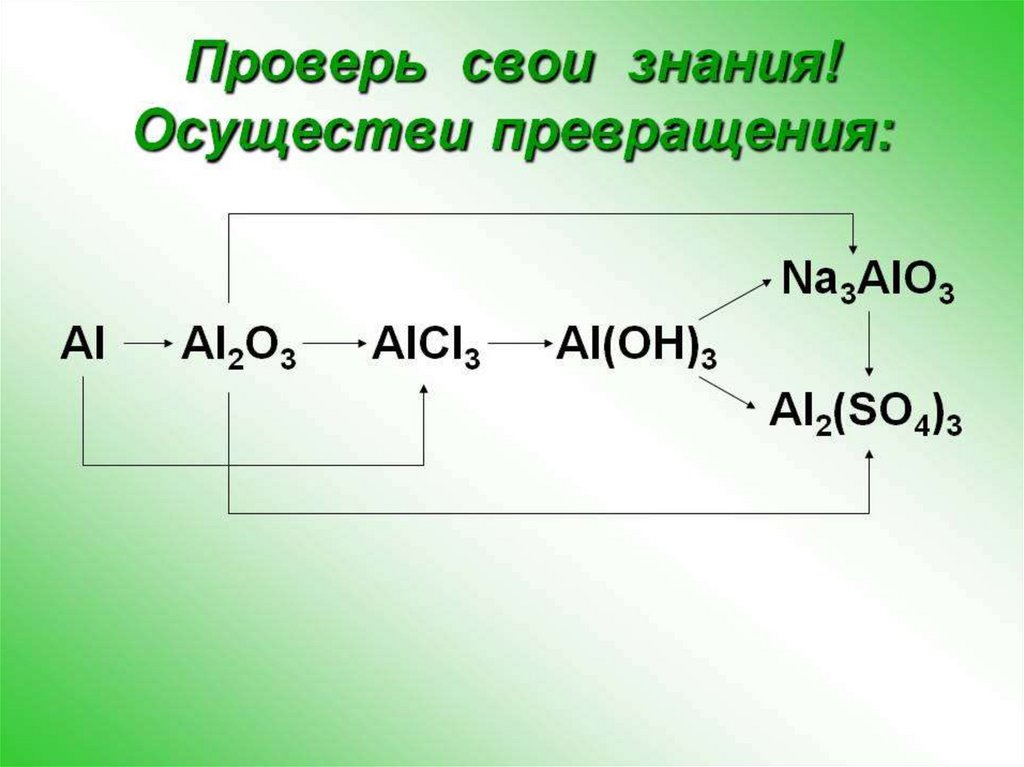
 chemistry
chemistry








