Similar presentations:
Elektrolytický vodič aneb Jak se kapalina stává elektricky vodivou
1. Snímka 1
ELEKTROLYTICKÝ VODIČaneb
Jak se kapalina stává elektricky vodivou
PaedDr. Jozef Beňuška
[email protected]
2. Snímka 2
Do nádoby s destilovanou vodou jsou vloženy dvěelektrody a zapojeny na zdroj stejnosměrného napětí.
-
+
+ Obvodem elektrický proud neprochází.
3. Snímka 3
Po přidání kuchyňské soli do destilované vody …-
+
+ - miliampérmetr ukáže výchylku.
4. Snímka 4
Přidáním kuchyňské soli do destilované vody docházík jevu elektrolytická disociace.
+
+
+
- +
+ - +
+ - +
- +
+ - +
+ - +
- +
NaCl Na+ + ClVznik volných iontů rozpadem rozpuštěné látky v rozpouštědle (v důsledku polárního charakteru molekul vody).
5. Snímka 5
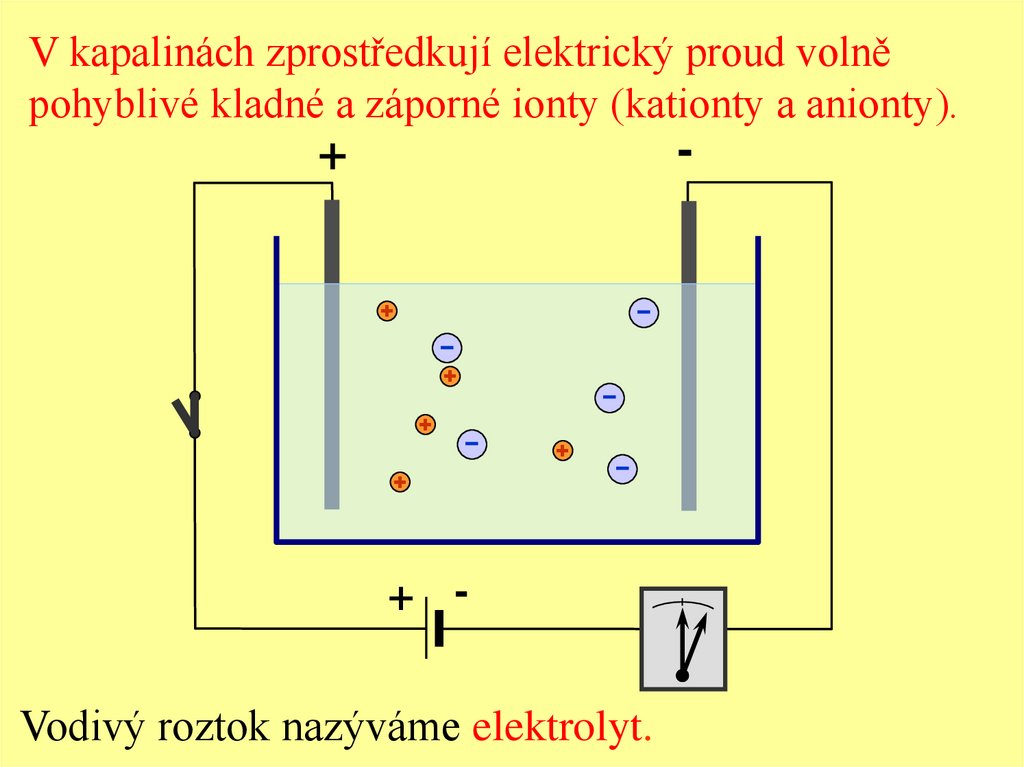
V kapalinách zprostředkují elektrický proud volněpohyblivé kladné a záporné ionty (kationty a anionty).
-
+
-
+
-+
+
+
-
+
-
+ Vodivý roztok nazýváme elektrolyt.
6. Snímka 6
Vložíme-li do elektrolytu dvě elektrody a zapojíme jena svorky stejnosměrného napětí, vznikne mezi elektrodami uvnitř elektrolytu elektrické pole.
Vznikem elektrického pole je vyvolán usměrněný
pohyb iontů v roztoku.
Kationty se začnou pohybovat ke katodě (elektrodě
zapojené na zápornou svorku zdroje) a anionty k anodě
(elektrodě zapojené na kladnou svorku zdroje).
S přenosem náboje nastává také přenos látky.
7. Snímka 7
Graf závislosti elektrického proudu na elektrickémnapětí v elektrolytu
I
mA
U U r RI
0
Ur
Ur - rozkladné napětí
R - odpor elektrolytu
U
V
8. Snímka 8
Elektrolyt - vodný roztok HCl, elektrody - platina.+ -
+
+
-
-
+
HCl H+ + Cl4Cl- + 2H2O 4HCl+O2
+
Na platinových elektrodách se vylučuje na katodě vodík,
na anodě kyslík - elektrody se polarizovaly.
Polarizační napětí má opačnou polaritu než vnější napětí.
9. Snímka 9
Graf závislosti elektrického proudu na elektrickémnapětí v elektrolytu
I
mA
U U r RI
0
Ur
U
V
Polarizační napětí má horní hranici - rozkladné napětí Ur.
Takže až větším vnějším napětím, než je rozkladné napětí,
je možno v obvodu udržovat trvalý proud.
10. Snímka 10
TestElektrolytická disociace je:
a) vznik volných iontů,
b) vznik volných iontů rozpadem rozpuštěné látky
v rozpouštědle,
c) vznik volných iontů v rozpouštědle,
d) vznik iontů rozpadem rozpuštěné látky
v rozpouštědle.
1
11. Snímka 11
TestV kapalinách zprostředkují elektrický proud volně
pohyblivé:
a) protony,
b) elektrony,
c) kationty a anionty,
d) molekuly soli.
2
12. Snímka 12
TestVyberte správné tvrzení:
a) Polarizační napětí má dolní hranici – rozkladné napětí
Ur. Takže až větším vnějším napětím než rozkladné
napětí je možno v obvodu udržovat trvalý proud.
b) Polarizační napětí má horní hranici – rozkladné napětí
Ur. Takže až větším vnějším napětím než rozkladné
napětí je možno v obvodu udržovat trvalý proud.
c) Polarizační napětí má horní hranici – rozkladné napětí
Ur. Takže menším vnějším napětím než rozkladné
napětí je možno v obvodu udržovat trvalý proud.
3











 physics
physics chemistry
chemistry