Similar presentations:
Строение атомов. Периодическая система. Лекция 2
1. Лекция 2 Строение атомов. Периодическая система
2.
3.
4.
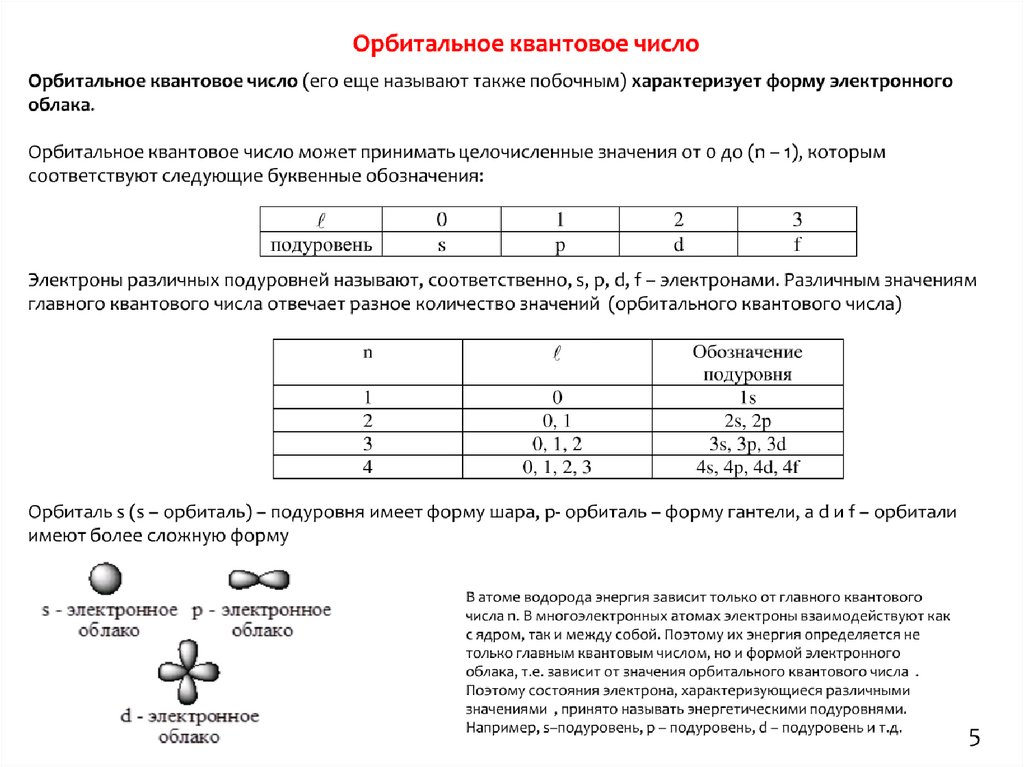
5.
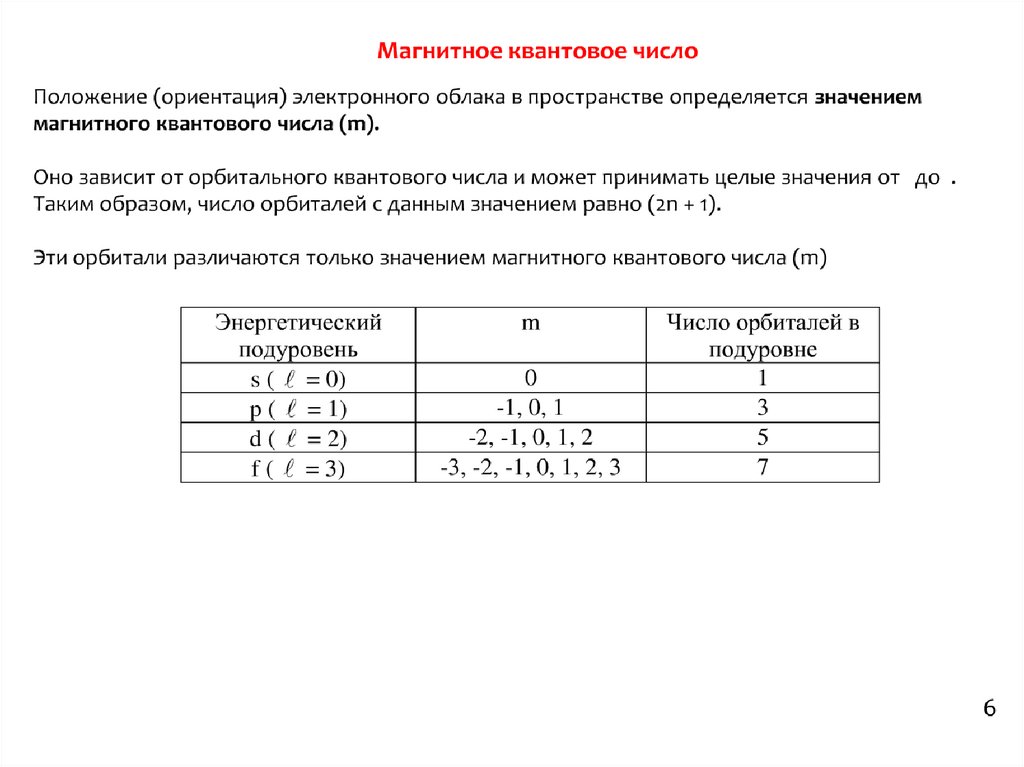
6.
7.
8.
9.
10.
11.
12.
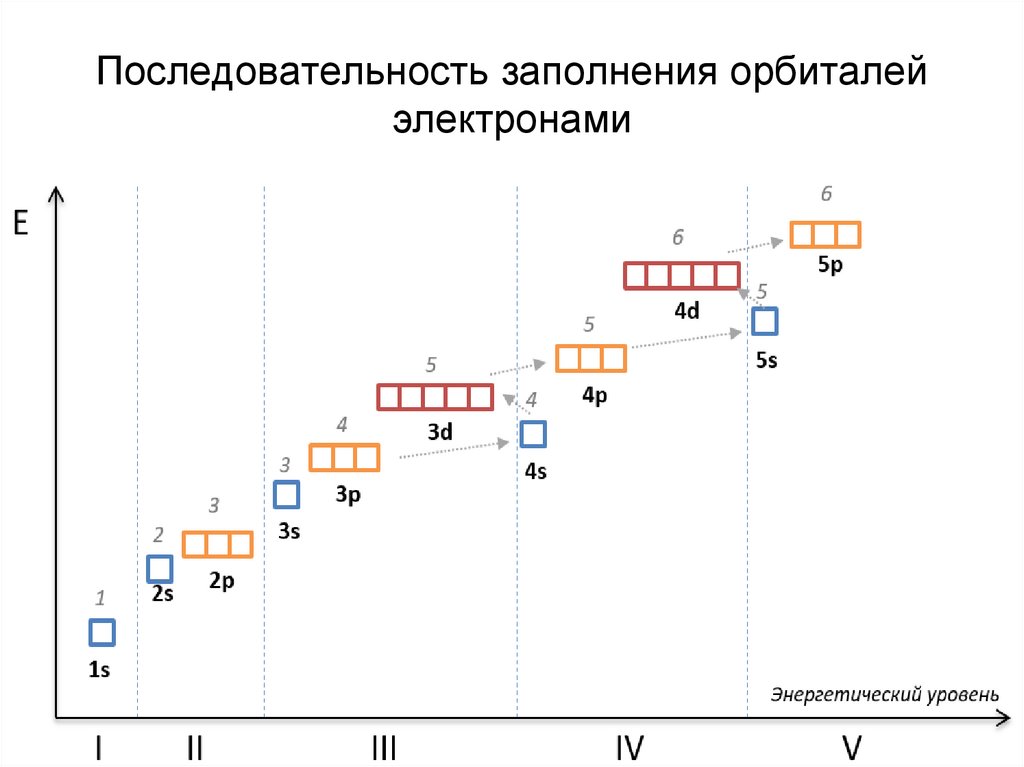
13. Последовательность заполнения орбиталей электронами
14.
15.
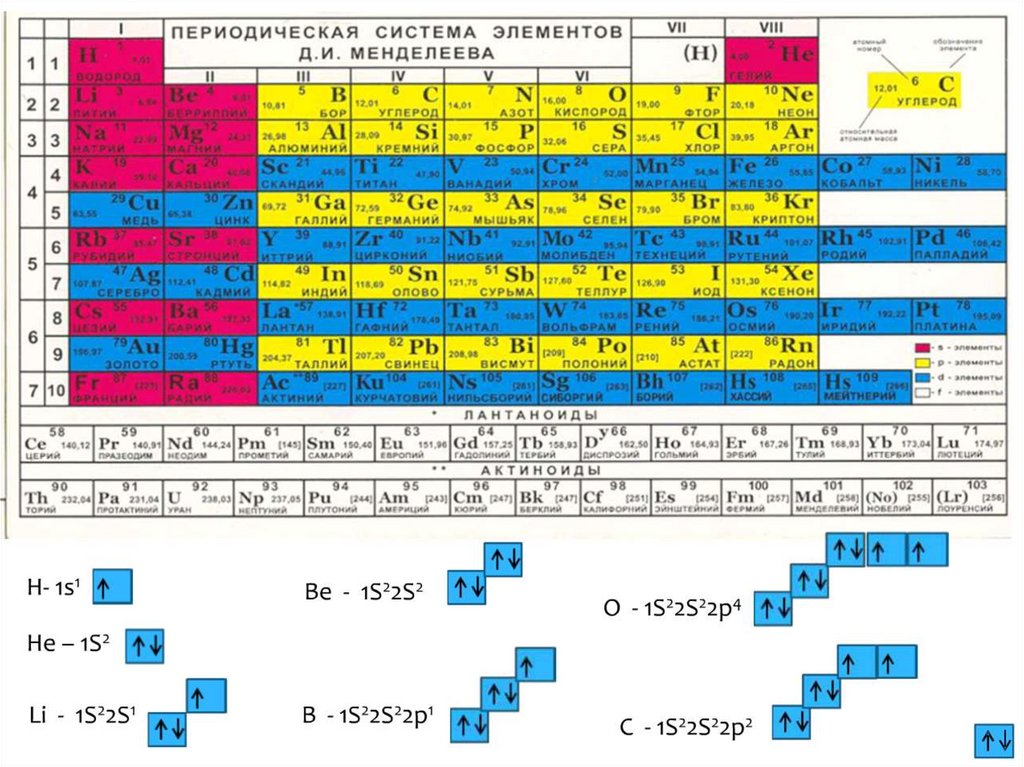
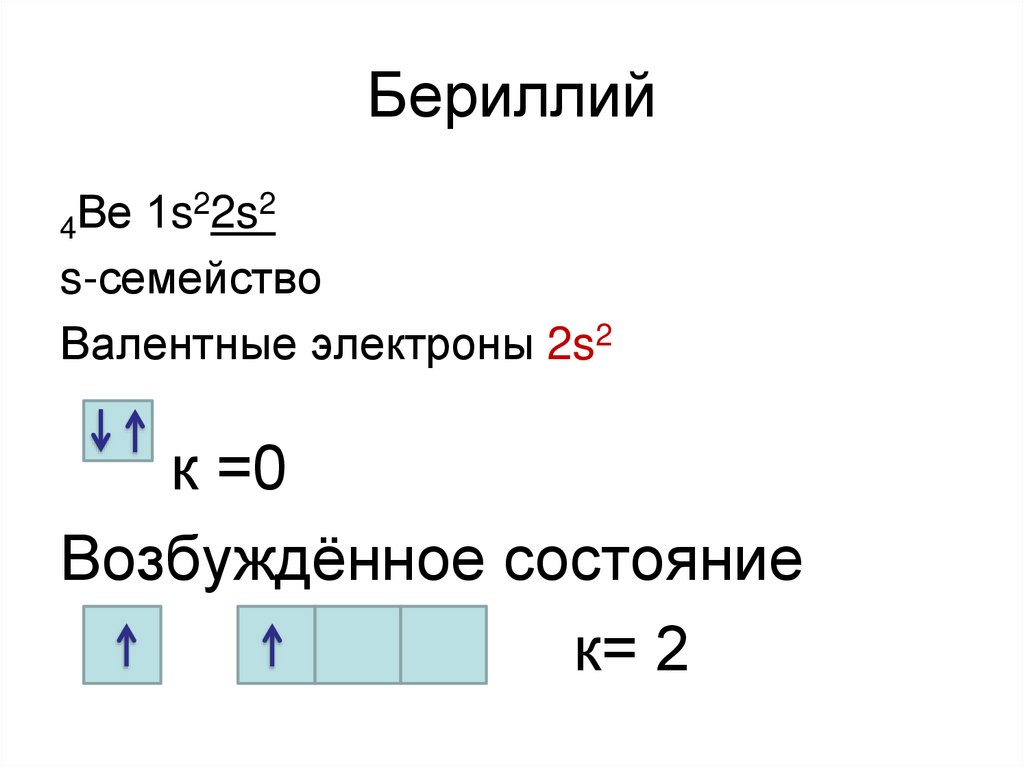
16. Бериллий
22s2Ве
1s
4
s-семейство
Валентные электроны 2s2
к =0
Возбуждённое состояние
к= 2
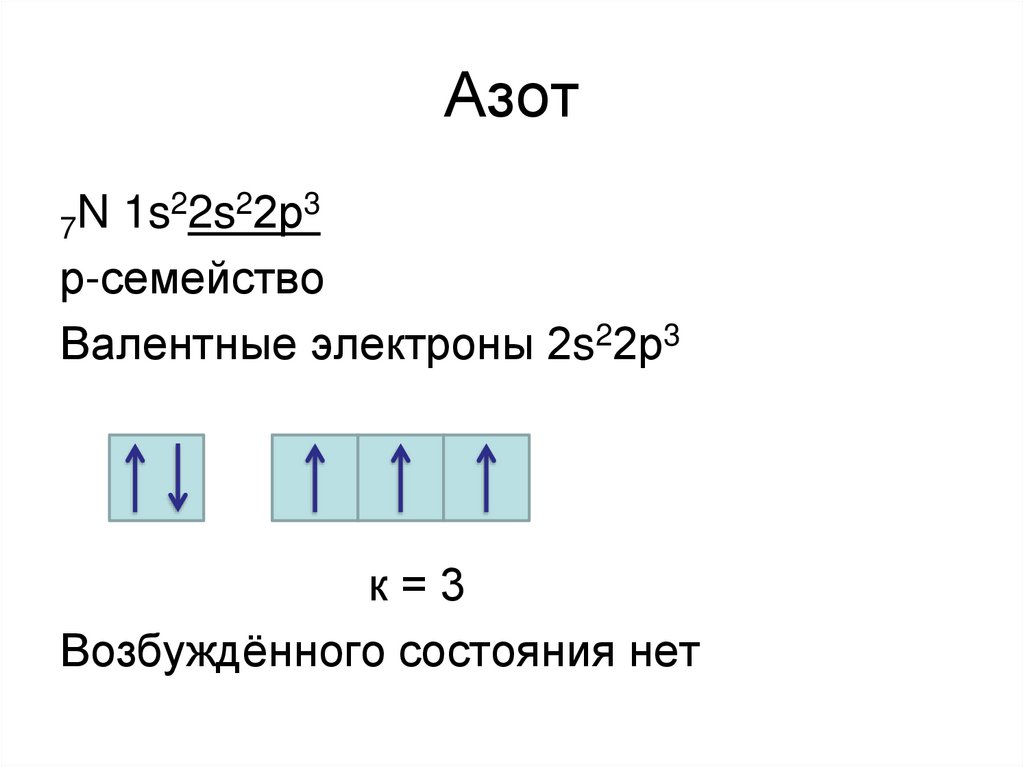
17. Азот
22s22р3N
1s
7
р-семейство
Валентные электроны 2s22р3
к=3
Возбуждённого состояния нет
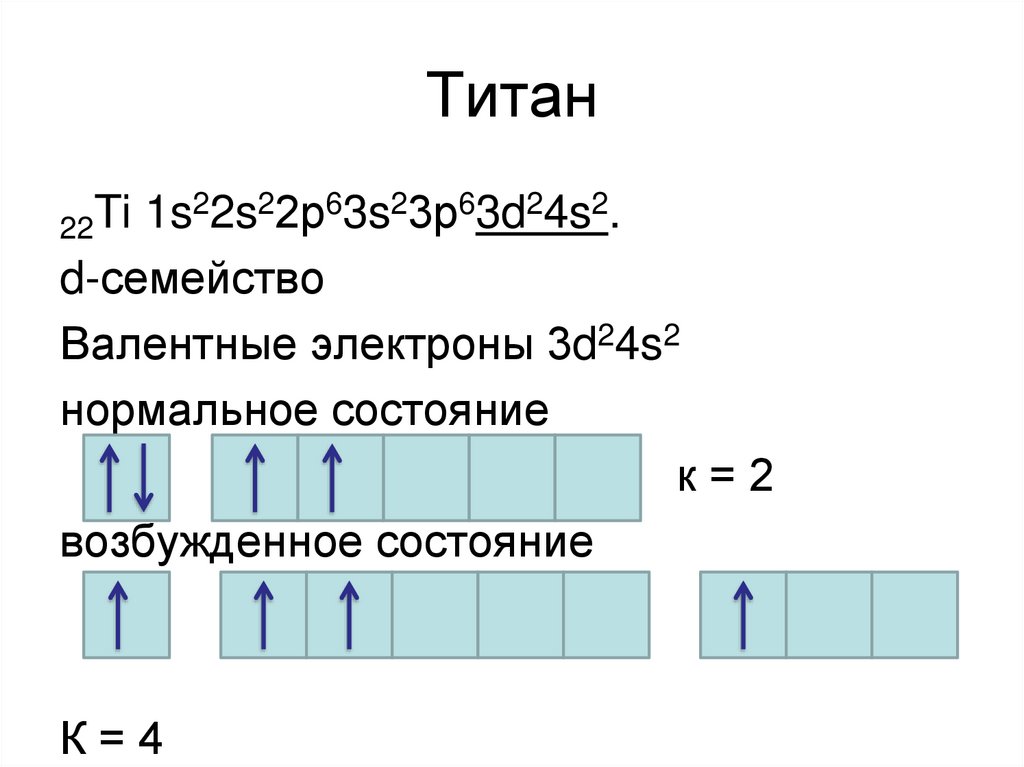
18. Титан
22s22р63s23р63d24s2.Ti
1s
22
d-семейство
Валентные электроны 3d24s2
нормальное состояние
к=2
возбужденное состояние
К=4
19. «Проскок» электрона
Переход электронов с s-подуровнявнешнего энергетического уровня ns на
d-подуровень предвнешнего уровня
(n – 1)d.
«Проскок» электрона происходит в
атомах некоторых d-элементов,
например, 24Сr, 29Cu, 42Mo, 47Ag, 79Au,
41Nb, 44Ru, 45Rh, 46Pd.
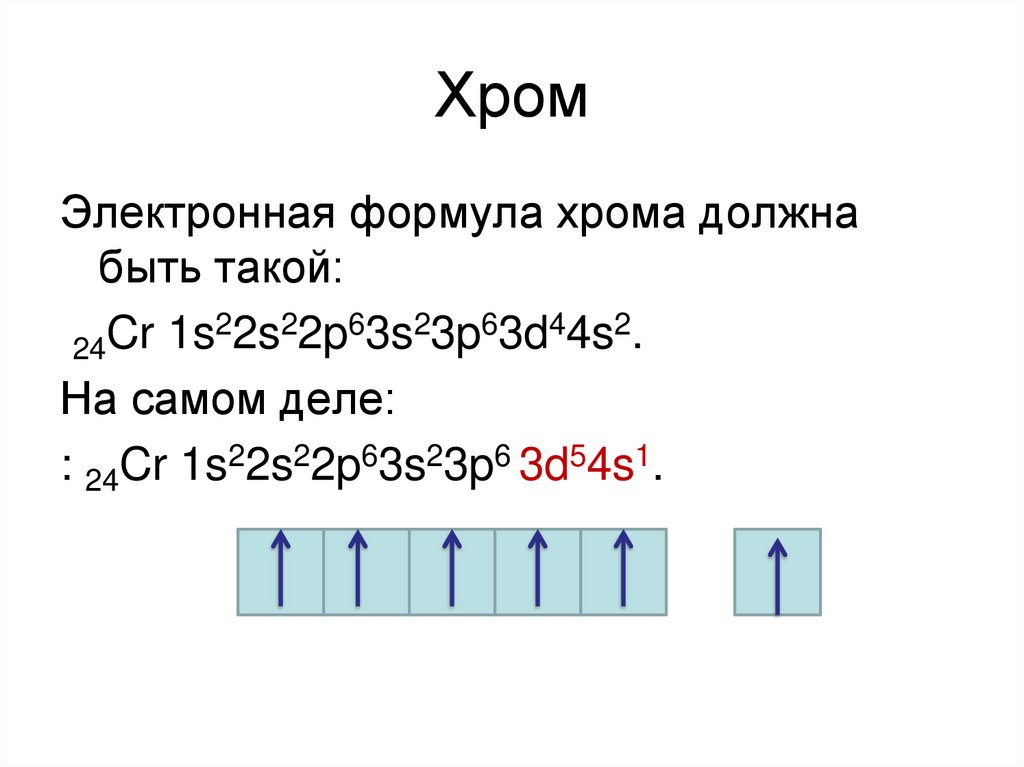
20. Хром
Электронная формула хрома должнабыть такой:
22s22p63s23p63d44s2.
Cr
1s
24
На самом деле:
: 24Cr 1s22s22p63s23p6 3d54s1.
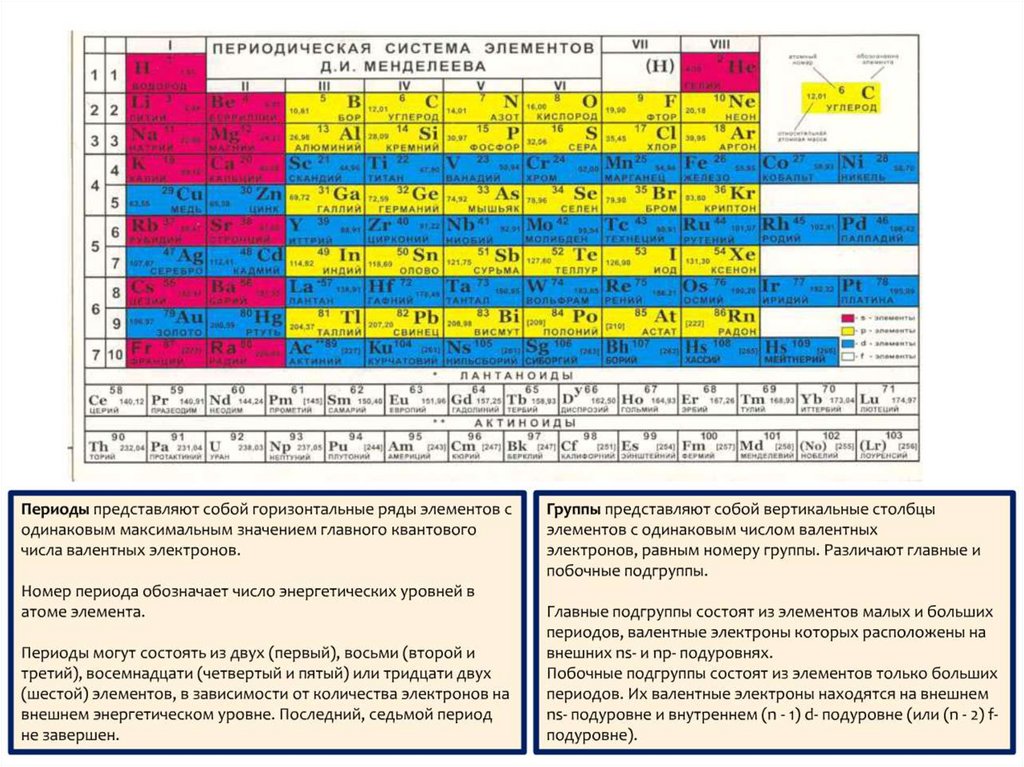
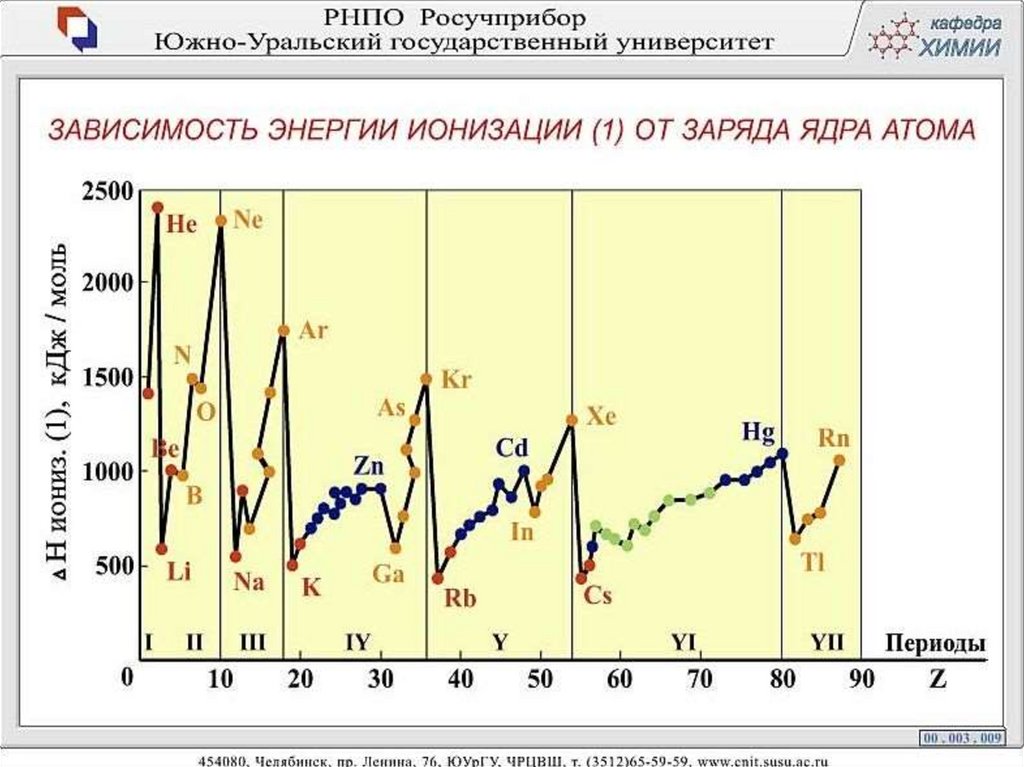
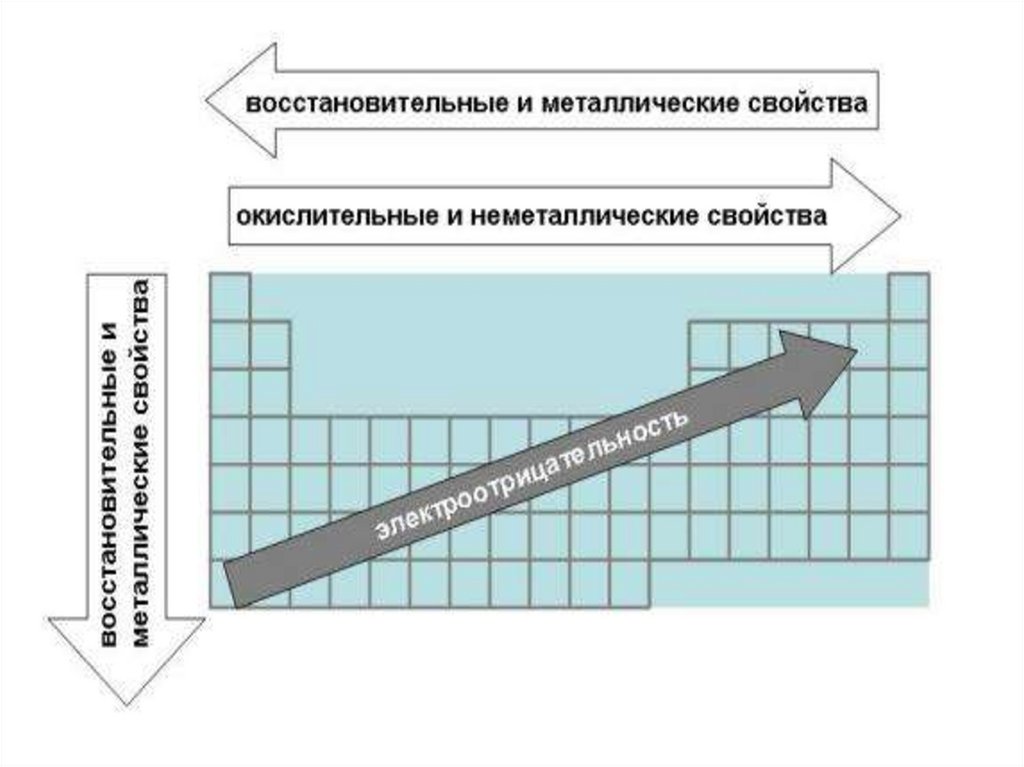
21. Лекция 3 Периодичность свойств химических элементов
22.
23.
24.
25.
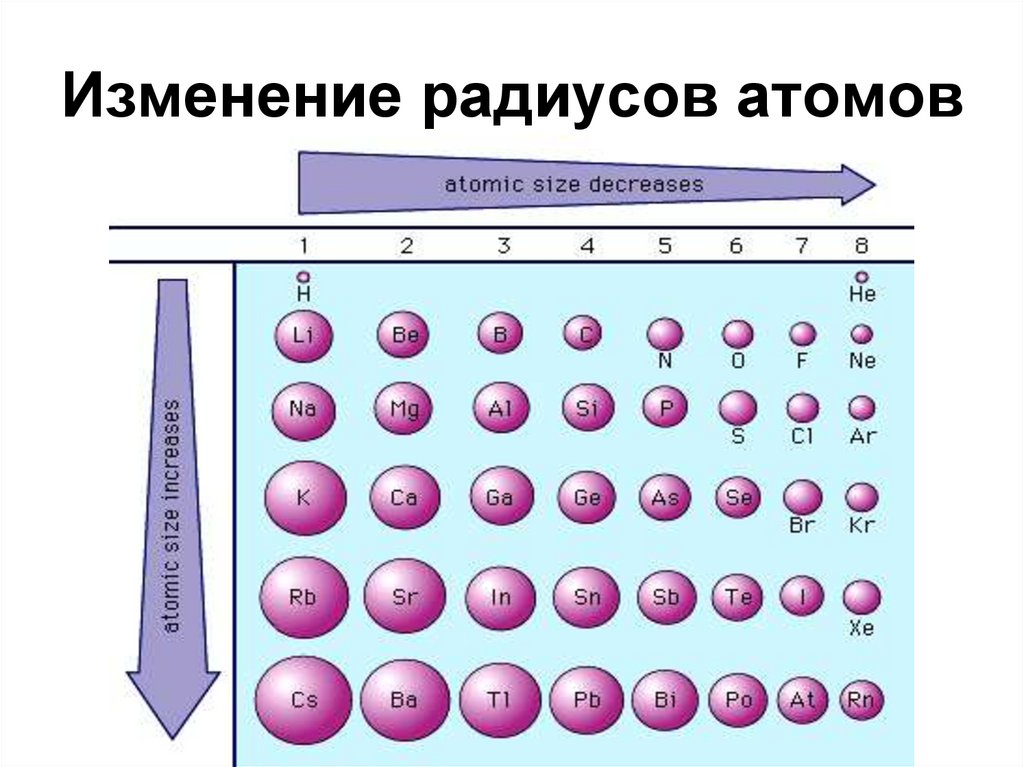
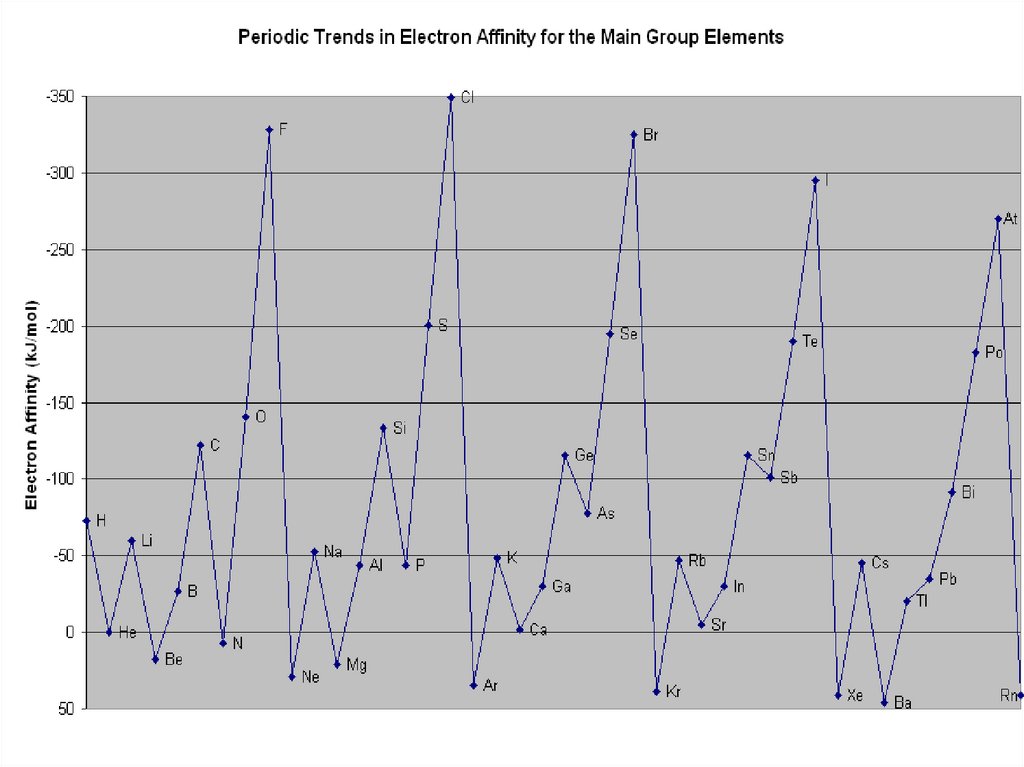
26. Изменение радиусов атомов
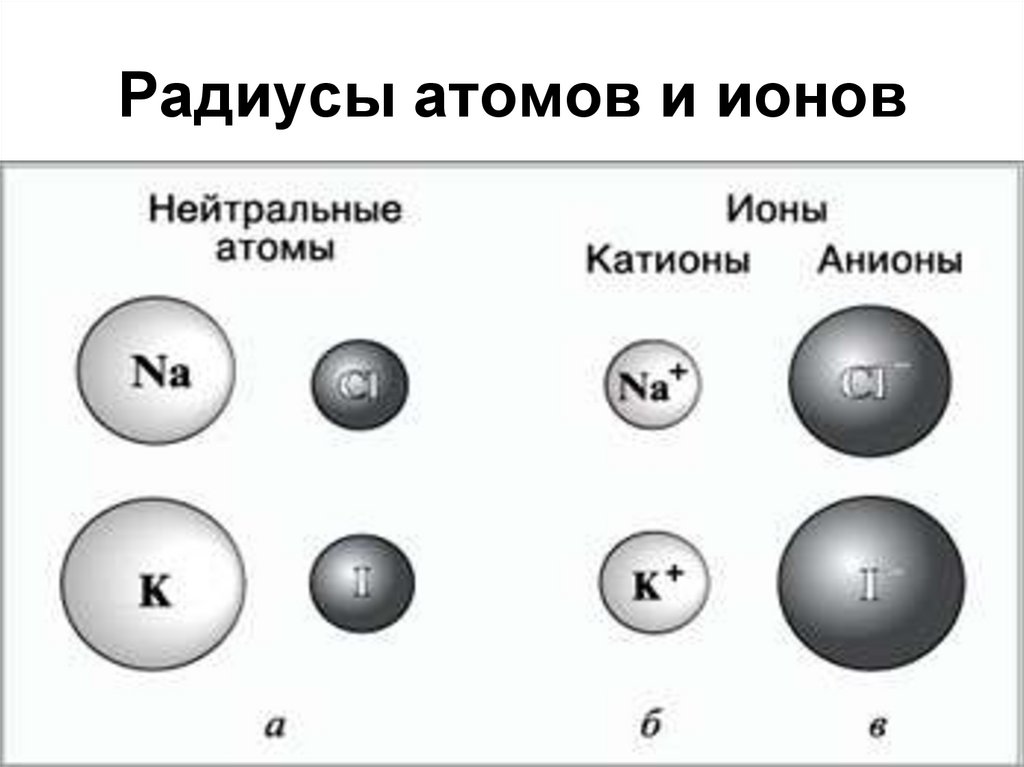
27. Радиусы атомов и ионов
28. Лантаноидное сжатие
29.
30.
31.
32.
33.
34.
35.
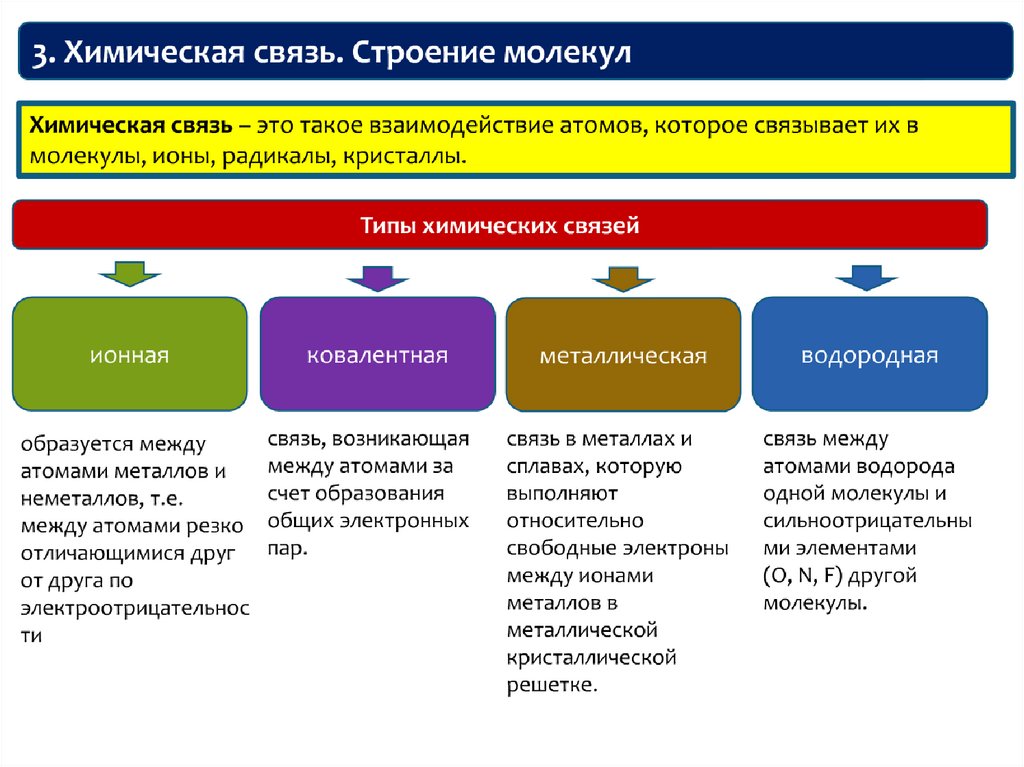
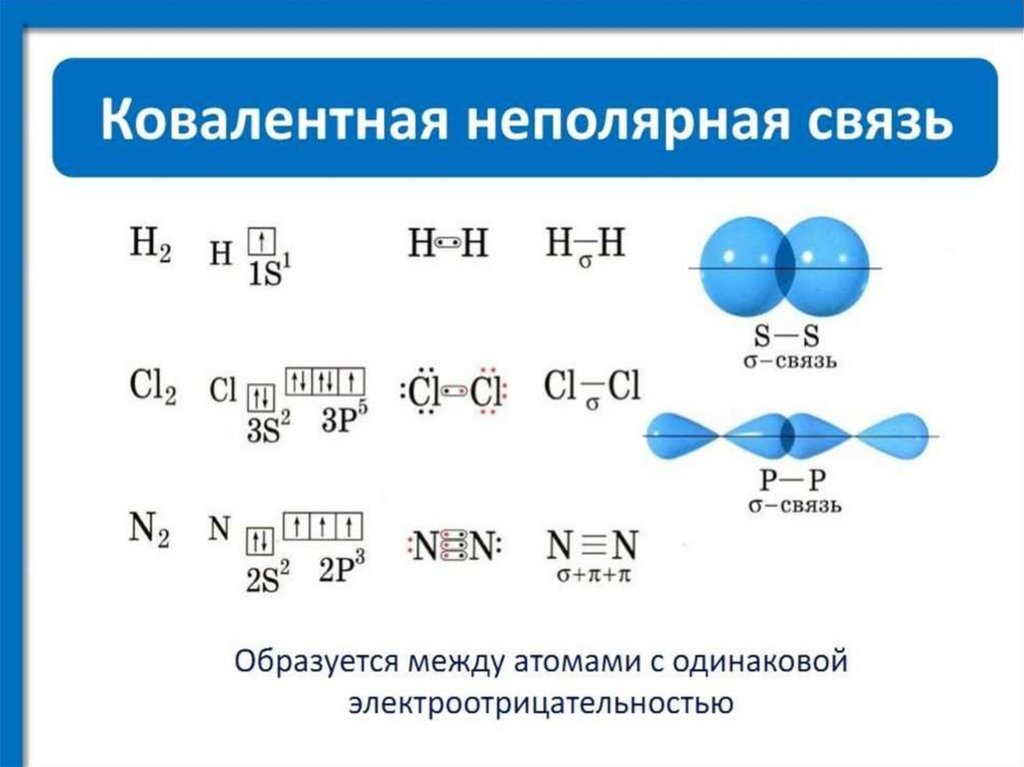
36. Лекция 4 ХИМИЧЕСКАЯ СВЯЗЬ. СТРОЕНИЕ МОЛЕКУЛ
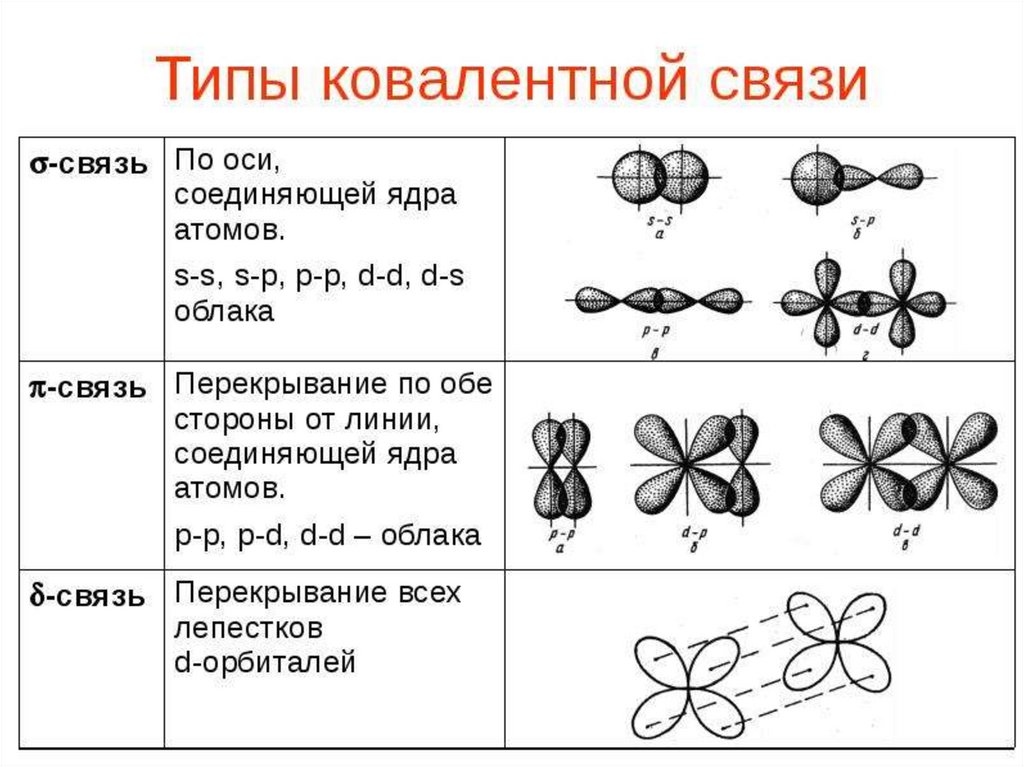
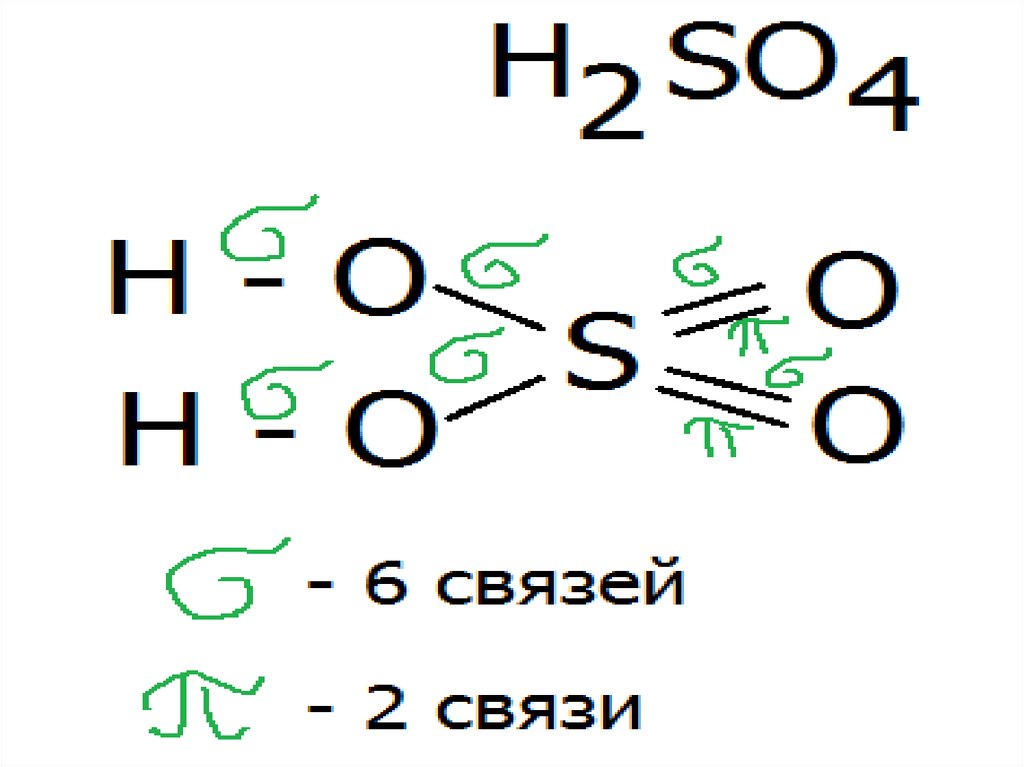
37.
38.
39.
40.
41.
42.
43.
44.
45.
46.
47.
48.
49.
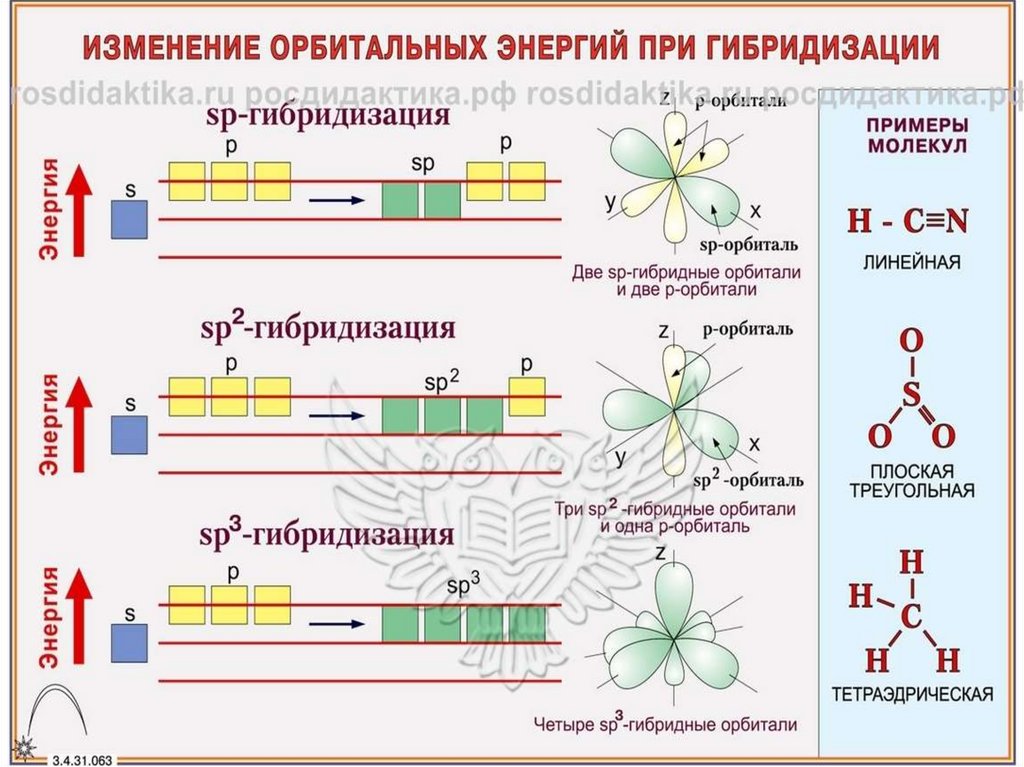
50.
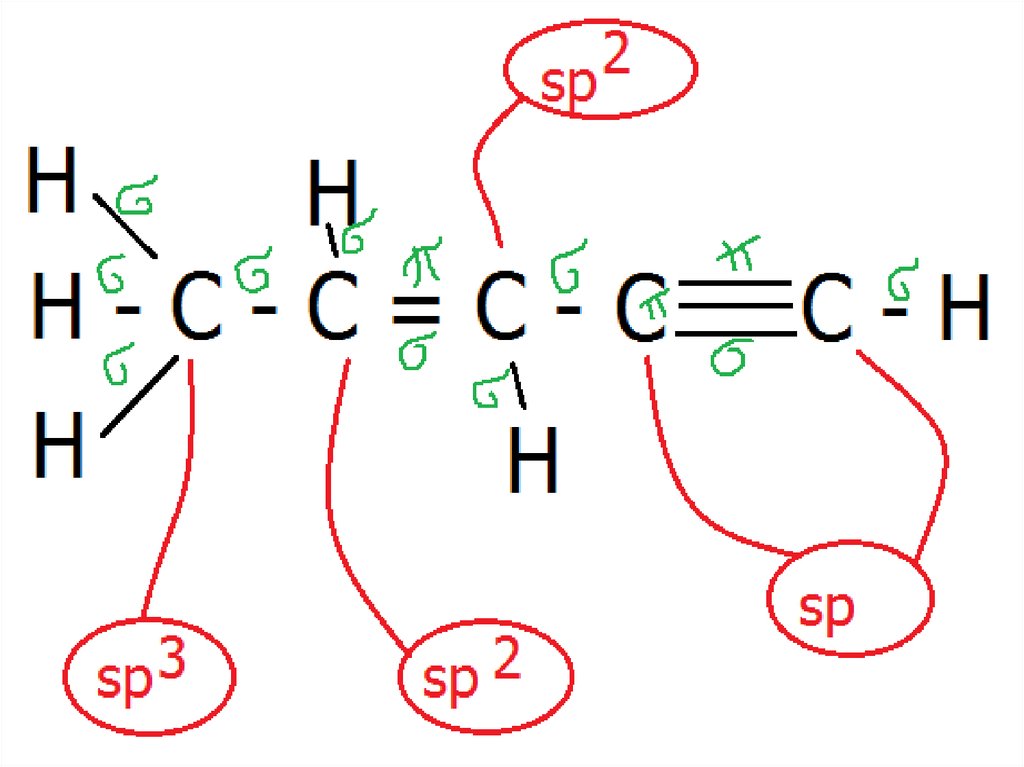
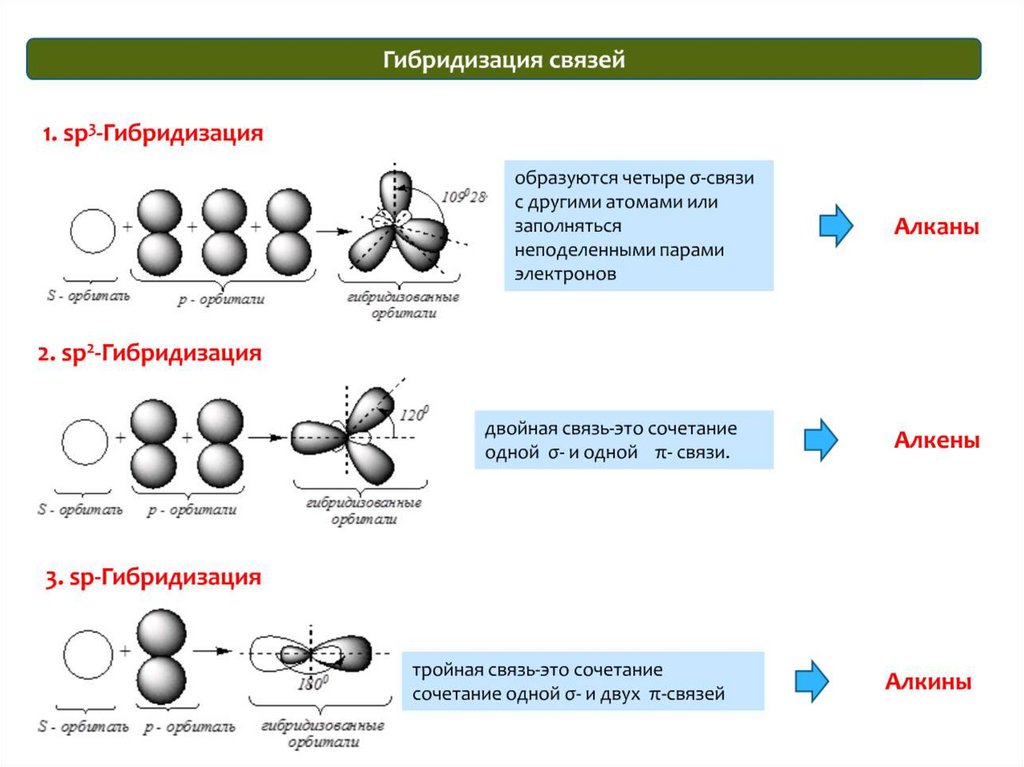
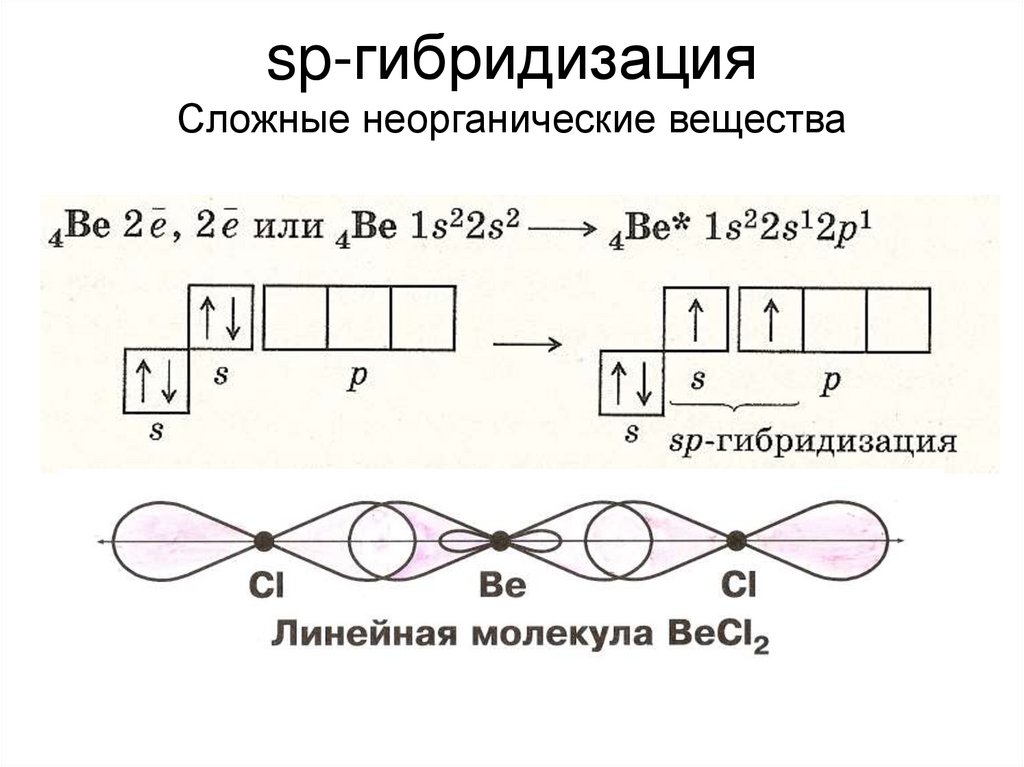
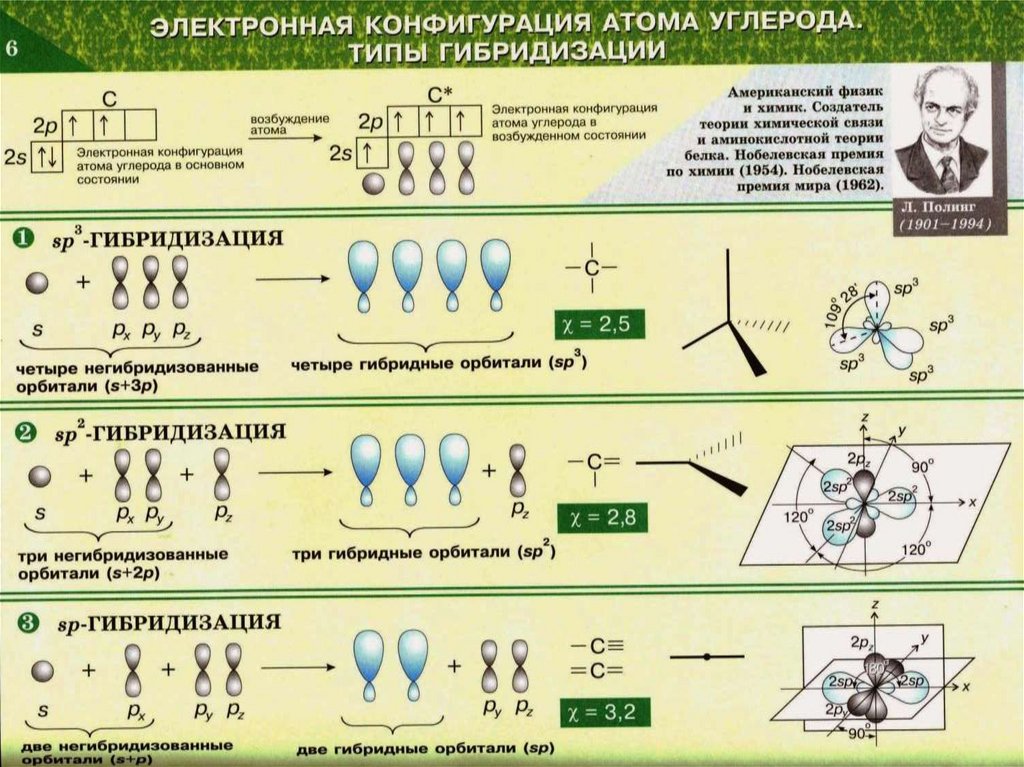
sp-гибридизацияСложные неорганические вещества
51.
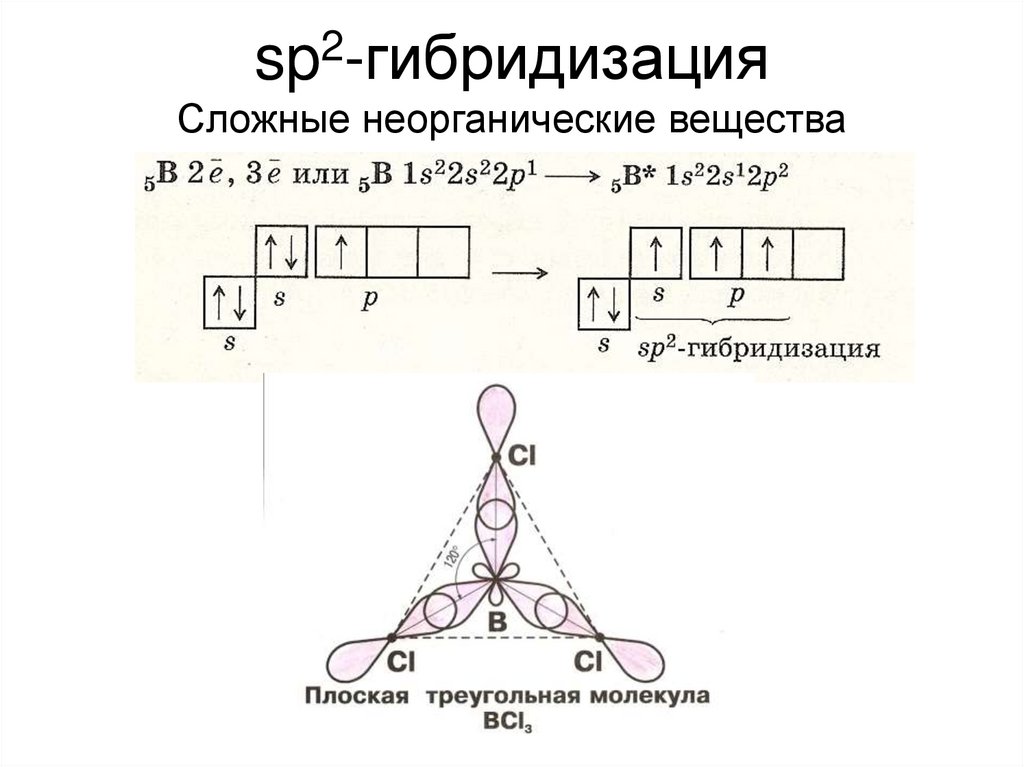
2sp -гибридизация
Сложные неорганические вещества
52.
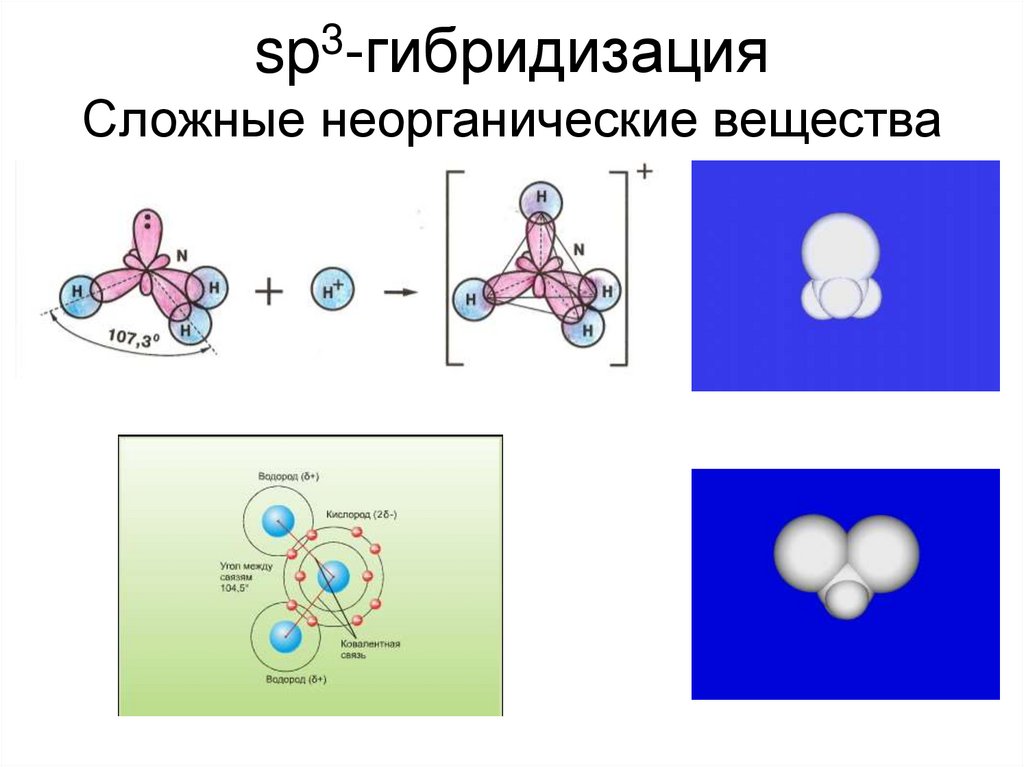
sp3-гибридизацияСложные неорганические вещества
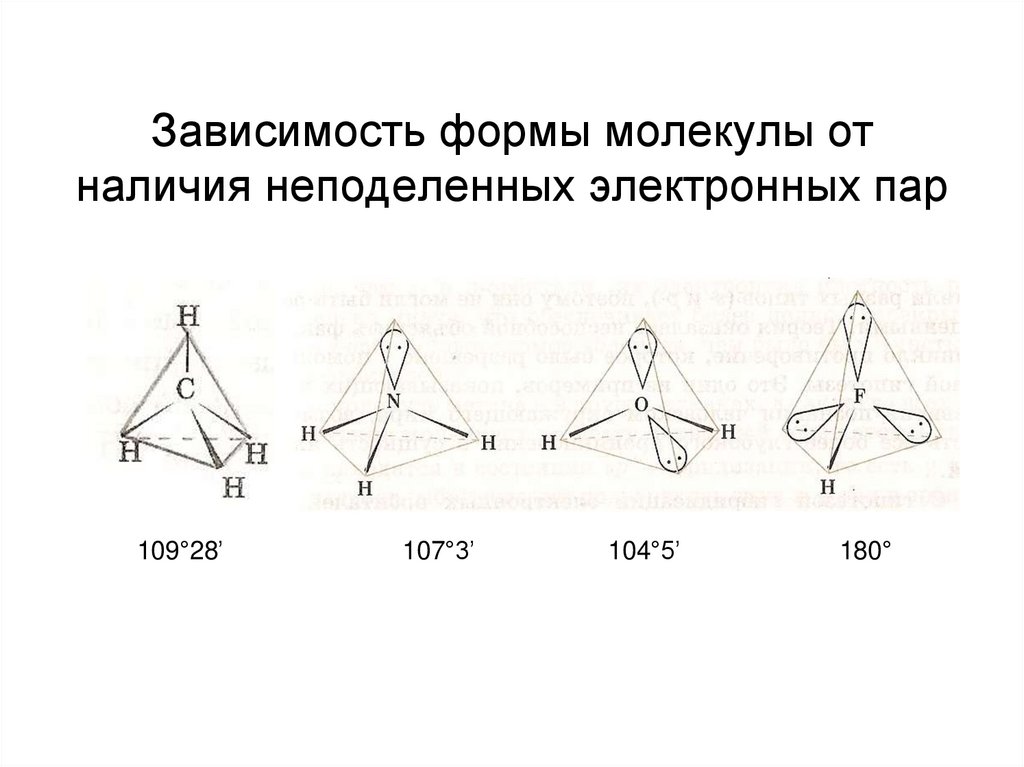
53. Зависимость формы молекулы от наличия неподеленных электронных пар
109°28’107°3’
104°5’
180°























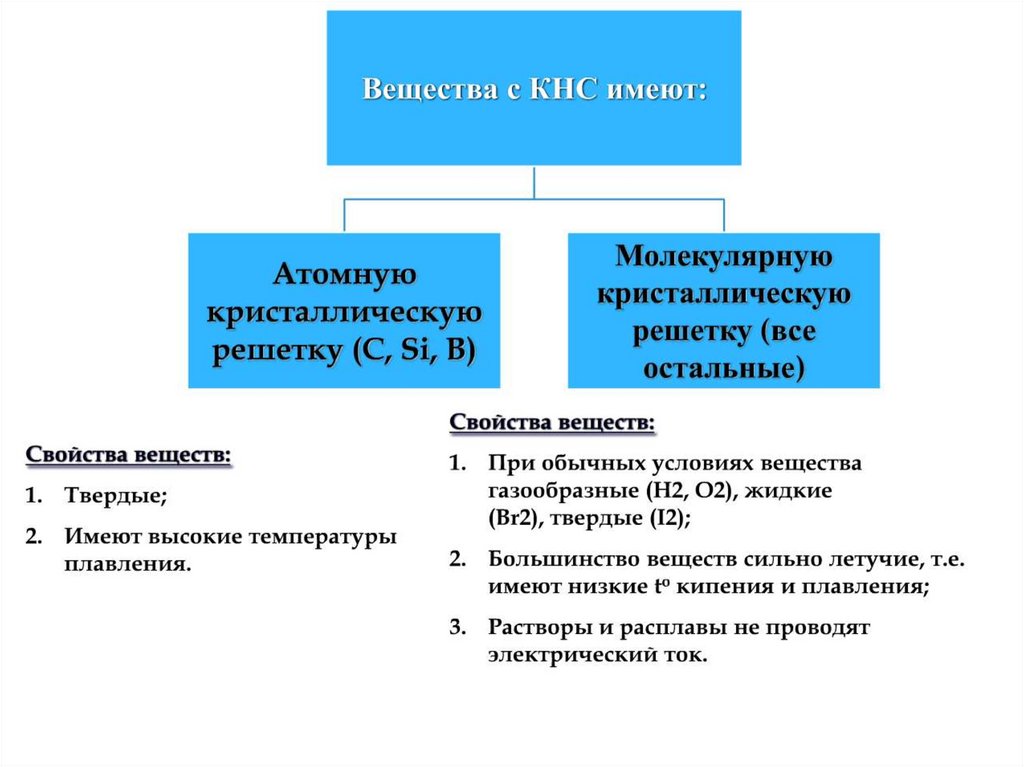
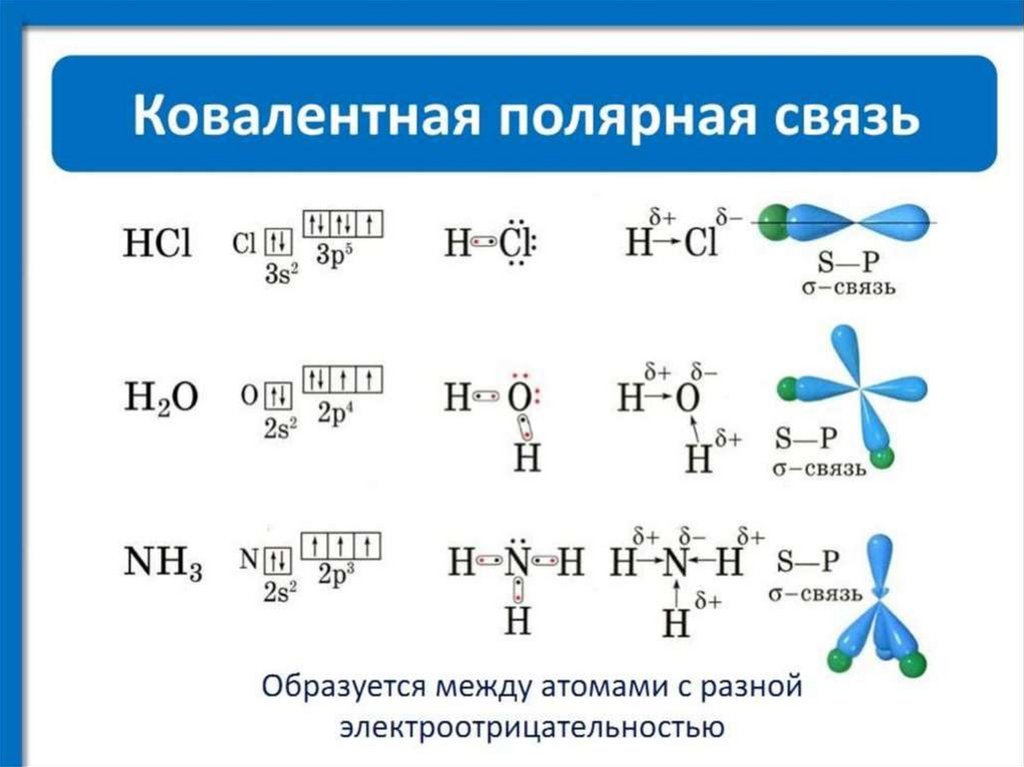
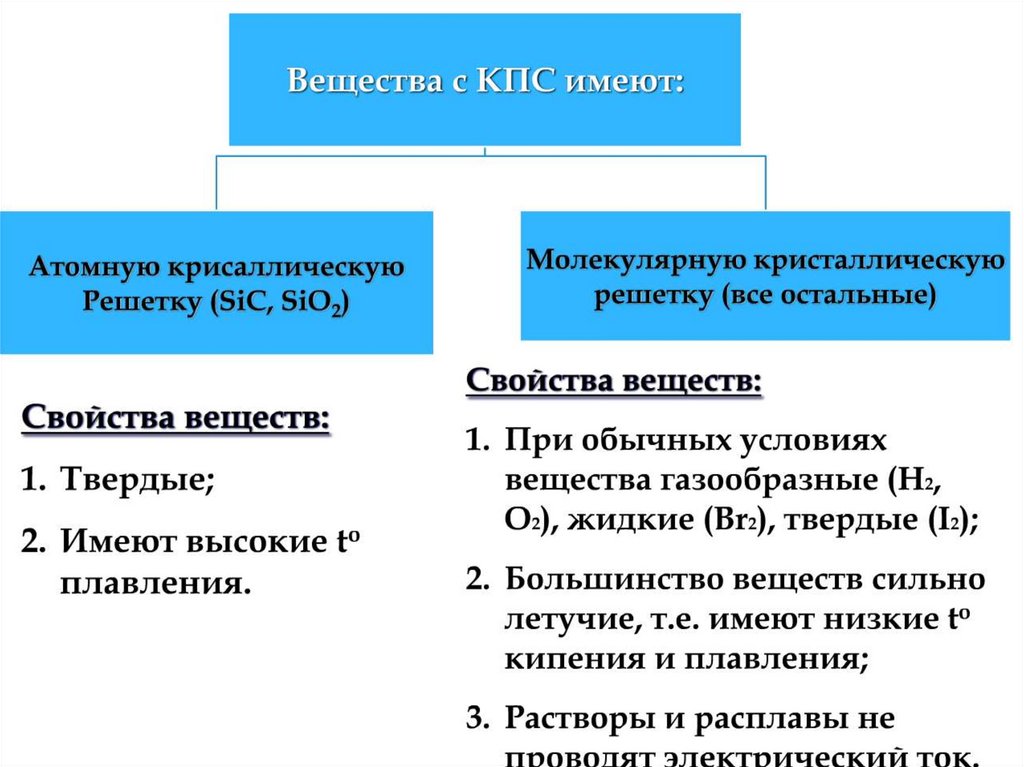

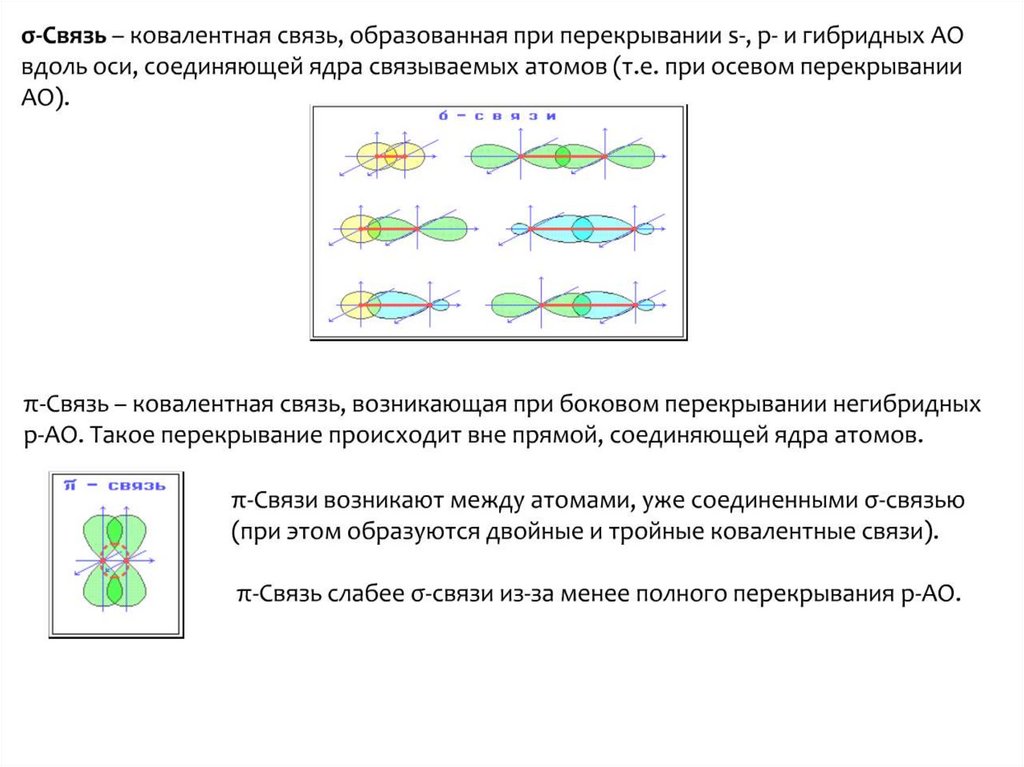





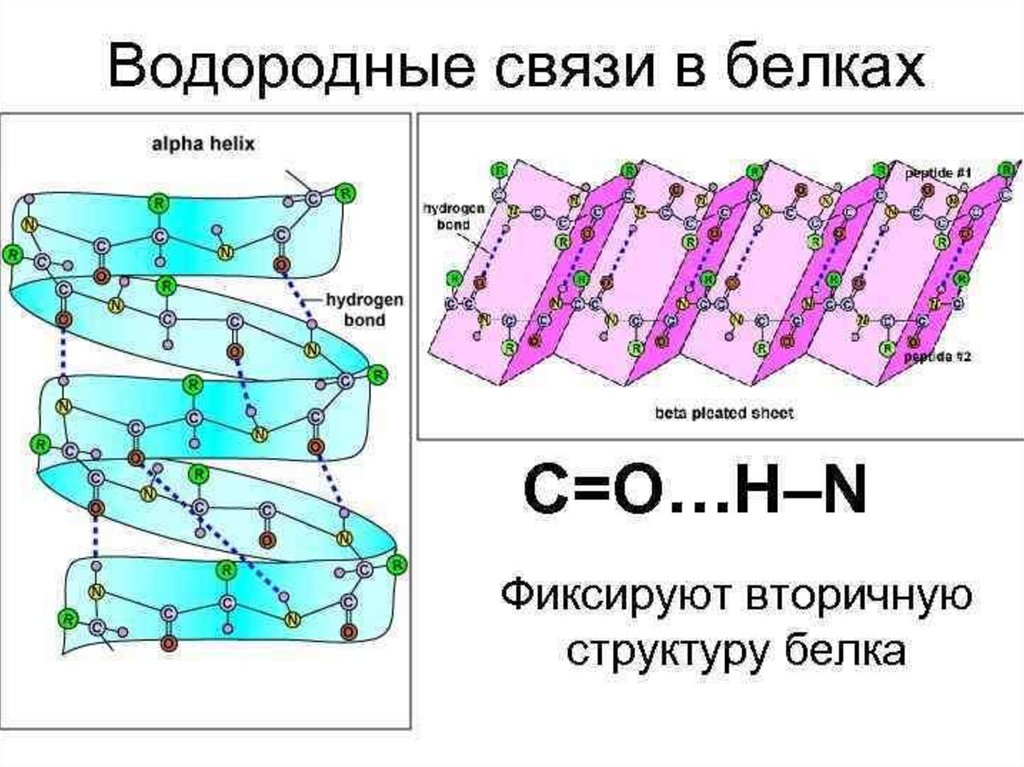
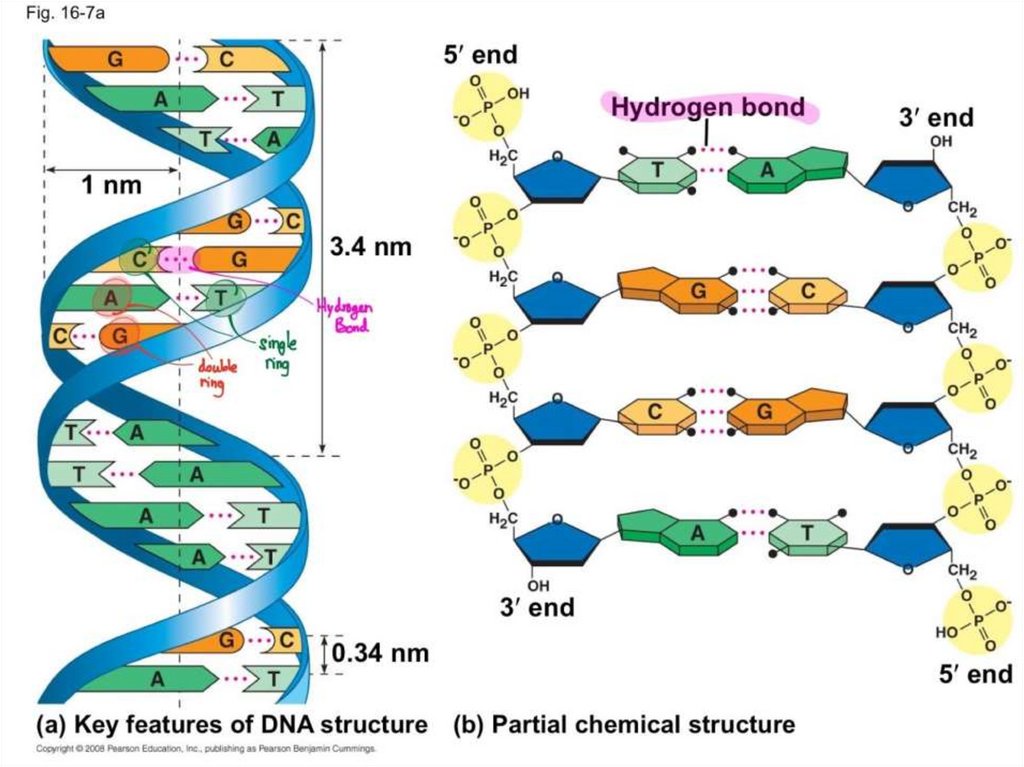
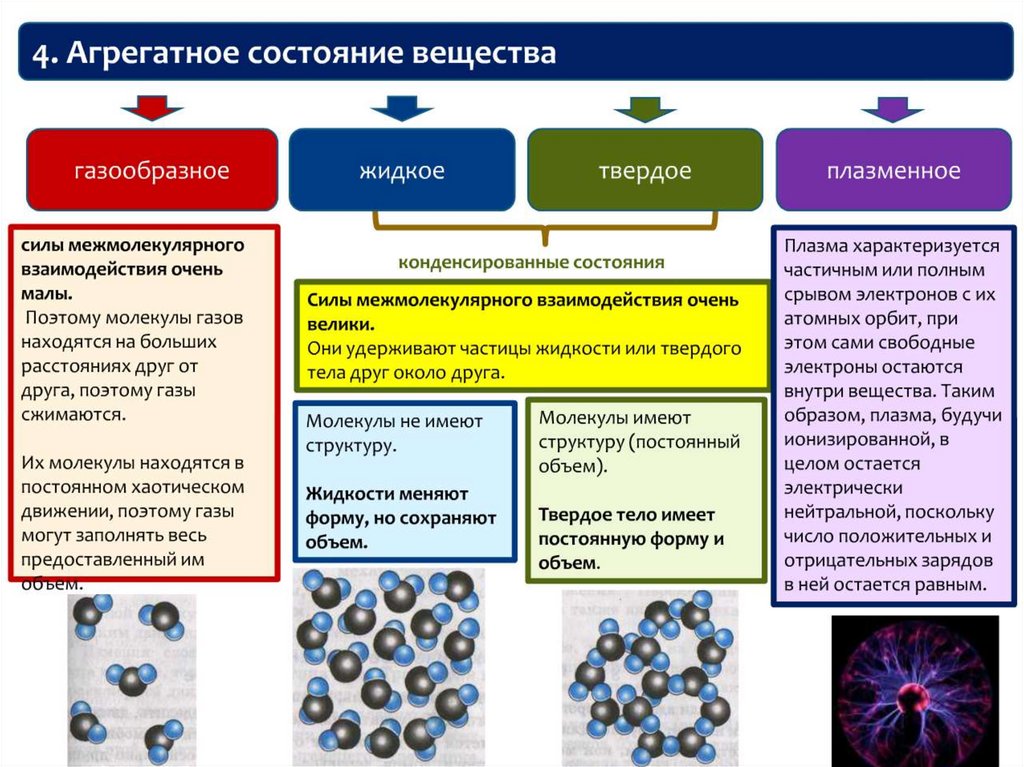
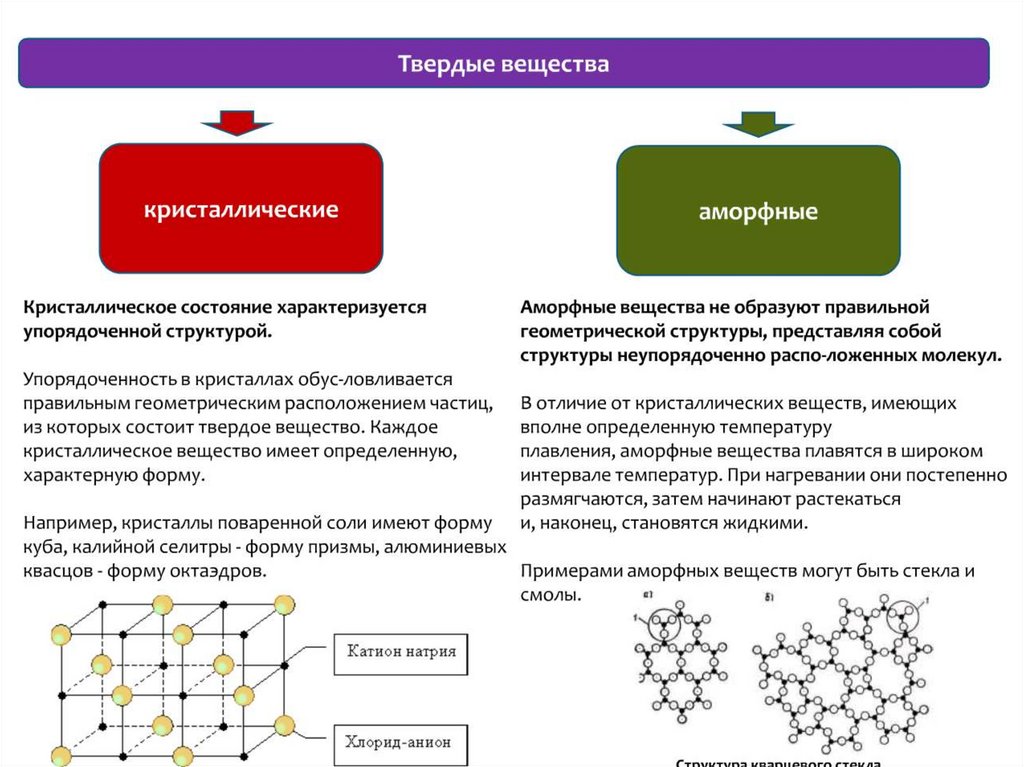


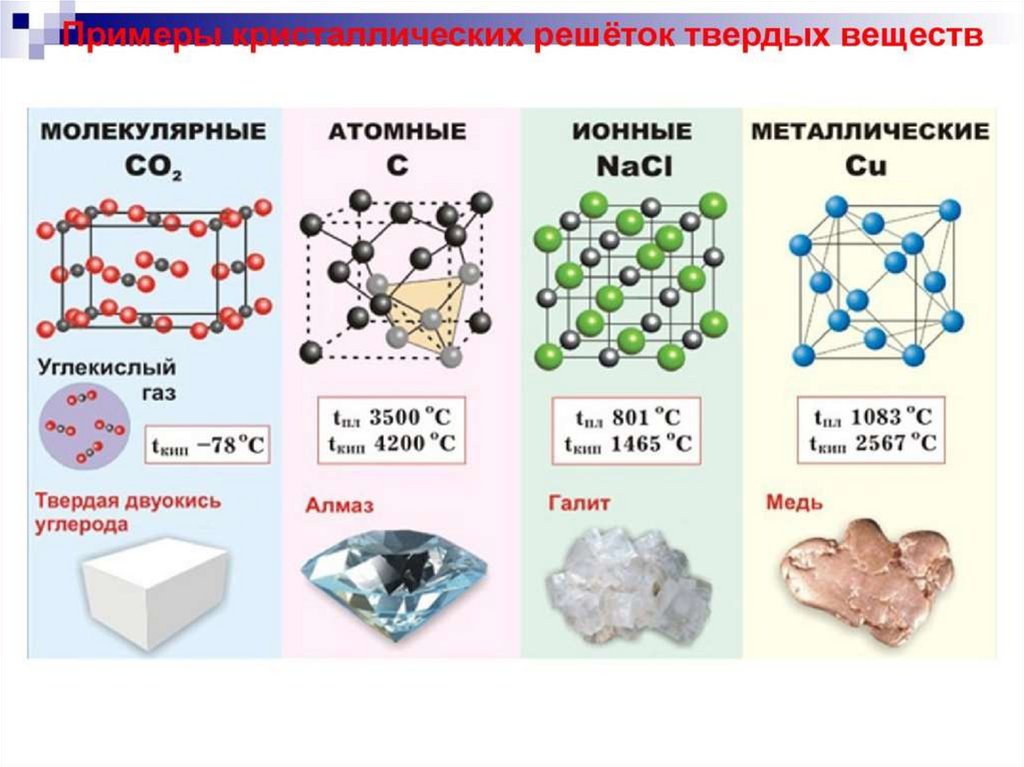
 chemistry
chemistry








