Similar presentations:
Химическая кинетика. Основные закономерности протекания химических реакций (лекция 5)
1.
Дисциплина Him 1204 «Химия» для специальности «6В05107 – Биология», 1 курсЛекция 5
Химическая кинетика. Основные закономерности
протекания химических реакций.
Закон действующих масс.
Влияние температуры на скорость химической
реакции.
2.
1. Основные понятия и представленияТермодинамика изучает только состояния систем, она не
прослеживает подробно путь реакции, поэтому она определяет лишь
потенциальную возможность ее протекания в определенном направлении.
В уравнениях термодинамики нет величины Времени
и она не
описывает скорости процессов.
Скорость реакции прямо не связана со значением энергии Гиббса
(ΔG).
Н-р, термодинамическая вероятность реакции окисления водорода до воды
Н2 + ½О2 = Н2О(ж), ΔG298 = −237,2 кДж/моль, значительно выше
чем вероятность реакции нейтрализации с образованием воды
Н+ + ОН− = Н2О(ж); ΔG298 = −79,9 кДж/моль
(1),
(2).
Однако (1) реакция в обычных условиях без катализатора практически не идет, а (2)
реакция протекает мгновенно.
3.
Основные понятия химической кинетикиХимическая кинетика – наука, изучающая скорости и механизмы
химических процессов, а также факторы, влияющие на них
Скорость химической реакции (Vх.р) - это изменение
концентрации какого-либо реагента или продукта в единицу
времени
Элементарный акт - каждое непосредственное взаимодействие
частиц, приводящее к изменению их химического строения
Элементарная стадия химического превращения - сумма всех
однотипных элементарных актов
Механизм химической реакции - совокупность элементарных
стадий, из которых складывается данная реакция
4.
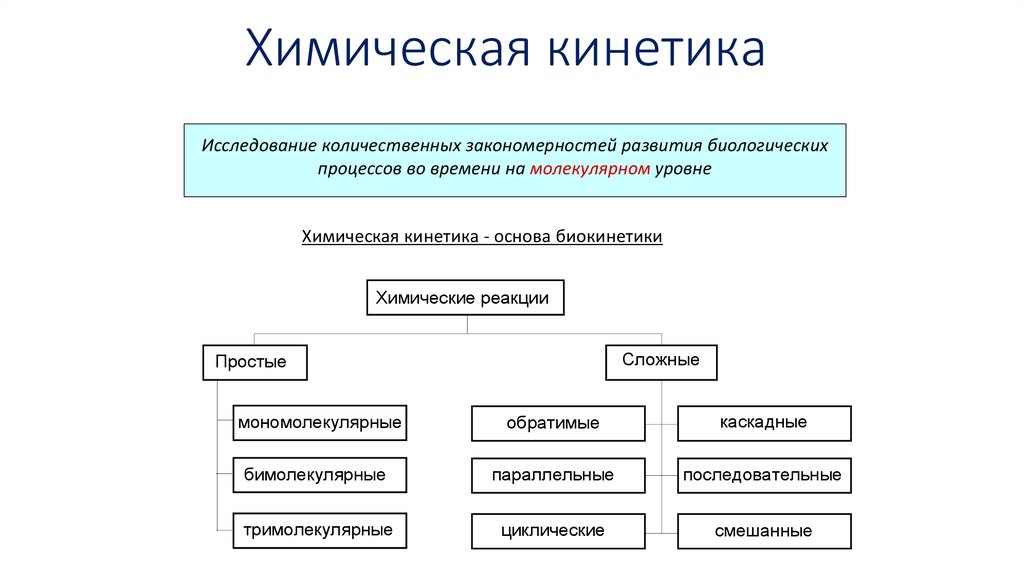
Химическая кинетикаИсследование количественных закономерностей развития биологических
процессов во времени на молекулярном уровне
Химическая кинетика - основа биокинетики
Химические реакции
Сложные
Простые
мономолекулярные
обратимые
каскадные
бимолекулярные
параллельные
последовательные
тримолекулярные
циклические
смешанные
5.
Химические процессыпростые (элементарные)
сложные
- механизм реакции
(совокупность элементарных стадий )
гомогенные
гетерогенные
системы
замкнутые
открытые
6.
7.
8.
Скорость химической реакции1 1 dN Ai
1 1 dN B j
w
i V dt
j V dt
V = const
1 d Ai 1 d B j
w
i dt
j dt
Элементарная реакция: w = число элементарных актов реакции
в единице объема в единицу времени.
9.
10.
Под механизмом реакции в кинетике понимают путь реакции, т. е.подробное изменение координат всех частиц в ее ходе, сближение и
удаление атомов и радикалов, повороты молекул и их частей, разрыв и
образование новых химических связей.
В ходе изменения координат атомов происходит изменение
энергии.
Механизм химической реакции удобно описывать с помощью
кривых потенциальной энергии (КПЭ) в координатах энергия (Е) − путь
реакции (q) (на самом деле реакция описывается поверхностью
потенциальной энергии − ППЭ в многомерном пространстве координат
всех атомов системы).
11.
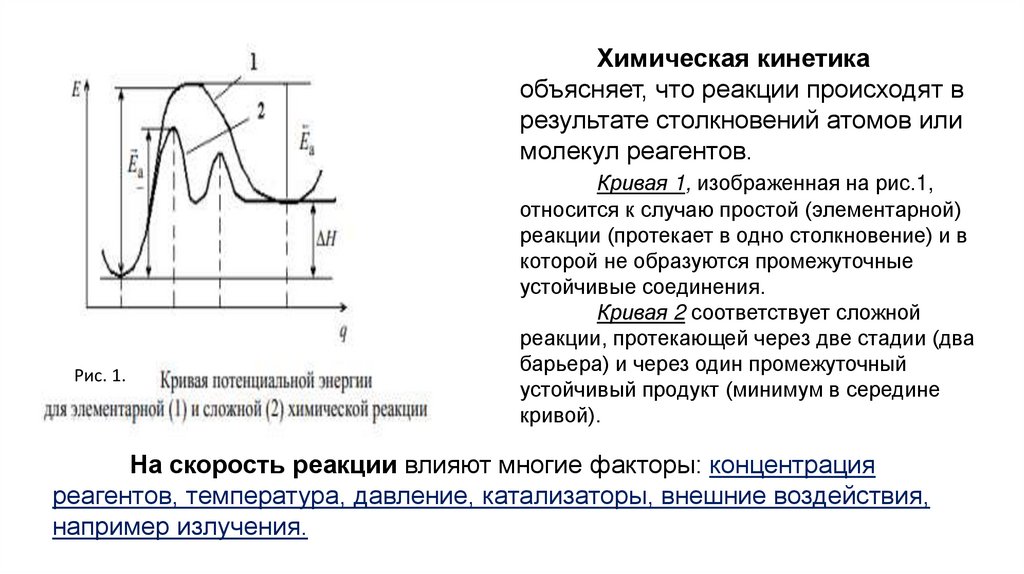
На рис. 1 показана схематично КПЭ(кривые потенциальной энергии) для
реакции реагент → →продукт (кривая 1).
На КПЭ есть минимумы (реагенты и
продукты) и максимум − для
промежуточного переходного состояния.
Такие максимумы − энергетические
барьеры (Еа) на пути реакции, причем они
разные для прямой и обратной реакции:
Ea макс. − Ea мин. = ΔHa реакции (1.3),
где Еа макс. и мин. − величины энергетических
барьеров (энергии активации).
Рис. 1.
Это выражение дает связь между кинетикой
(Еа – кинетический параметр) и
термодинамикой (ΔН) реакции.
12.
Химическая кинетикаобъясняет, что реакции происходят в
результате столкновений атомов или
молекул реагентов.
Рис. 1.
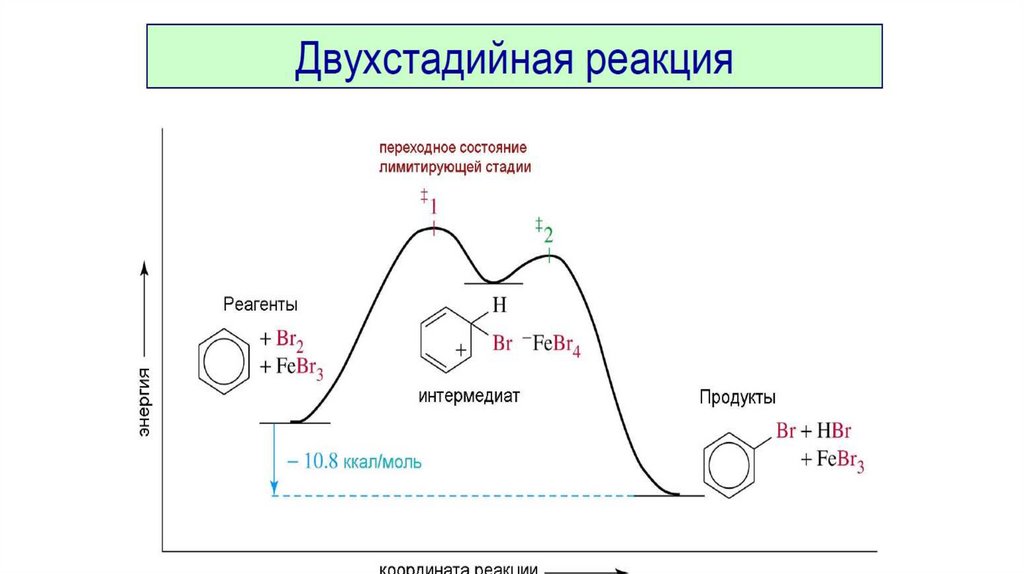
Кривая 1, изображенная на рис.1,
относится к случаю простой (элементарной)
реакции (протекает в одно столкновение) и в
которой не образуются промежуточные
устойчивые соединения.
Кривая 2 соответствует сложной
реакции, протекающей через две стадии (два
барьера) и через один промежуточный
устойчивый продукт (минимум в середине
кривой).
На скорость реакции влияют многие факторы: концентрация
реагентов, температура, давление, катализаторы, внешние воздействия,
например излучения.
13.
2. Влияние концентрации на скоростьхимической реакции
Т.к. скорость химической реакции зависит от столкновений, а
количество столкновений в единице объема (пропорционально
концентрации сталкивающихся молекул), то можно предположить, что
скорость реакции пропорциональна концентрациям реагентов, т. е.
для необратимой простой реакции
аА + bВ + .... = сС + dD + ...
(1.4)
(Закон действующих масс для кинетики),
где k − константа скорости, т. е. скорость реакции при [A] = [B] = моль/л
14.
Зависимость скорости химической реакцииот концентрации реагентов
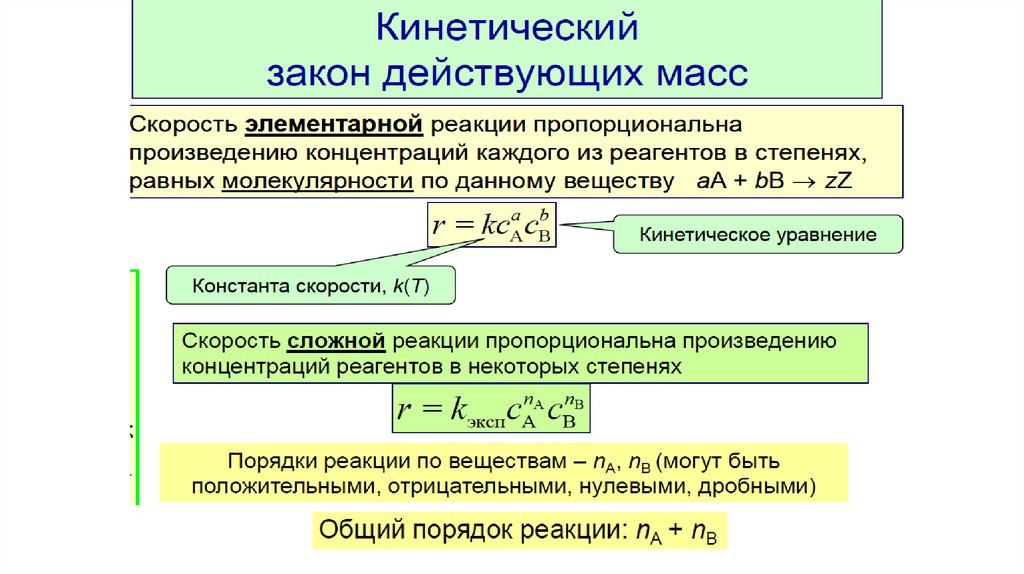
Закон действующих масс гласит: при постоянной температуре
скорость элементарной химической реакции пропорциональна
произведению концентраций реагирующих веществ, возведенных в
степени, равные стехиометрическим коэффициентам.
Элементарные реакции - реакции, протекающие в одну стадию
Кинетическое уравнение - математическая зависимость скорости
реакции от концентрации
Кинетические уравнения элементарных реакций:
бимолекулярной A + B = C
kC A CB
тримолекулярной 2A + B = D
kC2
A CB
k – константа скорости; СА, СВ – концентрации веществ, моль/л
15.
16.
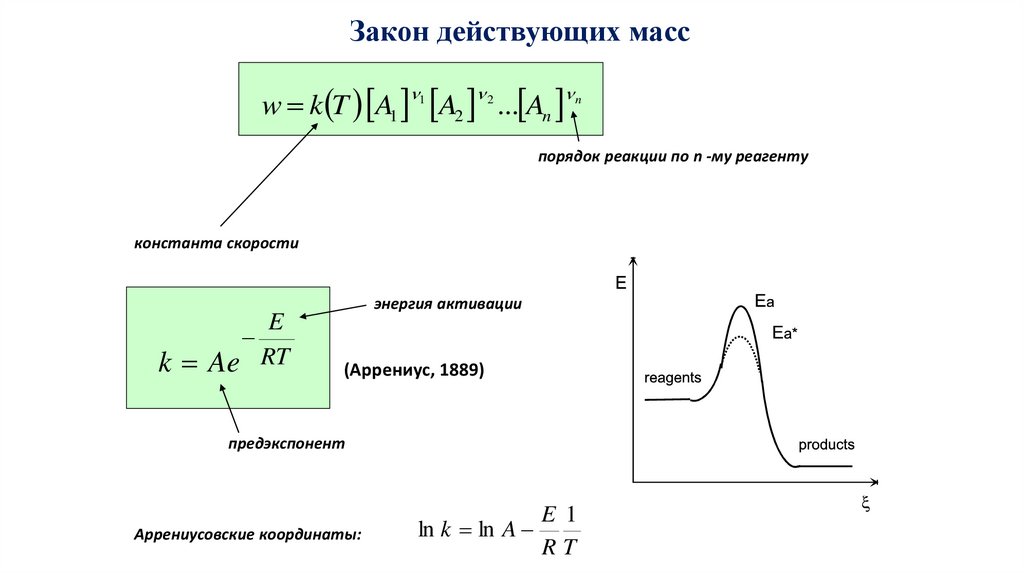
Закон действующих массw k T A1 A2 ... An
1
2
n
порядок реакции по n -му реагенту
константа скорости
k Ae
E
RT
энергия активации
(Аррениус, 1889)
предэкспонент
Аррениусовские координаты:
ln k ln A
E 1
RT
17.
18.
19.
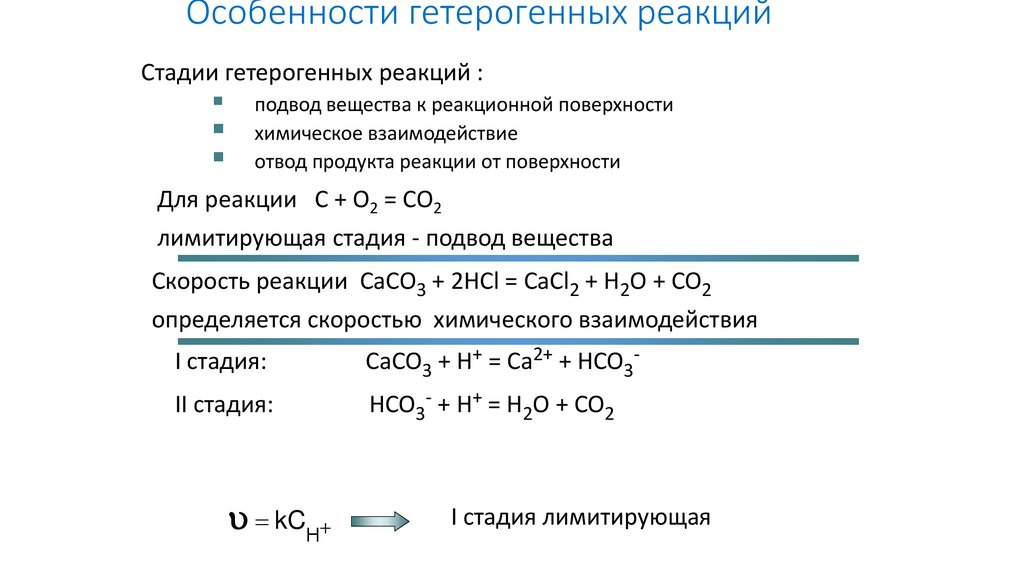
Особенности гетерогенных реакцийСтадии гетерогенных реакций :
подвод вещества к реакционной поверхности
химическое взаимодействие
отвод продукта реакции от поверхности
Для реакции C + O2 = CO2
лимитирующая стадия - подвод вещества
Скорость реакции CaCO3 + 2HCl = CaCl2 + H2O + CO2
определяется скоростью химического взаимодействия
I стадия:
CaCO3 + H+ = Ca2+ + HCO3-
II стадия:
HCO3- + H+ = H2O + CO2
kCН
I стадия лимитирующая
20.
3. Влияние давления на скорость химической реакцииВлияние давления существенно влияет на реакции с участием
газообразных веществ, так как концентрация реагентов меняется
пропорционально давлению (T = const)
Пример. Реакции 2NO(г) + 2H2(г) = N2(г) + 2Н2О(г)
соответствует кинетическое уравнение
2
kCNO
CH
2
При увеличении давления в 3 раза константа скорости не изменяется,
а концентрации реагирующих веществ увеличиваются в 3 раза
2
2 k(3CNO )2 3CH2 27kCNO
CH 27 1
2
скорость увеличивается в 27 раз
21.
Правило Вант-ГоффаПри повышении температуры на каждые 100 скорость
большинства реакций увеличивается в 2-4 раза:
T2 T1 (T2 -T1)/10
1 и 2 - скорость реакции при температурах
Т1 и Т2 (Т2 > Т1)
- температурный коэффициент скорости, равный 2 4
Например, при повышении температуры с 20 до 400С скорость
реакции (γ = 2) увеличивается в 4 раза:
Т2 4010 20 2
2
2 4
Т1
22.
23.
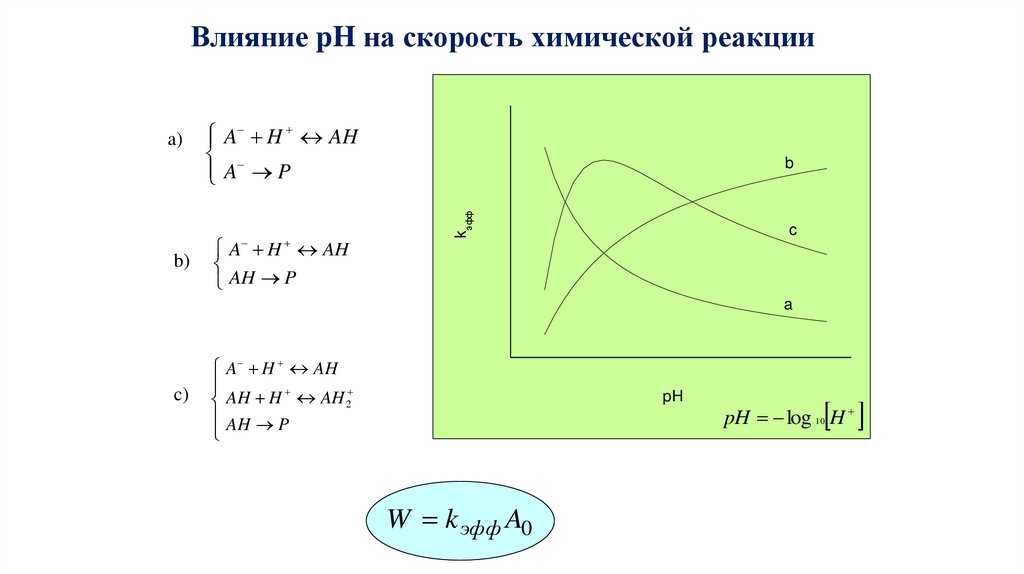
Влияние pH на скорость химической реакцииA H AH
A P
A H AH
AH P
b)
b
kэфф
a)
c
a
c)
A H AH
AH H AH 2
AH P
pH
W k эфф A0
pH log 10 H
24.
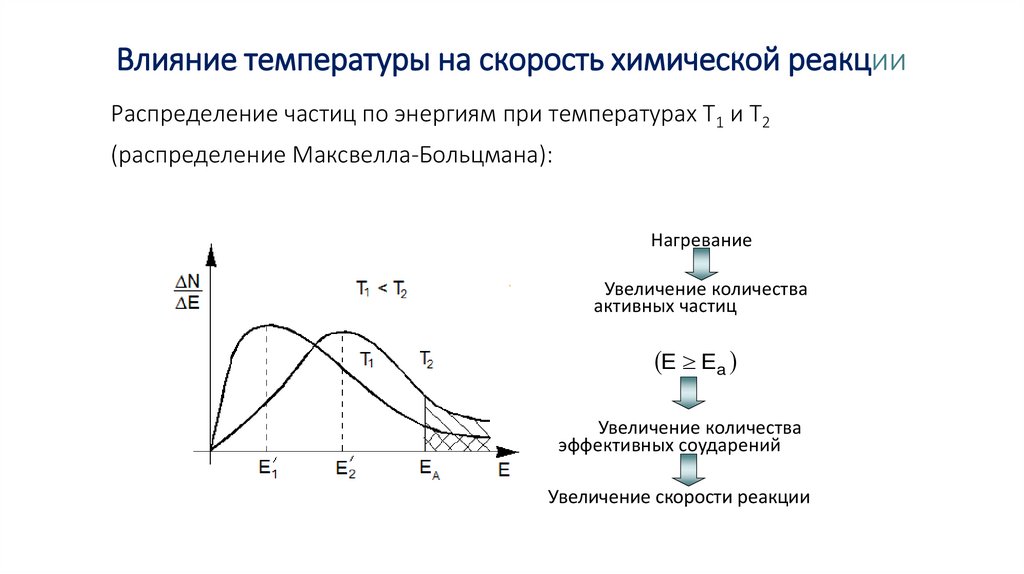
Влияние температуры на скорость химической реакцииРаспределение частиц по энергиям при температурах Т1 и Т2
(распределение Максвелла-Больцмана):
Нагревание
Увеличение количества
активных частиц
E Ea
Увеличение количества
эффективных соударений
Увеличение скорости реакции
25.
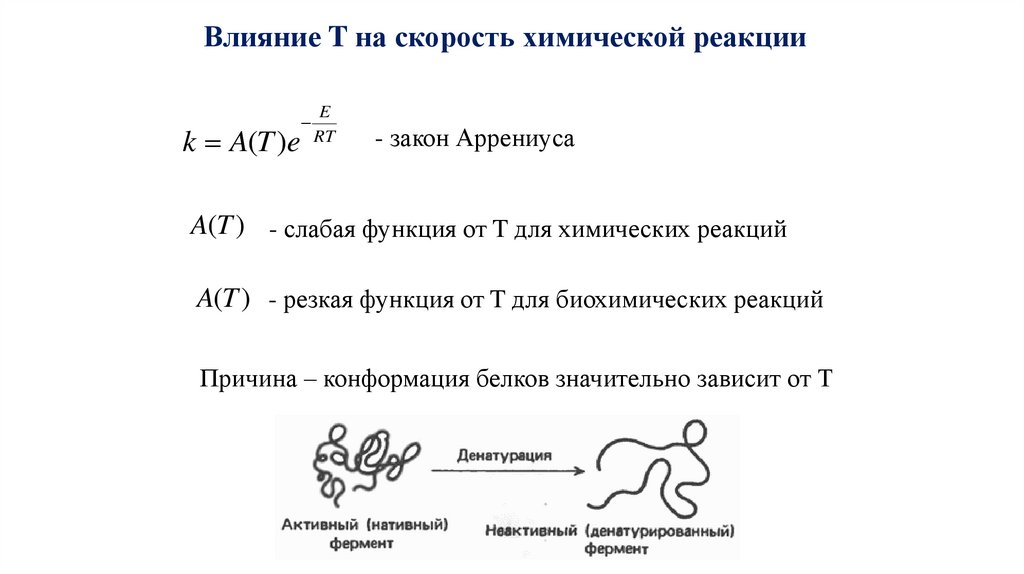
Влияние T на скорость химической реакцииk A(T )e
E
RT
- закон Аррениуса
A(T ) - слабая функция от T для химических реакций
A(T ) - резкая функция от T для биохимических реакций
Причина – конформация белков значительно зависит от Т
26.
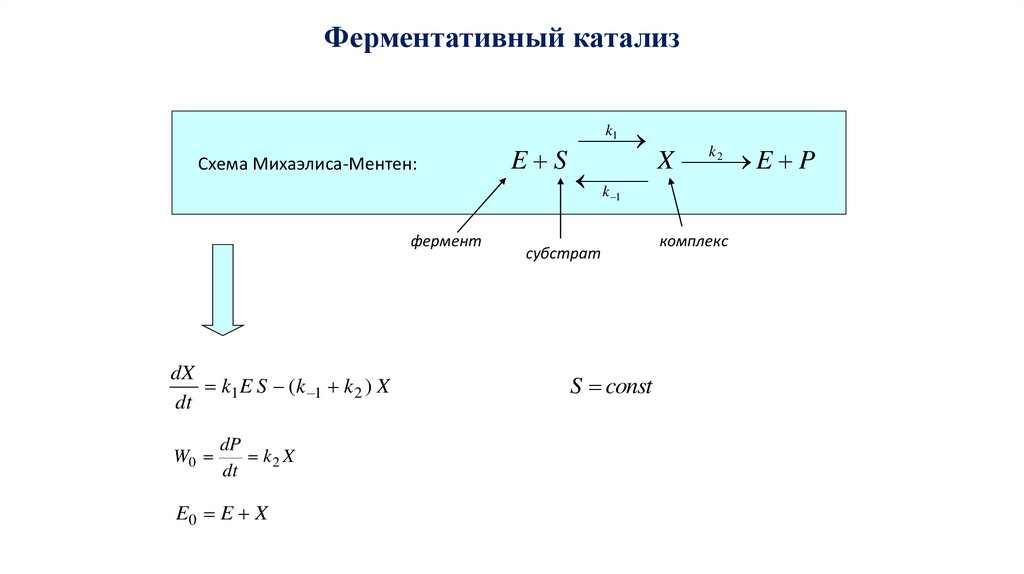
Ферментативный катализСхема Михаэлиса-Ментен:
фермент
dX
k1 E S (k 1 k 2 ) X
dt
W0
dP
k2 X
dt
E0 E X
k1
k2
E S
X
E P
k 1
субстрат
S const
комплекс
27.
Ферментативный катализP(t )
k 2 E0 S
k 2 E0 S
exp k1 S K m t 1
t
K m S 0 k1S k 1 k 2
Km S
Wm S
W
Km S
стационарная скорость
Km
k 1 k 2
k1
константа Михаэлиса
Wm Wmax k 2 E0
максимальная скорость
28.
Зависимость константы скорости от температурыУравнение Аррениуса
E
RT
- а
k Ae
Еа - энергия активации, кДж/моль
R - универсальная газовая постоянная, равная
8,31∙10-3
кДж /(моль К )
Т - абсолютная температура, К
А - коэффициент пропорциональности, отражающий
вероятность столкновения активных частиц;
величина постоянная для данной реакции
29.
Влияние катализаторов на скоростьхимической реакции
Катализаторы - вещества, увеличивающие скорость реакции и остающиеся в
конце реакции химически неизменными
Катализаторы применяют для изменения скорости термодинамически
возможных процессов ( G<0)
Ингибиторы - вещества, снижающие скорость реакции
Промоторы – вещества, добавки которых к катализатору усиливают
эффективность его действия
Автокатализ – увеличение скорости реакции под действием одного из
продуктов
Выделяют гомогенный и гетерогенный катализ
2SO2(г) + О2(г)= 2SO3(г)
катализатор NO(г) гомогенный катализ
катализатор V2O5(к) или Pt(к) гетерогенный катализ
30.
31.
32.
Задачи на определение Скорости химических реакций33.
Пример 2.34.
Пример 3.35.
Пример 4.36.
Пример 5.37.
ЗаключениеХимическая кинетика изучает скорости и механизмы химических процессов, а также
факторы, влияющие на них
Скорость реакции - изменение количества любого из реагирующих веществ или
продуктов реакции за единицу времени в единице реакционного пространства
Энергия активации - минимальная избыточная энергия частиц по сравнению со
средним уровнем, необходимая для протекания реакции
Скорость реакции зависит от C, p, T и катализатора:
• зависимость скорости от концентраций реагирующих веществ выражается
экспериментально получаемым кинетическим уравнением;
• изменение давления в системе приводит к пропорциональному изменению
концентраций газообразных реагентов и соответствующему изменению
скорости
• в соответствии с правилом Вант-Гоффа при повышении температуры на каждые
10о скорость большинства реакций увеличивается в 2 4 раза
• катализаторы - вещества, увеличивающие скорость реакции за счет снижения
энергии активации
38.
Рекомендуемая литература:Ос н овн ая ли те ра т ура
1. Ахметов Н.С. Общая и неорганическая химия. –М: Лань, - 2018. – 744 с.
2. Глинка Н.Л. Общая химия. М.: КноРус, - 2020. - 750 с.
3. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. – М.: Медиа, - 2012. 416 с.
4. Травень В.Ф. -Органическая химия. – М.: Академкнига. Т.1.– 2004.- 727 с.
Д о п ол н и те л ь н ая л и те р а т ур а
5. Глинка Н.Л. Задачи и упражнения по общей химии. М.: КноРус, - 2015. -265 с.
6. Кукушкин Ю.Н. Химия координационных соединений. – М.: Высшая школа. 2015. – 455 с.
7. Никольский А.Б., Суворов А.В. Общая и неорганическая химия. – Юрайт, 2021. – 378 с.
Электронные и интернет-ресурсы
1) https://chemistry.ru/
2) https://fen.nsu.ru/posob/gchem/UMK_2012_inorg_chem_chem.pdf
3) https://portal.tpu.ru/SHARED/m/MYY/education/Tab2/labor.pdf


























 chemistry
chemistry








