Similar presentations:
Висмут. 9 класс
1. ВИСМУТ
Подготовил: ученик9А класса
Ярмонов Родион
2. Содержание
1.Положение в Периодической системеД.И.Менделеева. Строение атома
2. История происхождения названия
3. Нахождение в природе
4. Физические свойства
5. Химические свойства
6. Получение
7. Сплавы
8.Применение
9. Биологическая роль
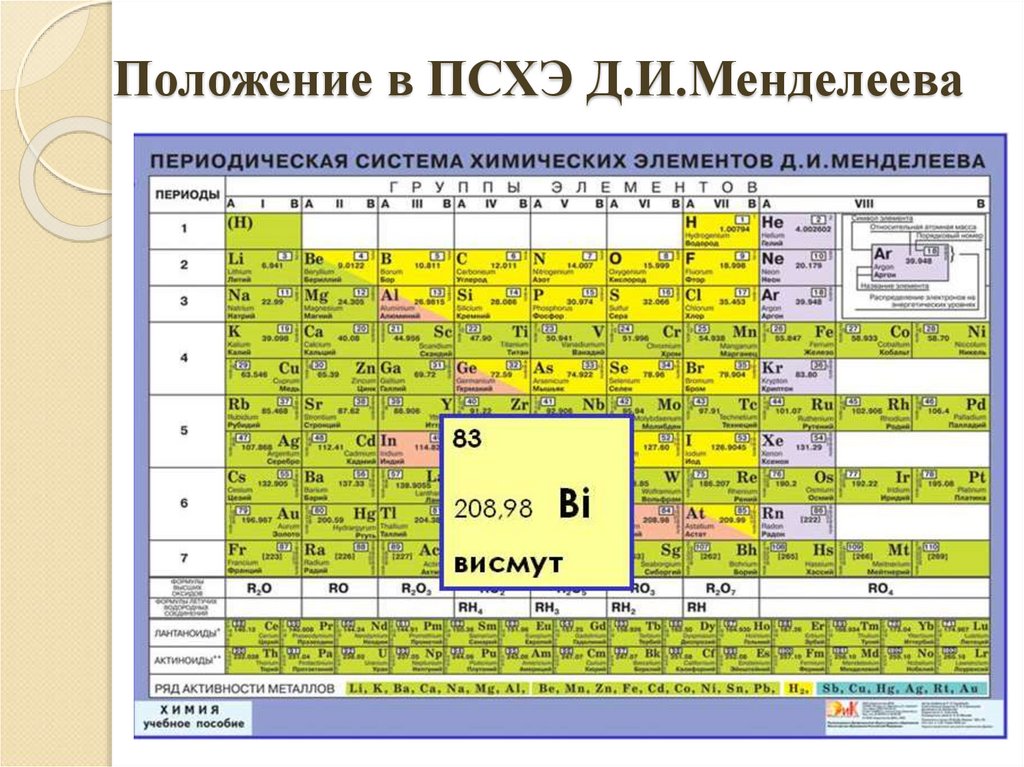
3. Положение в ПСХЭ Д.И.Менделеева
4. Строение атома
5. О происхождении названия
Предположительно латинское Bismuthum или bisemutumпроисходит от немецкого weisse Masse, «белая масса».
В Средневековье висмут часто использовался
алхимиками во время опытов. Добывающие руду
шахтёры называли его tectum argenti, что означает
«серебряная крыша», при этом они считали, что висмут
был наполовину серебром.
Висмут использовали не только в Европе. Инки
применяли висмут в процессе изготовления холодного
оружия, из-за него мечи отличались особой красотой, а
их блеск был вызван радужным окислением, которое
являлось следствием образования на поверхности
металла тонкой плёнки оксида висмута.
6. Из истории…
Висмут не был отнесён к самостоятельномуэлементу, и полагали, что он является
разновидностью свинца, сурьмы или олова.
Впервые о висмуте упоминается в 1546 году в
трудах немецкого минералога и металлурга
Георгиуса Агриколы.
В 1739 году немецким химиком Поттом И. Г.
было установлено, что висмут является всётаки отдельным химическим элементом.
Через 80 лет шведский химик Берцелиус
впервые ввёл символ элемента Bi в
химическую номенклатуру.
7. Нахождение в природе
Содержание висмута в земной коре — 2⋅10−5 % по массе,в морской воде — 2⋅10−5 мг/л.
В мировой практике около 90 % всего добываемого
висмута извлекается попутно при металлургической
переработке свинцово-цинковых, медных, оловянных
руд и концентратов, содержащих сотые и иногда десятые
доли процента висмута.
Минералами висмута, входящими в состав таких руд, а
также руд других металлов, являются висмут
самородный (содержит 98,5—99 % Bi), висмутин Bi2S3
(81,30 % Bi), тетрадимит Bi2Te2S (56,3—59,3 % Bi),
козалит Pb2Bi2S5 (42 % Bi), бисмит Bi2O3 (89,7 % Bi),
висмутит Bi2CO3(OH)4 (88,5—91,5 % Bi), виттихенит
Cu3BiS3, галеновисмутит PbBi2S4, айкинит CuPbBiS3.
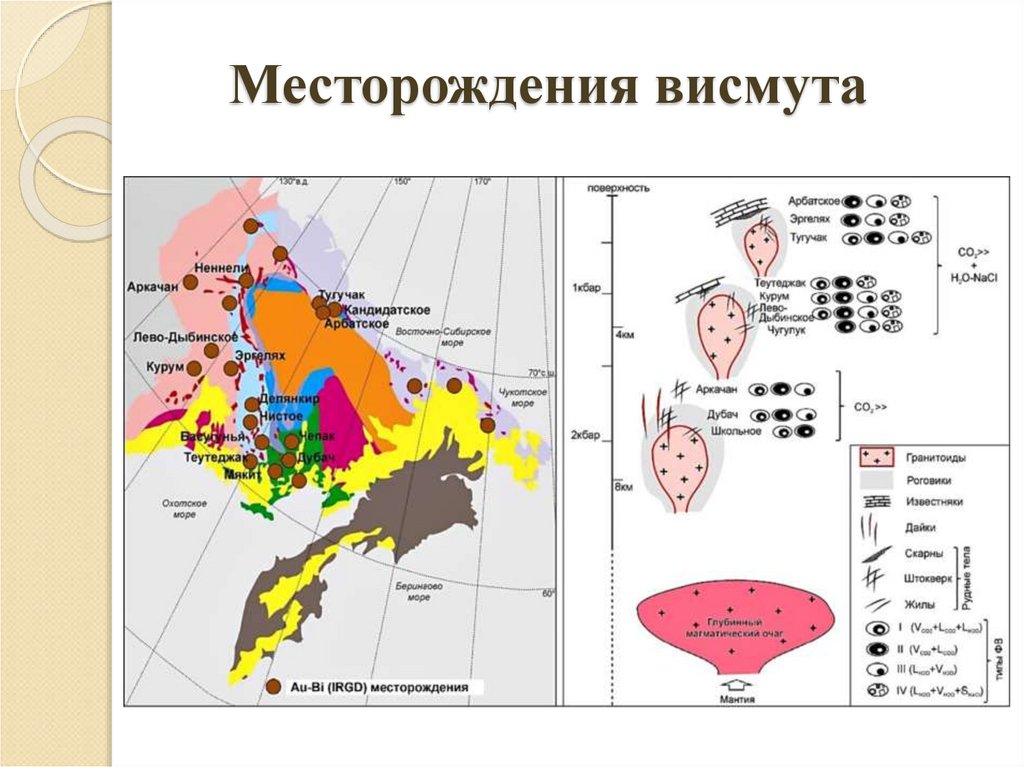
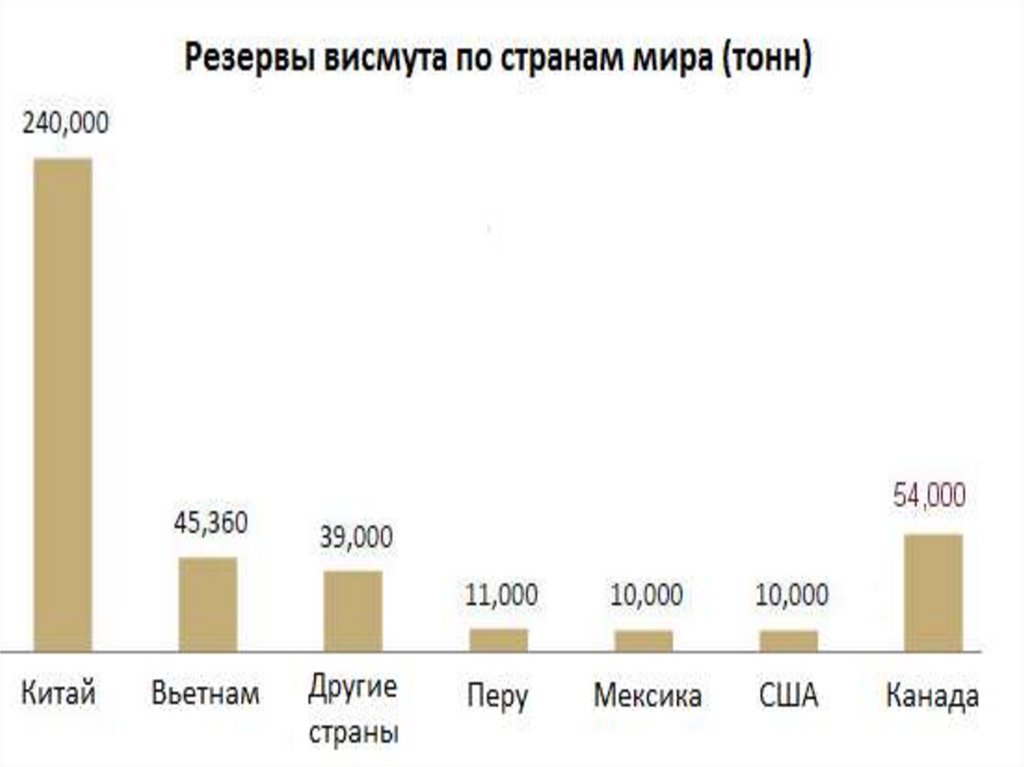
8. Месторождения висмута
9.
10. Физические свойства
Висмут — металл серебристо-белого цвета с розоватымоттенком. Известны восемь кристаллографических
модификаций висмута, семь из них получены при
высоком давлении.
Плотность (при н. у.) 9,79 г/см³
Температура
плавления
271,44 °C, 544,5 K
Температура кипения 1837 K
Уд. теплота плавления 11,30 кДж/моль
Уд. теплота испарения 172,0 кДж/моль
Молярная
теплоёмкость
Молярный объём
26,0[2] Дж/(K·моль)
21,3 см³/моль
11. Висмут — диамагнетик
Висмут — диамагнетикВисмут — сильнейший диамагнетик среди всех
металлов. Диамагнетик — это вещество, способное
намагничиваться навстречу направлению приложенного
магнитного поля; из неметаллов диамагнетиками
являются, например, водород, азот, инертные газы.
Эффект диамагнетизма висмута можно легко наблюдать
без специального оборудования: если его поместить
между полюсами обычного магнита, то он, стремясь
с одинаковой силой оттолкнуться от обоих полюсов,
займет положение на равном от
них расстоянии.
Это так называемая
диамагнитная левитация.
12. Химические свойства
В соединениях висмут проявляет степени окисления −3, +1,+2, +3, +4, +5. При комнатной температуре в среде сухого
воздуха не окисляется, но в среде влажного воздуха
покрывается тонкой плёнкой оксида.
1. При достижении температуры выше 1000 °C сгорает с
образованием оксида Bi2O3:
4Bi + 3O2 → 2Bi2O3
2.Взаимодействие висмута с серой или с сернистым газом
сопровождается образованием сульфидов BiS, Bi2S3.
Bi + S →510oC BiS
2Bi + 3S →300−400oC Bi2S3
С металлами способен образовывать интерметаллиды —
висмутиды.
Висмут также способен образовывать висмуторганические
соединения, такие, как триметилвисмут Bi(CH3)3 и
трифенилвисмут Bi(C6H5)3.
13. Химические свойства
3. Висмут проявляет стойкость по отношению кконцентрированной соляной и разбавленной серной
кислотам, но растворяется азотной кислотой и царской
водкой.
Bi + 4HNO3 → Bi(NO3)3 + NO↑ + 2H2O
Bi + 3HCl + HNO3 → BiCl3 + NO↑ + 2H2O
4. Реагирует с тетраоксидом диазота с образованием
нитрата висмута:
Bi + 3N2O4 →70−110oC Bi(NO3)3 + 3NO↑
5. С концентрированной серной кислотой растворяется с
образованием сульфата висмута:
2Bi + 6H2SO4 → Bi2(SO4)3 + 3SO2↑ + 6H2O
6. Взаимодействие висмута с фтором, хлором, бромом и
йодом сопровождается образованием различных
галогенидов:
2Bi + 5F2 →600−700oC 2BiF5
2Bi + 3Cl2 →200oC 2BiCl3
14.
Получение висмута основано на переработкеполиметаллических медных и свинцовых концентратов и висмутовых
руд методами пирометаллургии и гидрометаллургии. Процесс идет по
реакции:
Bi2S3 + 3Fe → 2Bi + 3FeS
В случае использования окисленных руд висмут восстанавливают
углеродом под слоем легкоплавкого флюса при температурах 900—
1000 °C:
Bi2O3 + 3C → 2Bi + 3CO
Сульфидные руды могут быть переведены в оксидные по реакции:
2Bi2S3 + 9O2 → 2Bi2O3 + 6SO2
Вместо углерода может быть использован сульфит натрия, который
восстанавливает оксид висмута при температуре 800 °C по реакции:
Bi2O3 + 3Na2SO3 → 2Bi + 3Na2SO4
Сульфид висмута может быть восстановлен до висмута с помощью
соды при температуре около 950 °C или с помощью гидроксида
натрия при температуре 500—600 °C.
4Bi2S3 + 12Na2CO3 → 8Bi + 9Na2S + 3Na2SO4 + 12CO2
4Bi2S3 + 24NaOH → 8Bi + 9Na2S + 3Na2SO4 + 12H2O
15. Висмутовые сплавы
ВИСМУТОВЫЕ СПЛАВЫ, довольно многочисленнаягруппа сплавов разнообразного состава, содержащих Bi в
количествах от 1 до 60%. В качестве других компонентов
в висмутовые сплавы входят Pb, Sn и Cd, реже Sb и Сu.
Висмутовые сплавы характеризуются низкой и резко
выраженной хрупкостью. Степень хрупкости находится в
зависимости от содержания Bi. Малая усадка
висмутовых сплавов при затвердевании позволяет
применять многие из них для производства отливок с
тонкими извилистыми контурами и сложным рисунком.
16. Применение
17. В медицине
Висмут – тяжелый металл. Его соединения, обладающиерезорптивным и местным действием, нашли применение
в медицине, которое довольно широко распространено.
Висмут, как и прочие тяжелые металлы, способен давать
соединения с белками, поэтому препараты на его
основе обладают антисептическими и вяжущими
свойствами.
18. В ювелирном деле
Магические свойства висмутаВисмут – это эталон гармонии любви,
жизни, мира, созидания и красоты. Этот
необыкновенный металл может
преобразить окружение до неузнаваемости.
Все вредно преобразовывается в полезное
под действием висмута. Он способен
воплощать в жизнь все добрые, позитивные
и хорошие желания. Висмут улучшает
психофизическое состояние человека,
выводит из депрессивного состояния,
приободряет, вселяет надежду. К тому же
висмут обладает способностью очищать
ауру человека, создавать защитный барьер.
19. Биологическая роль
Содержание висмута в человеческоморганизме составляет:
мышечная ткань — 0,32×10−5 %
костная ткань — менее 0,2×10−4 %
кровь — ~0,016 мг/л
ежедневный приём с пищей 0,005—
0,02 мг.


















 chemistry
chemistry








