Similar presentations:
Серная кислота
1.
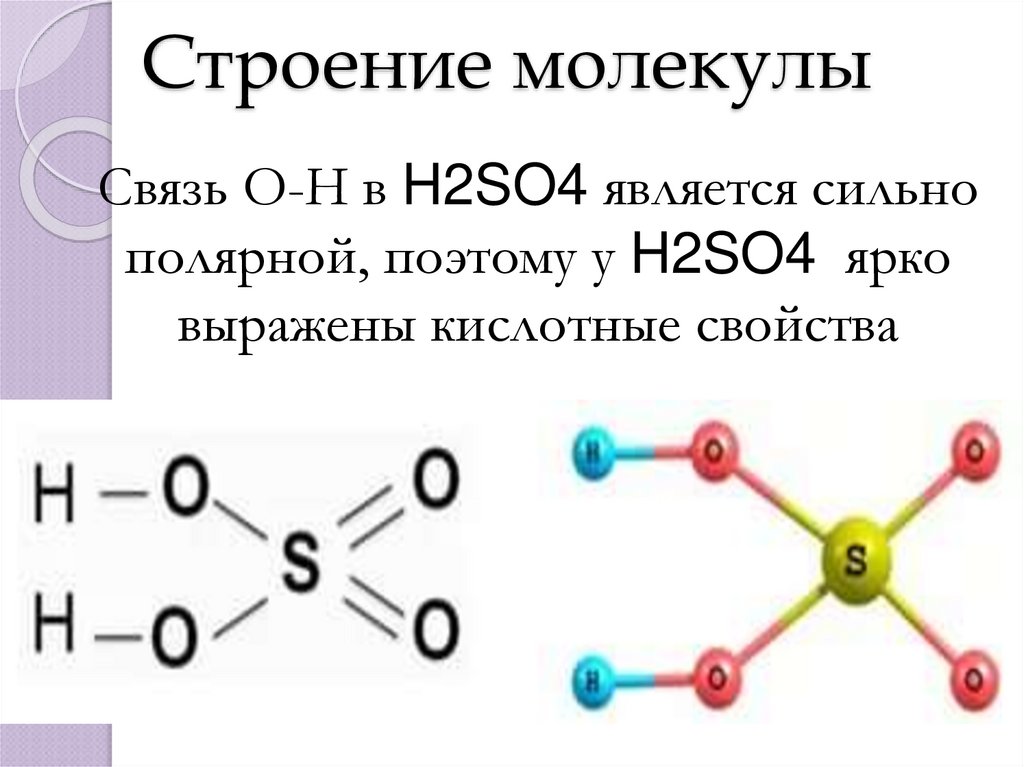
2. Строение молекулы
Связь О-Н в H2SO4 является сильнополярной, поэтому у H2SO4 ярко
выражены кислотные свойства
3. Физические свойства
Серная кислота тяжелая маслянистаяжидкость с плотностью
P = 1,84 г/см3.
Она нелетучая, хорошо
растворима в воде – с
сильным нагревом;
t°пл. = 10,3°C, t°кип. =
296°С.
Также очень
гигроскопична,
обладает
водоотнимающими
свойствами
4.
Химические свойстваH2SO4 - сильная двухосновная кислота
H2SO4 H+ + HSO4- 2H+ + SO42-
5.
разбавленнаяОтношение к неорганическим
веществам
1) диссоциация
Н2SО4→ Н++ HSO4HSO4-→ Н++ SO42-→
2) к индикаторам
Лакмус - красный
*метилоранж - бесцветный
3) к металлам
до Н
Zn + H2SO4→ ZnSO4 + Н2↑
после Н
Си + H2SO4≠
4) к основным и амфотерным оксидам
H2SO4 +MgO→ MgSO4 + H2O
5) к основаниям
H2SO4+ КОН →К2SO4+ H2O
6) к солям
К2СО3 + H2SO4 →К2SO4+ H2СO3
концентрированная
Отношение к органическим веществам
1)
2)
3)
4)
бумага+ H2SO4 → сжигает, образует
дыры
ткань + H2SO4 → обугливает
лучина + H2SO4 → обугливает
кожа + H2SO4 →ожоги, шрамы
специфические
1.с металлами
Си + 2H2SO4 → СиSO4 + SО2 ↑+2Н О
2.С водой
H2SO4 +nH2O → H2SO4 nH2O+Q
3.качественная реакция
H2SO4 +BaCl2→BaSO4 ↓+2HCl
белый
6.
Гигроскопичностьсерной кислоты
Концентрированная серная кислота набирает воду
и образовывает гидраты. Она разрушает
органические молекулы, отнимая водород и
кислород – составляющие воды. Разрушение
органических молекул сопровождается выделением
свободного углерода. Кислота ведет себя, как
обезвоживающий агент.
7.
Получение впромышленности
4FeS2 + 11O2 => 2Fe2O3 +
8SO2 + Q
2SO2 + O2 2SO3
nSO3 + H2SO4(конц)=>(H2SO4
• nSO3)
8.
Применение сернойкислоты
В производстве пластмассы
В производстве синтетического волокна
В средствах защиты растений
В моющих средствах
В лекарствах
9.
В красителях и пигментахВ производстве взрывчатых веществ
Электролит в аккумуляторах
В очистке нефтепродуктов
В получении солей и кислот
В металлургии
В минеральных удобрениях
10.
Соли серной кислотыCaSO4• 2H2O – гипс
CaSO4• 0,5H2O - алебастр
CuSO4• 5H2O – медный купорос
Na2SO4• 10H2O – мирабилит (глауберова
соль)
MgSO4• 7H2O – горькая соль
К2SO4• Al2(SO4)3 • 24H2O – алюмокалиевые
квасцы
11.
Важно знать!Серная кислота не сохраняется в
окружающей среде, быстро нейтрализуется.
Однако, высококонцентрированный раствор
серной кислоты опасен для человека: при
контакте с кожей вызывает сильные ожоги, а
при попадании в полость рта, горло,
желудок может вызвать летальный исход.
Контакт глаз с серной кислотой может
привести к слепоте.









 chemistry
chemistry








