Similar presentations:
Алотропні модифікації неметалів
1. Алотропні модифікації неметалів
2.
Алотропія - явище існування хімічного елемента увигляді двох або кількох простих речовин, різних за
властивостями і будовою.
Алотропними видозмінами (форми, модифікації)
хімічного елемента – це прості речовини утворені
одним і тим самим елементом.
3.
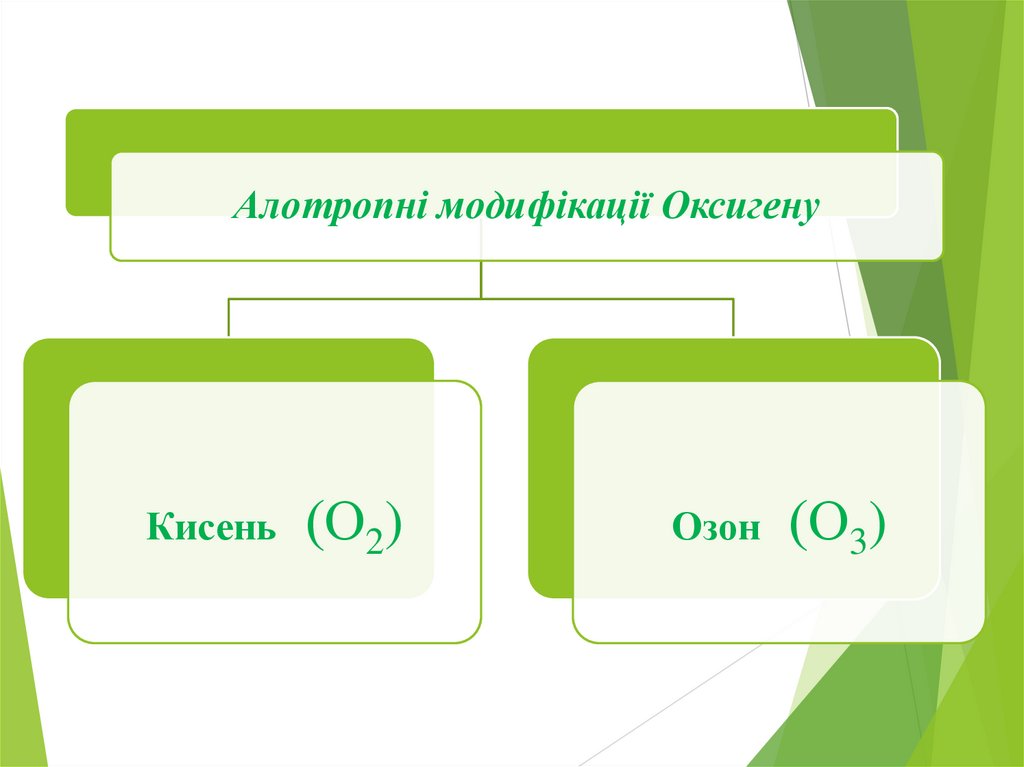
Алотропні модифікації ОксигенуКисень (О2)
Озон (О3)
4.
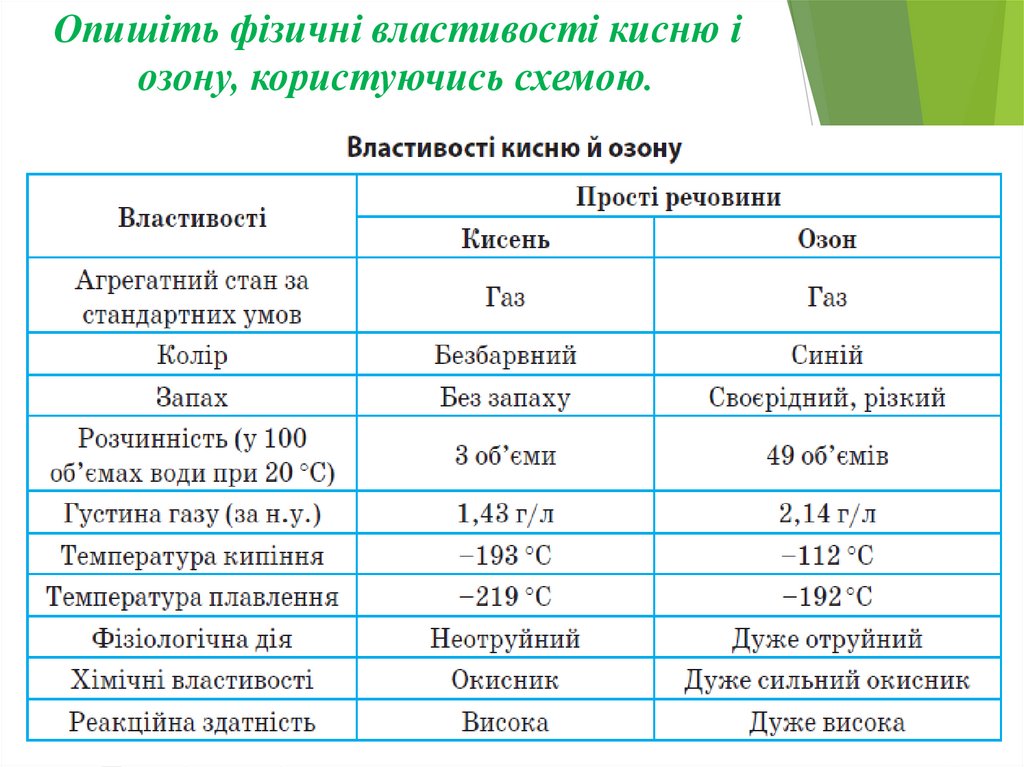
Опишіть фізичні властивості кисню іозону, користуючись схемою.
5.
Чим зумовлена алотропія у Оксигену?Алотропія у Оксигену зумовлена різною кількістю атомів, що
утворюють молекулу простої речовини.
6.
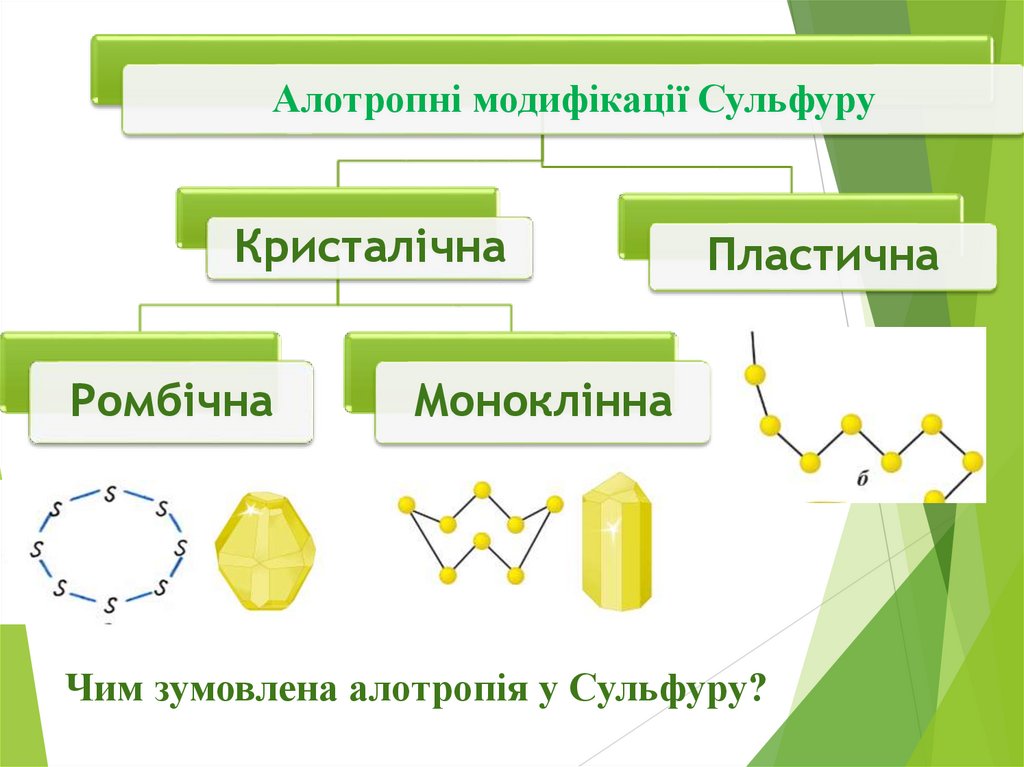
Алотропні модифікації СульфуруКристалічна
Ромбічна
Пластична
Моноклінна
Чим зумовлена алотропія у Сульфуру?
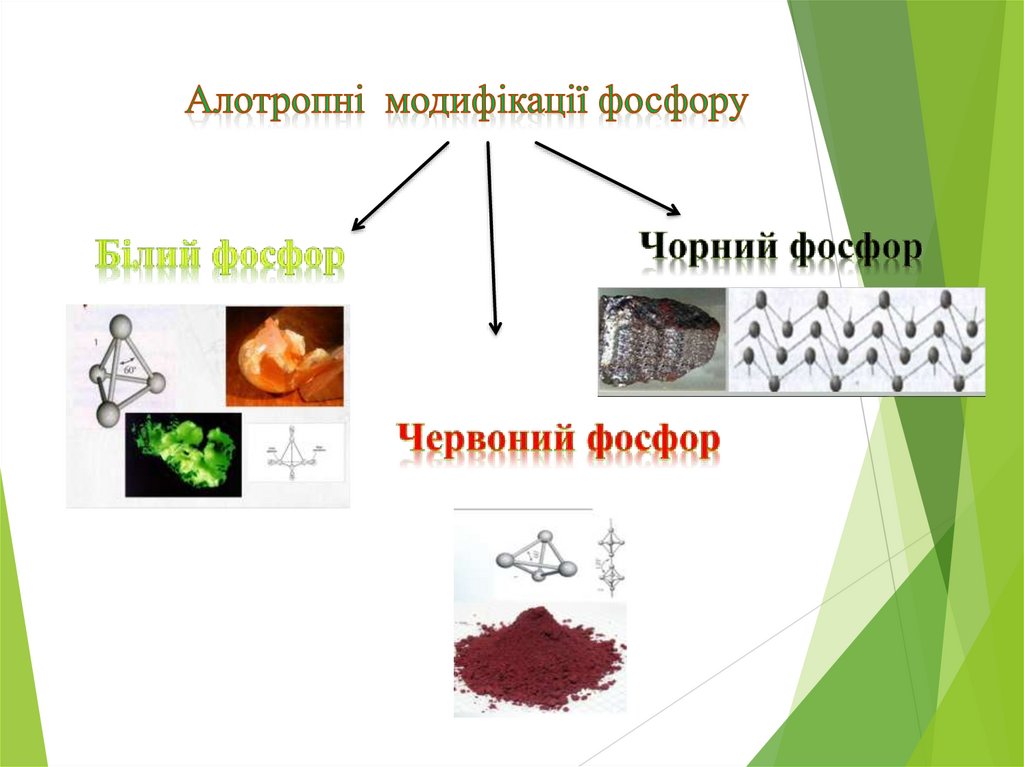
7. Фосфор.
8.
9. Фізичні властивості Фосфору
10.
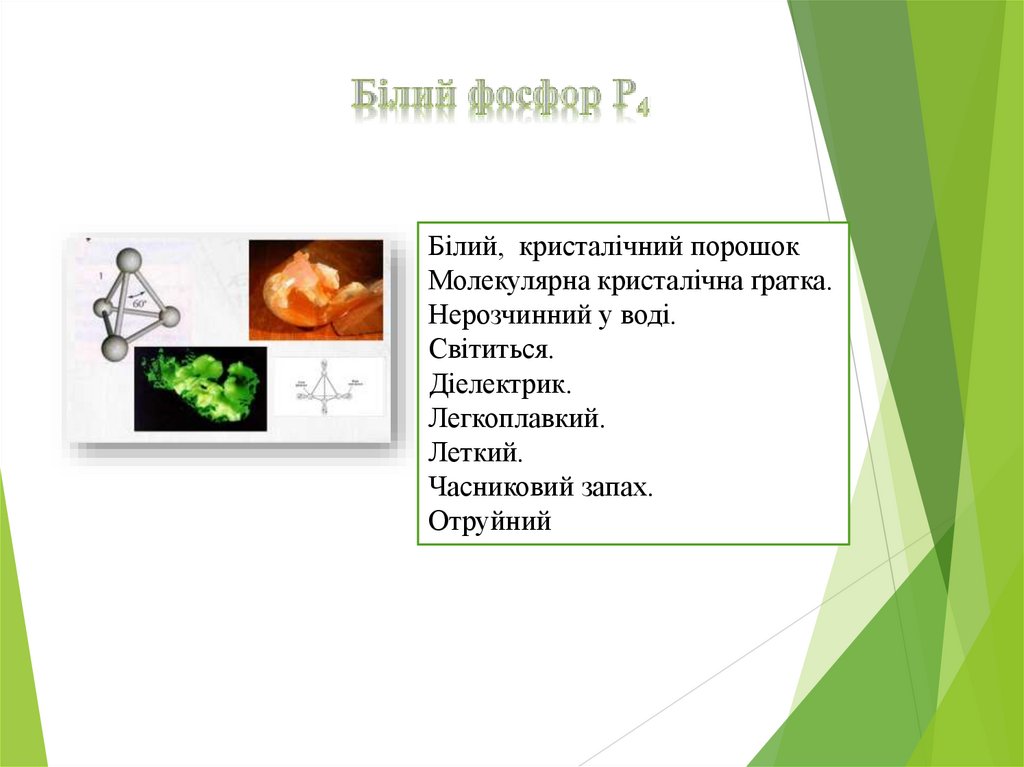
Білий, кристалічний порошокМолекулярна кристалічна ґратка.
Нерозчинний у воді.
Світиться.
Діелектрик.
Легкоплавкий.
Леткий.
Часниковий запах.
Отруйний
11.
Червоний порошокАтомна кристалічна гратка.
Нерозчинний у воді.
Не світиться.
Діелектрик.
Нелеткий.
Без запаху.
Не отруйний
12.
Чорний графітоподібний порошокАтомна кристалічна ґратка (шарувата, як у графіта).
Нерозчинний у воді.
Не світиться.
Напівпровідник.
Масний на дотик.
Нелеткий.
Без запаху.
Не отруйний
13.
Алотропні модифікації КарбонуАлмаз
Графіт
Карбін
Фулерен
14.
Алмаз має атомну кристалічну гратку. Коженатом Карбону сполучений з 4 іншими атомами
Карбону σ – зв’язками.
Безбарвні прозорі кристали, що сильно
заломлюють світло.
Виняткова твердість.
Тугоплавкий.
Погано проводить тепло і не проводить струм.
Не розчиняється у воді.
15. Застосування алмазу
Ювелірні вироби(заломлює світло)
Для різання скла,
шліфування, буріння
(дуже твердий)
16.
Графіт має атомну кристалічну гратку.Утворює пласкі шари: атоми Карбону
розміщуються шарами, відстань між якими
значно більша, ніж між атомами в одному шарі.
Електрони, що зв’язують шари, утворюють
єдину електронну хмару, як це відбувається в
металах.
Саме
цим
пояснюються
електропровідність графіту, його металічний
блиск.
М̕’яка темно-сіра речовина, непрозора.
З металічним блиском.
Маский на дотик.
Тугоплавкий (tпл = 3800ºС)
Добре проводить тепло і струм.
Не розчиняється у воді.
Легко розшаровується.
17. Застосування графіту
Грифелі для олівцівГрафітові тиглі
Електроди
Мастило для машин
Добавка до фарби
18.
Карбін складається з довгих ланцюгіватомів Карбону, сполучених між собою
подвійними або одинарними і потрійними
зв’язками. Чорний дрібнокристалічний
порошок.
Напівпровідник. Під дією світла його
електропровідність зростає, тому карбін
застосовують у фотоелементах.
За твердістю перевершує графіт, але
м’якший за алмаз
19.
Молекули фулерену мають форму сфери або еліпсоїда іпобудовані з п’яти- або шестикутників Карбону.
Атоми вуглецю в молекулі фулерену пов'язані σ- і πзв'язками
20. Застосування фулерену Нанотехнології У лазерних установках Напівпровідник Виробництво штучних алмазів
НанотехнологіїУ лазерних установках
Напівпровідник
Виробництво штучних алмазів
21. Домашнє завдання
Вивчити основні поняття з презентаціїПідготувати
порівняльну характеристику
алотропних модифікацій неметалів.
















 chemistry
chemistry








