Similar presentations:
Строение и функции белков
1.
СТРОЕНИЕ И ФУНКЦИИБЕЛКОВ
Выполнила Жалкова Н. 11
“Б”
2.
СТРОЕНИЕ БЕЛКОВ✕
Белки — высокомолекулярные органические
соединения, состоящие из остатков αаминокислот.
✕
В состав белков входят углерод, водород,
азот, кислород, сера. Часть белков образует
комплексы с другими молекулами,
содержащими фосфор, железо, цинк и медь.
3.
АМИНОКИСЛОТНЫЙ СОСТАВБЕЛКОВ
✕
В зависимости от того, могут ли аминокислоты
синтезироваться в организме человека и
других животных, различают: заменимые
аминокислоты — могут синтезироваться;
незаменимые аминокислоты — не могут
синтезироваться. Незаменимые аминокислоты
должны поступать в организм вместе с пищей.
Растения синтезируют все виды аминокислот.
4.
АМИНОКИСЛОТНЫЙ СОСТАВБЕЛКОВ
✕
✕
✕
✕
В зависимости от аминокислотного состава,
белки бывают:
полноценными — содержат весь набор
аминокислот;
неполноценными — какие-то аминокислоты
в их составе отсутствуют.
Если белки состоят только из аминокислот, их
называют простыми. Если белки содержат
помимо аминокислот еще и
неаминокислотный компонент их называют
сложными.
5.
АМИНОКИСЛОТНЫЙ СОСТАВБЕЛКОВ
✕
Все аминокислоты содержат: 1) карбоксильную
группу (–СООН), 2) аминогруппу (–NH2), 3) радикал
(остальная часть молекулы). В зависимости от
количества аминогрупп и карбоксильных групп,
входящих в состав аминокислот, различают:
нейтральные аминокислоты, имеющие одну
карбоксильную группу и одну аминогруппу; основные
аминокислоты, имеющие более одной аминогруппы;
кислые аминокислоты, имеющие более одной
карбоксильной группы.
аминогруппа
карбоксильна
я группа
6.
ПРОСТРАНСТВЕННАЯОРГАНИЗАЦИЯ БЕЛКОВЫХ
МОЛЕКУЛ
✕
Выполнение белками определенных
специфических функций зависит от
пространственной конфигурации их молекул.
✕
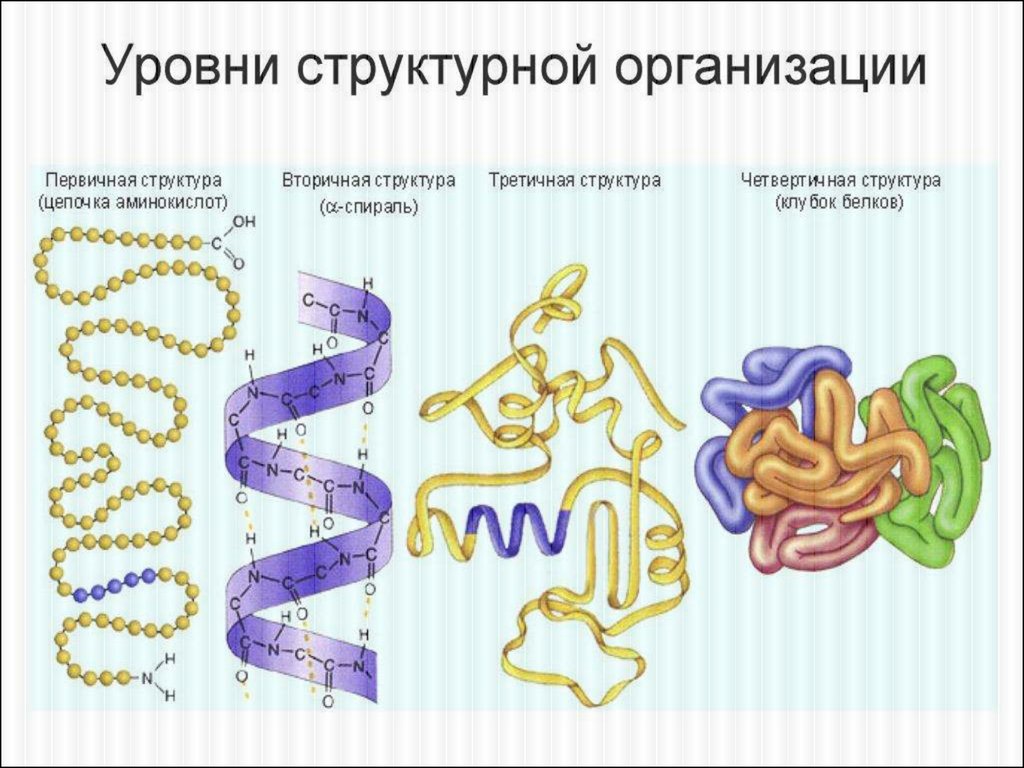
Выделяют 4 уровня пространственной
организации белков: первичный,
вторичный, третичный и четвертичный.
7.
8.
ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА✕
Это последовательность расположения
аминокислотных остатков в полипептидной цепи,
составляющей молекулу белка. Связь между
аминокислотами — пептидная.
9.
ВТОРИЧНАЯ СТРУКТУРА✕
Это упорядоченное свертывание полипептидной цепи в
спираль (имеет вид растянутой пружины). Витки спирали
укрепляются водородными связями, возникающими между
карбоксильными группами и аминогруппами.
10.
ТРЕТИЧНАЯ СТРУКТУРА✕ Это укладка полипептидных цепей в глобулы,
возникающая в результате возникновения химических
связей и установления гидрофобных взаимодействий
между радикалами аминокислотных остатков.
✕ На уровне третичной структуры существуют ферменты,
антитела, некоторые гормоны.
11.
ЧЕТВЕРТИЧНАЯ СТРУКТУРА✕
✕
Она характерна для сложных белков, молекулы которых
образованы двумя и более глобулами. Субъединицы
удерживаются в молекуле благодаря ионным,
гидрофобным и электростатическим взаимодействиям.
Иногда при образовании четвертичной структуры между
субъединицами возникают дисульфидные связи.
Наиболее изученным белком, имеющим четвертичную
структуру, является гемоглобин. Он образован двумя
α-субъединицами (141 аминокислотный остаток)
и двумя β-субъединицами (146 аминокислотных
остатков).
12.
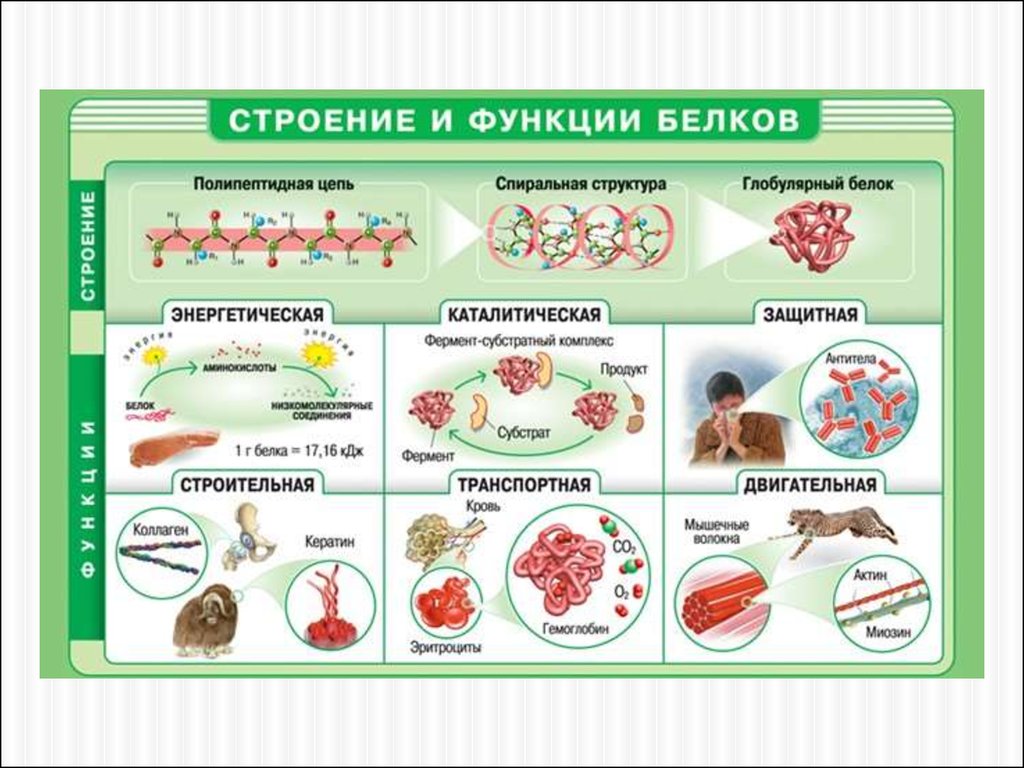
ФУНКЦИИ БЕЛКОВФункция
Примеры и пояснения
Строительная
Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран
(липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д.
Транспортная
Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них
в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают
активный перенос некоторых веществ из клетки во внешнюю среду и обратно.
Регуляторная
Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин
регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов.
Защитная
В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые
белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует
остановке кровотечений.
Двигательная
Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных.
Сигнальная
В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в
ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и
передачу команд в клетку.
Запасающая
В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря
белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо
не выводится из организма, а сохраняется, образуя комплекс с белком ферритином.
При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а
Энергетическая затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки
используются только тогда, когда другие источники (углеводы и жиры) израсходованы.
Одна из важнейших функций белков. Обеспечивается белками — ферментами, которые ускоряют биохимические
Каталитическая реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО 2 при
фотосинтезе.












 biology
biology chemistry
chemistry








