Similar presentations:
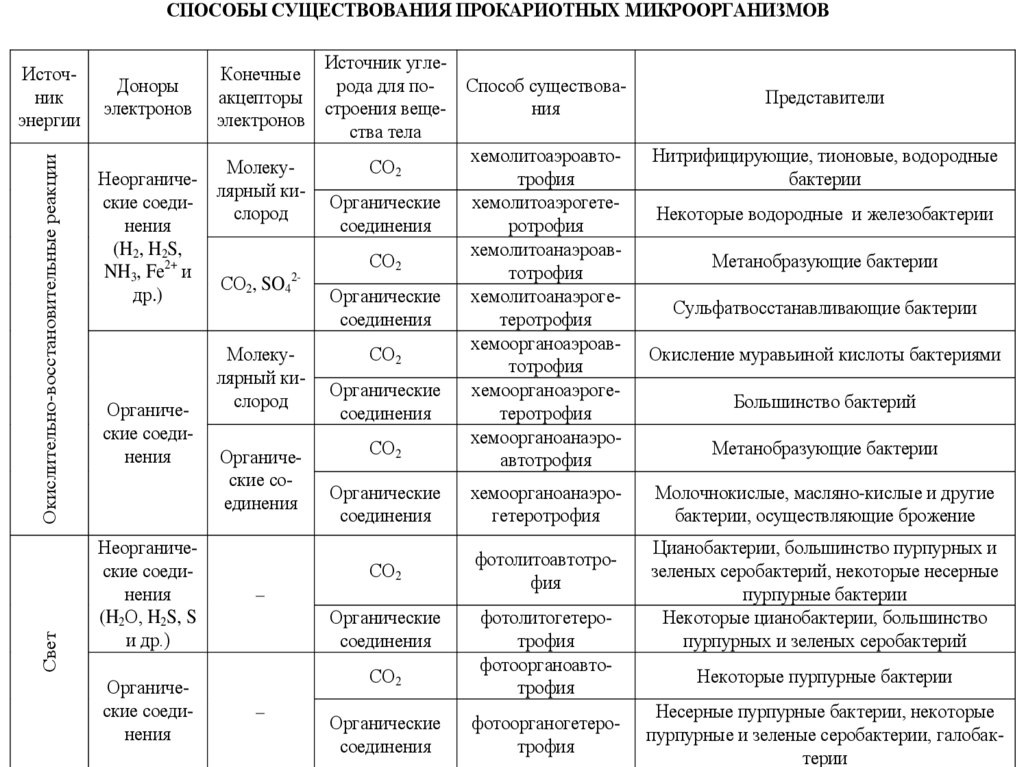
Способы существования прокариотных микроорганизмов
1.
СПОСОБЫ СУЩЕСТВОВАНИЯ ПРОКАРИОТНЫХ МИКРООРГАНИЗМОВСвет
Окислительно-восстановительные реакции
Источник
энергии
Источник углеКонечные
Доноры
рода для поСпособ существоваакцепторы
электронов
строения вещения
электронов
ства тела
хемолитоаэроавтоМолекуСО2
трофия
Неорганичелярный киские соедиОрганические
хемолитоаэрогетеслород
нения
соединения
ротрофия
(H2, H2S,
хемолитоанаэроавСО2
2+
NH3, Fe и
тотрофия
СО2, SO42др.)
Органические хемолитоанаэрогесоединения
теротрофия
хемоорганоаэроавМолекуСО2
тотрофия
лярный киОрганические
хемоорганоаэрогеслород
Органичесоединения
теротрофия
ские соедихемоорганоанаэроСО
2
нения
Органичеавтотрофия
ские соОрганические хемоорганоанаэроединения
соединения
гетеротрофия
Неорганические соединения
(H2О, H2S, S
и др.)
Органические соединения
СО2
Органические
соединения
СО2
Органические
соединения
фотолитоавтотрофия
фотолитогетеротрофия
фотоорганоавтотрофия
фотоорганогетеротрофия
Представители
Нитрифицирующие, тионовые, водородные
бактерии
Некоторые водородные и железобактерии
Метанобразующие бактерии
Сульфатвосстанавливающие бактерии
Окисление муравьиной кислоты бактериями
Большинство бактерий
Метанобразующие бактерии
Молочнокислые, масляно-кислые и другие
бактерии, осуществляющие брожение
Цианобактерии, большинство пурпурных и
зеленых серобактерий, некоторые несерные
пурпурные бактерии
Некоторые цианобактерии, большинство
пурпурных и зеленых серобактерий
Некоторые пурпурные бактерии
Несерные пурпурные бактерии, некоторые
пурпурные и зеленые серобактерии, галобактерии
2. ФЕРМЕНТЫ МИКРООРГАНИЗМОВ
3.
ОКСИДОРЕДУКТАЗЫ:Дегидрогеназы
Хиноны
Цитохромы (а-, а3-, в-, с-, о-цитохромы,
цитохромоксидаза)
Железо-серные белки (Fe-S)
Каталаза
Пероксидаза
ТРАНСФЕРАЗЫ:
Транскетолазы, трансальдолазы
Трансаминазы
4.
–Дегидрогеназы (никотинамидадениндинуклеотид (НАД),
НАД фосфат, флавинадениндинуклеотид (ФАД),
флавинмононуклеотид) наиболее обширная группа
дыхательных ферментов в клетках аэробных и
анаэробных бактерий.
Катализируют реакции отрыва водорода от
молекулы субстрата (окисление) и перенос его на
другое вещество (восстановление). В качестве
активных группировок эти ферменты содержат
пиридиновые (НАД, НАДФ) и флавиновые (ФАД,
ФМН) производные.
Н2 переносят не на кислород, а на другие
ферменты или переносчики
Анаэробные дегидрогеназы, содержащие НАД:
Дегидрогеназы, содержащие ФАД:
Н2 переносят от субстратов или пиридиновых
дегидрогеназ к цитохромам или на молекулярный
кислород (аэробные дегидрогеназы)
5.
– Хиноны (у Гр- убихинон (кофермент Q),у Гр+ нафтохиноны) дыхательные
ферменты, локализующиеся в липидной
фазе мембран. По сравнению с другими
компонентами дыхательной цепи хиноны
содержатся в 10-15 кратном избытке.
Функционируют в дыхательной цепи,
находясь между флавопротеидами и
цитохромами. Переносят водород или
электроны. Служат сборщиком
водорода от различных коферментов
и простетических групп в дыхательной
цепи и передают его цитохромам.
6.
–Цитохромы (а-, а3-, в-, с-, о-цитохромы, цитохромоксидаза)
окислительно-восстановительные феремнты-переносчики
водорода на молекулярный кислород, основные компоненты
дыхательной цепи (цепь переноса электронов), возбуждаются
светом, различно окрашены. У анаэробных фотосинтезирующих
бактерий участвуют в процессах переноса электронов.
У р. Desulfovibrio с помощью цитохрома С3 в анаэробных
условиях осуществляется сульфатное дыхание при
восстановлении сульфата осуществляется окислительное
фосфорилирование.
Молочнокислые Str. lactis, Leuconostoc и анаэробы Bifido
синтезируют цитохромы на средах, содержащих гемин
или кровь.
У строгого анаэроба Vibrio succinogenes также
обнаружены цитохромы (фосфорилирование сопряжено с
транспортом электронов).
Цитохромы содержат атомы железа (гем) и обеспечивают
протекание окислительно-восстановительных реакций в
результате перехода Fe 2+ в Fe 3+, то есть являются
переносчиками электронов от цитохрома к кислороду.
Могут переносить электроны и на другие акцепторы.
7.
–Железо-серные белки (Fe-S) участвуют в транспорте электронов
в мембране, фиксируют молекулярный азот, восстанавливают
сульфит и нитрит, участвуют в процессе фотосинтеза (в
хлоропластах у анаэробных бактерий). Железо-серные белки
имеют низкую молекулярную массу, сильно отрицательный.
У Clostridia, Chromatium [4Fe+4S]. У Azotobacter по два
[4Fe+4S].
Железо-серные белки окислительно-восстановительные
системы, переносящие электроны. Они содержат атомы
железа, связанные с одной стороны с серой цистеина, а с
другой с неорганической сульфидной серой. Последняя
легко отщепляется при подкислении в виде H2S. Остатки
цистеина входят в состав полипептидных цепей. Fe-S в
центре можно рассматривать как простетическую группу
полипептида. Участвующие в дыхательной цепи [2Fe+2S]центры способны переносить только один электрон. Из
общего количества находящихся в плазматической
мембране железа 80% содержится в Fe-S-белках и только
20% в цитохромах.
8.
– Каталаза (Гр- Sporolactobacillus, Гр+Bacillus) обеспечивает расщепление Н2О2
(образуется при переносе водорода
непосредственно на кислород) до воды и
кислорода.
– Пероксидаза обеспечивает расщепление
Н2О2 до воды и кислорода, а также
способствует окислению перекисью
водорода органических соединений клетки.
9.
• . Транскетолазы, трансальдолазыкатализируют взаимопревращение сахаров,
имеющих в своем составе разное количество
атомов углерода за счет переноса от одного
сахара к другому углеродсодержащих остатков в
виде кетонных и альдегидных группировок.
• Уридинфосфат (УТФ) фосфорилированный
рибонуклеотид (сходны по структуре с АТФ, но в
клетках содержатся в меньших количествах).
• АТФ главный переносчик фосфатных групп, а
УТФ и УДФ служат теми каналами, через которые
энергия АТФ направляется на биосинтез клеточных
компонентов.
• В реакциях гликолиза взаимопревращение сахаров
происходит за счет их
нуклеозиддифосфопроизводных: глюкозо-фосфат
+ УДФ → УДФ-глюкоза → различные сахара.
10.
• Трансаминазы• КоА был идентифицирован как
переносчик ацильного радикала
СН3СО-
11.
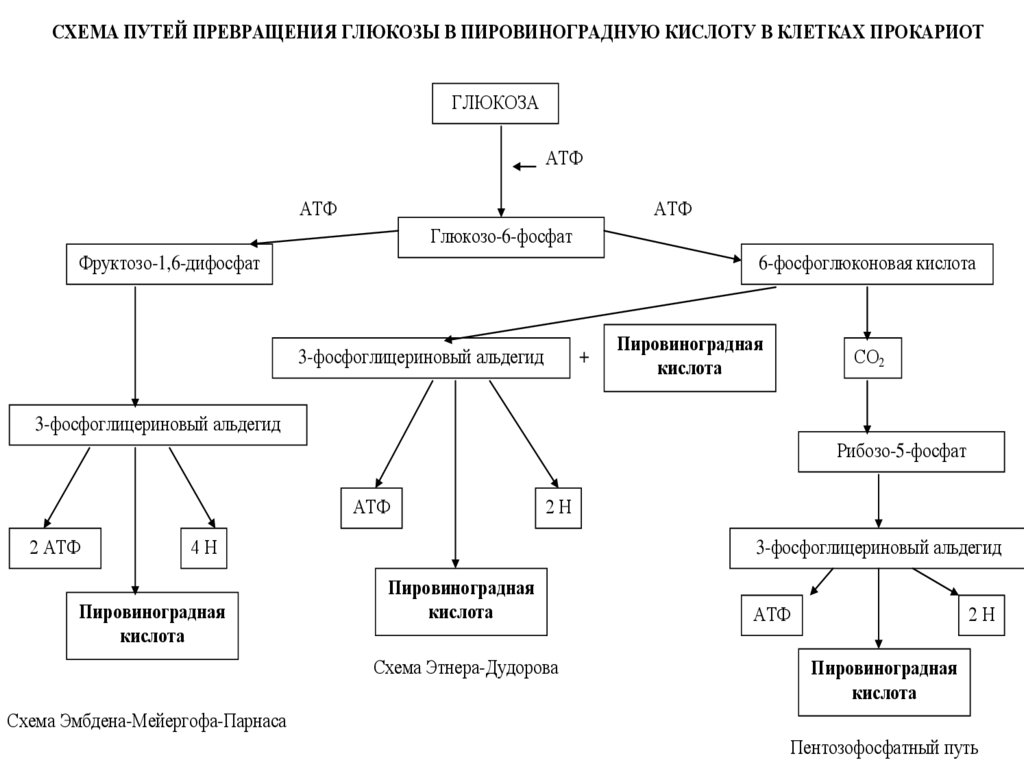
СХЕМА ПУТЕЙ ПРЕВРАЩЕНИЯ ГЛЮКОЗЫ В ПИРОВИНОГРАДНУЮ КИСЛОТУ В КЛЕТКАХ ПРОКАРИОТГЛЮКОЗА
АТФ
АТФ
АТФ
Глюкозо-6-фосфат
Фруктозо-1,6-дифосфат
6-фосфоглюконовая кислота
3-фосфоглицериновый альдегид
+
Пировиноградная
кислота
СО2
3-фосфоглицериновый альдегид
Рибозо-5-фосфат
АТФ
2 АТФ
2Н
4Н
Пировиноградная
кислота
3-фосфоглицериновый альдегид
Пировиноградная
кислота
Схема Этнера-Дудорова
АТФ
2Н
Пировиноградная
кислота
Схема Эмбдена-Мейергофа-Парнаса
Пентозофосфатный путь
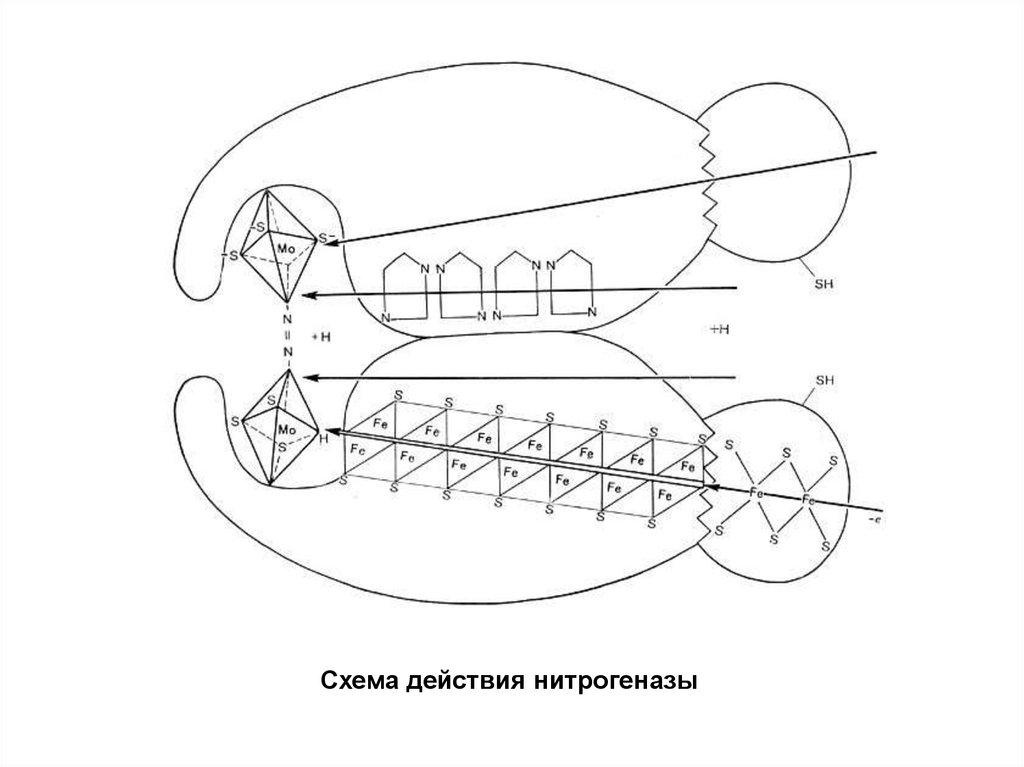
12. НИТРОГЕНАЗА
13.
• Фиксация молекулярного азота, до сих поробнаруженная только у прокариот,
осуществляется с помощью ферментной
системы - нитрогеназы, состоящей из двух
компонентов: малого, содержащего железо и
серу (Fe-белок), и большого, в состав
которого дополнительно входит молибден (
MoFe-белок ). Соотношение между ними у
разных азотфиксирующих прокариот
колеблется от 1:1 до 2:1, хотя в целом
нитрогеназы из разных источников
обнаруживают значительное сходство.
14.
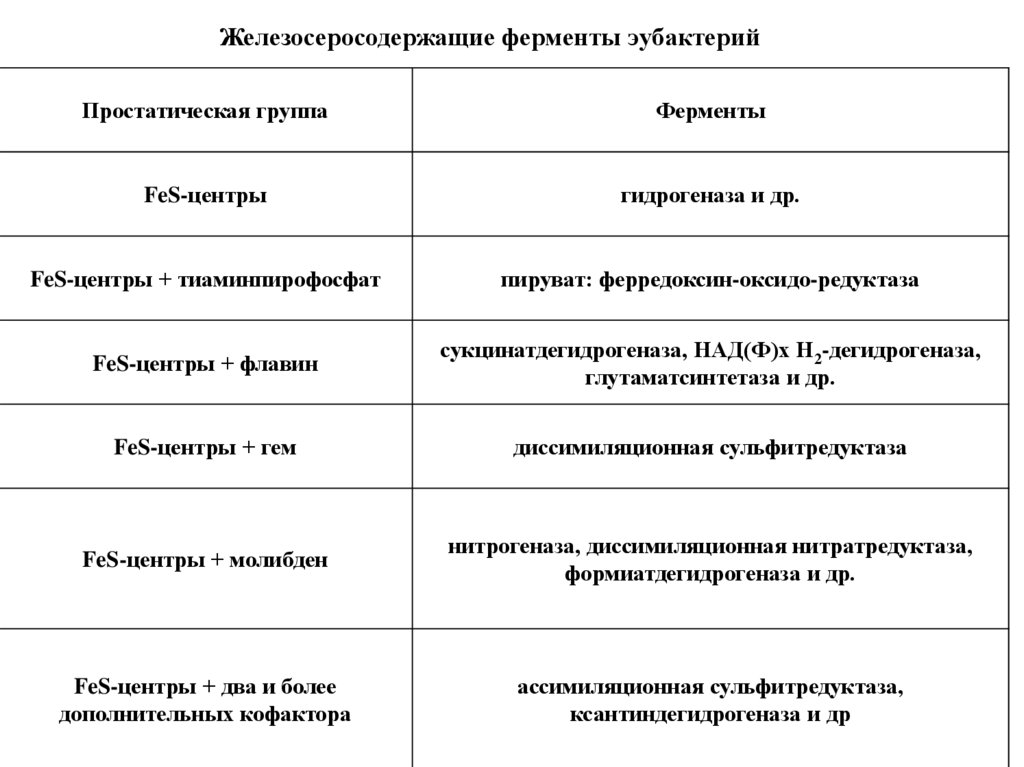
Железосеросодержащие ферменты эубактерийПростатическая группа
Ферменты
FeS-центры
гидрогеназа и др.
FeS-центры + тиаминпирофосфат
пируват: ферредоксин-оксидо-редуктаза
FeS-центры + флавин
сукцинатдегидрогеназа, НАД(Ф)х Н2-дегидрогеназа,
глутаматсинтетаза и др.
FeS-центры + гем
диссимиляционная сульфитредуктаза
FeS-центры + молибден
нитрогеназа, диссимиляционная нитратредуктаза,
формиатдегидрогеназа и др.
FeS-центры + два и более
дополнительных кофактора
ассимиляционная сульфитредуктаза,
ксантиндегидрогеназа и др
15. Гидрогеназы бактерий
• Гидрогеназы - одна из групп FeS-содержащихферментов , катализирующих реакции поглощения и
выделения молекулярного водорода, обнаружены у
разных групп эубактерий : облигатных анаэробов и
аэробов, факультативных форм, у хемотрофных и
фототрофных организмов. Различаются строением
молекулы, природой доноров и акцепторов
электронов, с которыми взаимодействуют,
локализацией в клетке, выполняемыми функциями.
Но все гидрогеназы катализируют реакцию (Н2
переходит обратимо в 2Н+ + 2е).
16.
• Гидрогеназа Сlostridium pasteurianum , один изнаиболее детально изученных ферментов, - белок с
молекулярной массой примерно 60000 Да,
представленный одной субъединицей. В молекуле
содержатся три FeS-центра типа Fe4S4. Донором
(акцептором) электронов клостридиальной
гидрогеназы служит ферредоксин .
• При разрушении клеток Сlostridium pasteurianum
гидрогеназная активность проявляется только в
растворимой фракции: в периплазматическом
пространстве и цитоплазме . Гидрогеназа,
локализованная в периплазматическом
пространстве, катализирует необратимую реакцию
поглощения Н2. Находящаяся в цитоплазме
гидрогеназа способна катализировать реакции как
поглощения, так и выделения Н2 У клостридиев она
входит в состав ферментного комплекса,
осуществляющего окислительное
декарбоксилирование пирувата
17.
• Основная функция гидрогеназ клостридиев (идругих облигатных анаэробов) заключается в
избавлении от избытка образующихся в
катаболических реакциях восстановительных
эквивалентов (электронов), которые
переносятся на Н+ и удаляются из клетки в
виде молекулярного водорода.
• Гидрогеназы других эубактерий могут иметь
более сложное строение: состоять из
нескольких неидентичных субъединиц,
содержать помимо FeS- центров флавины в
качестве простетических групп. Помимо
ферредоксинов гидрогеназы разных
организмов могут взаимодействовать с
довольно широким набором переносчиков
электронов: цитохромами с, НАД(Ф),
хинонами и др.
18.
• Процесс азотфиксации очень чувствителен к О2. Несмотряна это, способность фиксировать N2 широко
распространена среди прокариот, различающихся
отношением к молекулярному кислороду; она присуща
хемотрофам и фототрофам , в том числе цианобактериям ,
осуществляющим кислородный фотосинтез. Фиксировать
N2 могут свободноживущие формы и прокариоты,
находящиеся в симбиозе с эукариотными организмами.
• К числу аэробных азотфиксаторов относятся представители
рода Azotobacter , у которых обнаружены различные
защитные приспособления. Одно из них связано с резким
увеличением дыхательной активности клеток,
осуществляющих азотфиксацию в аэробных условиях.
Дыхание в значительной мере служит в этом случае для
"связывания" внутриклеточного О2. При этом обнаружены
существенные перестройки, выражающиеся как в
интенсивном развитии системы внутрицитоплазматических
мембран , так и в организации самой дыхательной цепи,
локализованной в этих мембранах. Таким образом,
происходит "сжигание" части углеродных субстратов,
которые используются для восстановления О2, без
запасания при этом клеткой энергии.
19.
• В дополнение к вынужденному "принесению вжертву" части источников углерода высокие
концентрации О2 вызывают в клетке
обратимые изменения структуры
нитрогеназы, делающие чувствительные к
молекулярному кислороду участки менее
доступными для него. Возможно, при этом
происходит изменение взаимного
расположения двух нитрогеназных белков.
• Обнаружены специальные защитные белки,
образующие комплексы с нитрогеназными
белками и приводящие к повышению их
стабильности в присутствии О2. Никаких
других функций, кроме защитной, у этих
белков пока не найдено.
20.
Большинство азотфиксирующих прокариот способны
фиксировать молекулярный азот в микроаэробных условиях. К
числу защитных приспособлений у них относятся:
- образование слизи, препятствующей диффузии в клетку О2 и
тем самым создающей вокруг нее микроаэробную зону;
- формирование клеточных скоплений, затрудняющих доступ О2 к
клеткам, расположенным внутри скопления, которым, таким
образом, создаются более благоприятные условия для
азотфиксации;
- существование азотфиксирующих видов в ассоциации с
неазотфиксирующими аэробными гетеротрофами, защищающими
нитрогеназу азотфиксаторов от доступа О2.
Специфические приспособления для защиты нитрогеназы oт
высоких концентраций О2 выработаны симбиотическими
азотфиксаторами - клубеньковыми бактериями. Уже сами
клубеньки, место активного размножения бактерий и фиксации
ими N2, следует рассматривать как структуру, одним из
назначений которой является ограничение доступа внутрь
молекулярного кислорода. Эту же функцию выполняет
содержащийся в клубеньках леггемоглобин (белок, аналогичный
гемоглобину), способный активно связывать О2 и контролировать
его поступление в бактероиды. В любом случае при
осуществлении метаболизма аэробного типа дыхание также будет
препятствовать накоплению в клетке молекулярного кислорода.
21.
• У безгетероцистных цианобактерий защитанитрогеназы вегетативных клеток от О2, в
первую очередь эндогенного, осуществляется
с помощью разделения во времени
процессов фотосинтеза и азотфиксации,
непрерывного синтеза нитрогеназы, высокой
активности супероксиддисмутазы в сочетании
с каталазной и пероксидазной активностями.
• Средством защиты от экзогенного О2 служит
синтез большого количества слизи, часто
окружающей клетки азотфиксирующих
цианобактерий. Существование в виде
колониальных форм также может
обеспечивать создание анаэробных условий
для клеток, располагающихся в центральной
части колонии.
22.
• Наиболее совершенна защита от эндогенногои экзогенного молекулярного кислорода в
гетероцистах. Гетероцисты не способны к
фотосинтетическому выделению О2. А
высокие активности окислительного
пентозофосфатного пути , поставляющего
электроны в дыхательную цепь, где они
акцептируются О2, повышенные уровни
супероксиддисмутазы сравнительно с
вегетативными клетками, образование
гетероцистами молекулярного водорода,
толстая многослойная оболочка,
выполняющая функцию газового барьера, все это надежно защищает
азотфиксирующую систему в гетероцистах от
инактивации молекулярным кислородом.
23.
Схема действия нитрогеназы24.
25.
• Молекулярный азот через щель размером 4—5 А (этосоответствует длине молекулы азота) поступает внутрь
фермента и здесь активируется. В его активации
большая роль принадлежит молибдено- и
железосодержащим центрам, по цепям атомов которых
происходит эстафетная передача активирующих азот
электронов от восстановителя. Реакции активации
способствует близость группировок серы.
• В результате активации и хемосорбции азота
нитрогеназой высвобождается энергия и происходит
разрыв двух связей в молекуле азота. На это расходуется
7,8*105 дж/моль. Третья связь разрывается при
внедрении в молекулу активированного азота: водорода,
активированного, в свою очередь, ферментами
дегидрогеназной и гидрогеназной систем. Получающийся
аммиак или другие восстановленные продукты азота
реагируют с кетокислотами, образуя аминокислоты.





















 biology
biology








