Similar presentations:
Ионо-дисперсное состояние микрокомпонентов в растворах
1. НЕДОБУХ ТАТЬЯНА АЛЕКСЕЕВНА Доцент кафедры радиохимии и прикладной экологии ФтИ
Основы ядерной физики,радиохимии и дозиметрии
Лекция 2
ИОНО-ДИСПЕРСНОЕ СОСТОЯНИЕ
МИКРОКОМПОНЕНТОВ В РАСТВОРАХ
НЕДОБУХ ТАТЬЯНА АЛЕКСЕЕВНА
Доцент кафедры радиохимии и прикладной экологии ФтИ
2. Содержание лекции
Состояние микрокомпонентов в водных растворах.Ионо-дисперсные формы. Комплексные соединения.
Устойчивость комплексных соединений.
Образование гидроксосоединений. Гидролиз, протолиз.
Моноядерный и полиядерный гидролиз. Образование
полиядерных гидроксокомплексов. Оляция, оксоляция,
замещение анионами.
3. Состояние микрокомпонентов в водных растворах
Под термином "состояние" в радиохимии подразумеваетсясовокупность всех форм, образованных радионуклидом в
водном растворе:
простые акваионы - M(H2O)Nz+ ;
ионные пары или внешнесферные комплексы;
комплексные ионы, образованные центральным ионом (Мz+) и
лигандами (Ln-), причем лиганды могут быть одинаковой или
различной химической природы - {M(H2O)N-iLi}z-ni;
моноядерные продукты гидролиза {M(H2O)N-i(OH)i}z-i;
полиядерные гидроксокомплексы - {Mj(H2O)j(N-i)(OH)i}jz-i;
гетерополиядерные гидроксокомплексы;
истинные радиоколлоиды;
псевдорадиоколлоиды.
4. Ионо-дисперсные формы
К ионо-дисперсным формам относятся простые акваионы,моноядерные, полиядерные и гетрополиядерные комплексы.
Описание ионо-дисперсных форм обычно осуществляют с
позиций образования комплексных соединений.
Комплексные или координационные соединения - это частицы
(нейтральные молекулы или ионы), которые образуются в
результате присоединения к данному иону (или атому),
называемому ''комплексообразователем'' (центральным
атомом), нейтральных молекул или других ионов,
называемых лигандами: MLn,
где n - число лигандов в комплексе, равное координационному
числу, если лиганды образуют с центральным ионом только
одну связь. Координационное число зависит от природы
лиганда.
5. Равновесие реакций комплексообразования
В общем случае образование комплексного соединенияможно выразить следующим уравнением:
mM nL M m Ln
Термодинамическая константа комплексообразования:
aM m Ln
f M m Ln
[ M m Ln ]
t m n
m n
m
n
aM a L [ M ] [ L ] f M f L
( p, T const )
aM = f[M] – активность, f – коэффициент активности, [] – символ
концентрации.
Концентрационная константа комплексообразования:
M
m Ln
[ M m Ln ]
[ M ]m [ L]n
( p, T , J const ).
Если в структуре комплекса существует только один
центральный атом, то он называется моноядерным,
если m ≠ 1, то полиядерным.
6. Константы комплексообразования
Константы образования: ступенчатые Ki; общие iM L ML
ML1 L ML2
[ ML ]
K1
[ M ] [ L]
[ ML2 ]
K2
[ ML ] [ L]
.........................
MLN 1 L MLN K N
[ MLN ]
[ MLN 1 ] [ L]
1 K1
2 K1 K 2
..............
N
N K1 K 2 K N K i
i 1
Константы нестойкости: ступенчатые k; общие K N
'
ML M L
[ M ][ L] 1
k
[ ML]
K
K k1k2 k N
'
N
1
N
7. Связь между константами и аналитически измеряемыми величинами
Общая концентрация металла в растворе:N
CM [ M ] [ ML] [ ML2 ] [ MLN ] [ MLi ]
i 0
CM [ M ] 1[ M ][ L] 2 [ M ][ L]2 N [ M ][ L]N
N
Введя 0 1, [ M ] 0 [ M ][ L] , получаем CM [ M ] i [ L]i ,
i 0
N – максимальное число лигандов в комплексе.
Общая концентрация лиганда в растворе:
0
N
CL [ L] [ ML ] 2[ ML2 ] N [ MLN ] [ L] i[ MLi ]
i 1
N
CL [ L] 1[ M ][ L] 2 2 [ M ][ L] N N [ M ][ L] [ L] i i [ L]i .
2
N
i 1
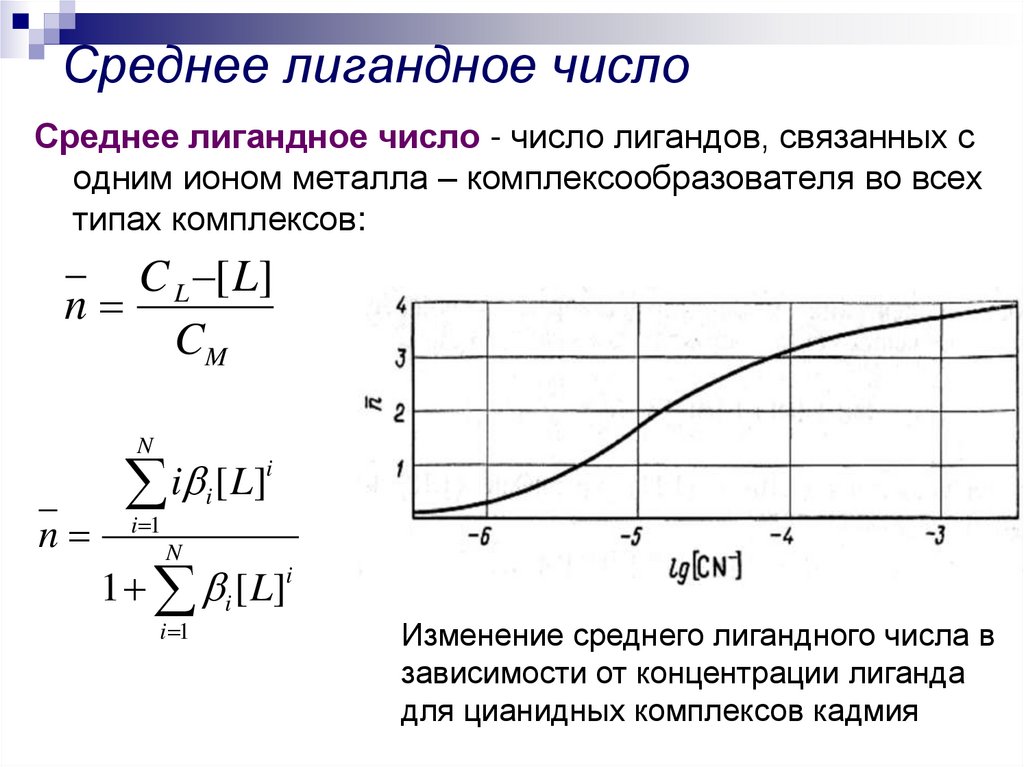
8. Среднее лигандное число
Среднее лигандное число - число лигандов, связанных содним ионом металла – комплексообразователя во всех
типах комплексов:
C L [ L]
n
CM
N
n
i
i
[
L
]
i
i 1
N
1 i [ L]i
i 1
Изменение среднего лигандного числа в
зависимости от концентрации лиганда
для цианидных комплексов кадмия
9. Мольная доля i - комплекса в растворе
[ MLi ]i [ M ][ L]i
i [ L]i
i
N
, 0
CM
[ M ] 1[ M ][ L] 2 [ M ][ L]2 N [ M ][ L]N
i [ L]i
i 0
N
i 1
i 0
1
N
[ L]
i
i 0
i
αi зависят только от концентрации лиганда и не зависят от
концентрации металла в растворе для моноядерных
комплексов
Доля аммиачных комплексов цинка, как функция концентрации свободного
аммиака
10. Комплексы с несколькими видами лигандов
ji[ ML ji ]
CM
ji
ji [ L j ]i
,
2
N
2
N
1 11[ L1 ] 12[ L1 ] 1N [ L1 ] 21[ L 2 ] 22[ L2 ] 2 N [ L2 ]
ji [ L j ]
K
Nj
1 ji [ L j ]i
,
j 1 i 1
К – число различных видов лигандов,
участвующих в комплексообразовании
Состояние урана (VI) в морской
воде в зависимости от рН:
1 – UO2F+; 2 – UO2SO4; 3 – UO22+;
4 – UO2Cl+; 5 – UO2(SO4)22-; 6 – UO2F3-;
7 – UO2OH+; 8 – UO2(OH)2; 9 – UO2(CO3)22-;
10 – UO2(CO)34-
11. Внешнесферные и внутрисферные комплексы
Внутрисферные комплексы образуются в результатепроявления сил близкодействия, что приводит к
молекулярному
контакту
между
иономкомплексообразователем
и
лигандами.
Возможность
образования внутрисферного комплекса определяется
напряженностью поля и способностью к поляризации, т.е.
ионным потенциалом,
z
, где z – заряд иона, а r – его радиус.
r
Внешнесферные комплексы образуются, если лиганды
способны образовывать вторую и более удаленные сферы.
Превращение внешнесферного комплекса во внутрисферный
возможно происходит в результате химической реакции:
M ( H 2O )
2
6
2
6
2
L M ( H 2 O ) ; L M ( H 2O ) 5 L H 2 O
12. Концепция «жестких» и «мягких» кислот и оснований Пирсона
Кроме ковалентной связи при образовании комплекса рассматриваютсядругие типы взаимодействия, в том числе и те, которые приводят
частично или полностью к электростатической (ионной) связи.
Жесткие частицы обладают прочной малодеформируемой электронной
структурой. Это могут быть атомы элементов с высокой
электроотрицательностью (F, O, N) или катионы с большим зарядом.
Жесткие кислоты. Электронная оболочка жестких кислот характеризуется
высокой стабильностью относительно внешних электрических полей.
Жесткие основания вследствие прочной и устойчивой электронной
оболочки, а также соответствующего строения электронных орбиталей не
имеют склонности к образованию ковалентных связей с катионом.
Мягкие частицы имеют подвижную деформируемую электронную
структуру и высокую поляризуемость.
Мягкие кислоты – большие катионы с деформируемой электронной
оболочкой.
Мягкие основания характеризуются высокой способностью к
поляризуемости.
13. Образование комплексных соединений
Анализируя константы устойчивости комплексов, можносделать вывод, что жесткие кислоты образуют наиболее
прочные соединения с жесткими основаниями, а мягкие
кислоты – с мягкими основаниями.
Большое значение имеет и то, каким образом формируется
соответствующее соединение, что определяет молекулярный
контакт при образовании этого соединения:
S2жесткость
группы
определяет кислород
мягкость
группы
определяет
сульфидная сера.
14. Распределение кислот и оснований по Пирсону
КомплексообразователиЖесткие кислоты
Промежуточная группа
Мягкие кислоты
H+, Li+, Na+, K+,
Fe2+, Co2+, Ni2+, Cu2+, Pb2+, Cu+, Ag+, Tl+, Tl3+,
Be2+, Mg2+, Ca2+, Sr2+,
Sn2+, Ru2+, Rh3+
Hg2+, Pd2+, Pt2+, Cd2+, Te4+
Al3+, Sc3+, Ga3+, In3+, Ln3+,
Cr3+, Co3+, Fe3+,
Si4+, WO4+, VO2+, Zr4+,
Th4+, Pu, UO22+
Лиганды
Жесткие основания
Промежуточная группа
H2O, OH-, F-, Cl-, CH3CO2- Br-,
, PO43-, SO42-, CO32-, ClO4-, C5H5N (пиридин),
NO3-,
NO2-, SO32-, N2
ROH, R2O, –NH2, RNH2,
R=O, N2H4
Ln – лантаноиды. R – органический радикал
Мягкие основания
I-, S2-,
R2S, RS, SCN-, S2O8R3P, CN-
15. Внутрикомплексные соединения
Лиганды, которые могут предоставить две или более электронных парцентральному атому для образования комплекса называются
полидентатными.
Комплекс, состоящий из центрального атома и одного или нескольких
полидентатных лигандов, называется хелатным соединением или
хелатом.
Примеры лигандов различной дентатности.
1.
2.
3.
Монодентатные лиганды: H2O, NH3, Cl-, CN-…
Бидентатные лиганды:
(этилендиамин).
SO42-,
CO32-,
Тридентатные лиганды: диацетоамин
октадентатных.
C2O42-,
и
NH2—C2H4—NH2
далее
вплоть
до
Комплексы с полидентатными лигандами более устойчивы,
чем с монодентатными.
16. Устойчивость комплексных соединений
[Cu(H2O)4]2+ + 4NH3 ↔ [Cu(NH3)4]2+ + 4H2O(1)
[Cu(H2O)4]2+ + 2en ↔ [Cu(en)2]2+ + 4H2O
(2)
Энергия Гиббса
G RT ln K
G H 0 T S .
Изменение числа степеней свободы системы:
для 1 реакции:
было – 5
стало – 5
для 2 реакции:
было – 3
стало - 5
17. Кинетика процесса
Рассмотрим две реакции с участием в качестве лигандов аммиака иэтилендиамина:
M + 2NH3 ↔ M(NH3)2
M + en
↔ M(en)
(1)
(2)
Образование соединений по обеим реакциям происходит в две
стадии:
1 реакция
2 реакция
Образование связи с 1 молекулой NH3
Случайное событие
Образование связи с 2 молекулой NH3
Случайное событие
Образование связи с азотом
одной амино-группы
Случайное
Образование связи с азотом
второй амино-группы
Предопределенное
событие
событие
18. Образование комплексов в присутствии различных лигандов
Определяетсясоотношением
констант
соответствующих комплексных соединений.
В зависимости от скорости обмена лигандами, а иногда и
центральными ионами, различают инертные и лабильные
комплексы.
Новый комплекс может образоваться в результате замены
одного или нескольких лигандов:
в реакциях диссоциативного типа
ML6 → ML5 + L
ML5 + Y → ML5Y ;
по механизму замещения:
устойчивости
19. Процесс образования гидроксосоединений
Образование гидроксосоединений свойственно большинствуэлементов, которые традиционно представляют интерес для
радиохимии, химии и технологии редких, рассеянных и
радиоактивных веществ.
Для элементов, которые находятся на микроконцентрационном
уровне, невозможно не учитывать процессы гидролиза, как
одну из причин изменения их состояния.
Гидролиз следует рассматривать как начальную стадию
образования гетерогенных систем.
Процесс образования гидроксокомплексов можно описать с
различных позиций:
1. образование гидроксокомплексов;
2. реакции гидролиза;
3. реакции протолиза.
20. Образование гидроксокомплексов
Mz
OH MOH
[ MOH ( z 1) ]
K1
[ M z ] [OH ]
( z 1)
MOH ( z 1) OH M (OH ) (2z 2)
[ M (OH ) (2z 2) ]
K2
[ MOH ( z 1) ] [OH ]
.........................
M (OH )i( z1 i 1) OH M (OH )i( z i )
[ M (OH )i( z i ) ]
Ki
[ M (OH )i( z1 i 1) ] [OH ]
Каждую ступень можно охарактеризовать ступенчатой
константой, а в общем виде – общей константой образования
гидроксокомплексов.
M
z
iOH M (OH )
i K1 K 2 K i
( z i )
i
[ M (OH )i( z i ) ]
i
[ M z ] [OH ]i
21. Реакция гидролиза
Mz
H 2O M (OH )
M (OH )
( z 1)
( z 1)
H
H 2O M (OH )
[ M (OH ) ( z 1) ] [ H ]
1
[M z ]
( z 2 )
2
H
[ M (OH ) (2z 2) ] [ H ]
2
[ M (OH ) ( z 1) ]
............................
[ M (OH )i( z i ) ] [ H ]
M (OH )
H 2O M (OH )
H
i
[ M (OH )i( z1 i 1) ]
γi – ступенчатые константы гидролиза. Константа гидролиза общая:
( z i 1)
i 1
( z i )
i
bi 1 2 i i
i
Связь между константами
гидролиза и константами образования
гидроксокомплексов осуществляется через ионное произведение воды:
[ H ] [OH ]
KW
H 2O H OH
K
KW [ H ] [OH ]
[OH ]
[ H 2O ]
[H ]
[ MOH ( z 1) ] [ MOH ( z 1) ] [ H ] 1
K1
z
z
[ M ] [OH ]
[ M ] KW
KW
1 K1 KW
bi i KWi
22. Реакция протолиза
Реакция протолиза – это реакция отщепления протона откоординированной молекулы воды:
[ M ( H 2O) n ]z [ M ( H 2O) n 1 OH ]( z 1) H aq
[[ M ( H 2O) n 1 OH ]( z 1) ] [ H ]
1
[[ M ( H 2O) n ]z ]
Информация о механизме физико-химического процесса должна
касаться стадийности массопереноса, установления скоростей,
выделения лимитирующих стадий.
Рассмотренные процессы, приводящих к образованию
гидроксокомплексов в растворе, различаются по механизму.
Расчеты, относящиеся к равновесному состоянию, можно
выполнять пользуясь любым из этих представлений и
соответствующей системой констант.
23.
Описание процесса гидролиза с точки зрения равновесногосостояния возможно с использованием констант гидролиза
или констант комплексообразования.
1
Zr
Zr(OH)
0,8
Zr(OH)2
0,6
Zr(OH)3
0,4
Zr(OH)4
0,2
0
-1,0
0,0
1,0
2,0
3,0
рН
Зависимость гидроксоформ состояния Zr(IV) от рН раствора
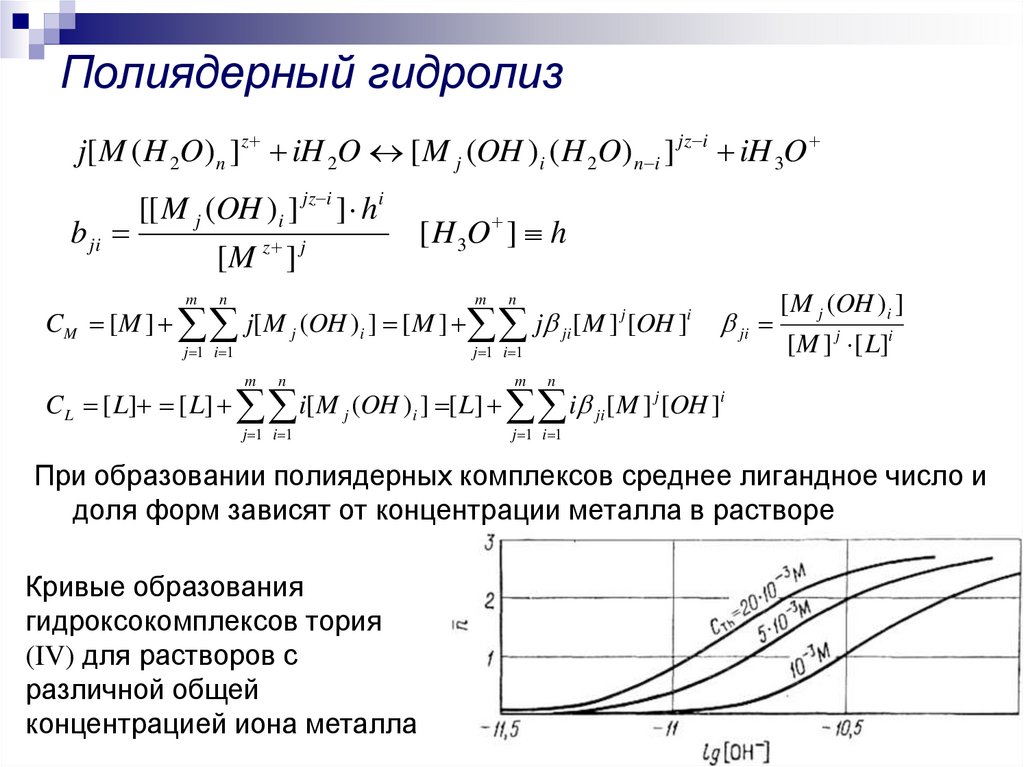
24. Полиядерный гидролиз
j[ M ( H 2O) n ]z iH 2O [ M j (OH )i ( H 2O) n i ] jz i iH 3Ob ji
[[ M j (OH )i ] jz i ] hi
[M z ] j
m
n
[ H 3O ] h
m
n
CM [ M ] j[ M j (OH )i ] [ M ] j ji [ M ] [OH ]
j
j 1 i 1
j 1 i 1
m
n
m
i
ji
[ M j (OH )i ]
[ M ] j [ L]i
n
CL [ L] [ L] i[ M j (OH )i ] [ L] i ji [ M ] j [OH ]i
j 1 i 1
j 1 i 1
При образовании полиядерных комплексов среднее лигандное число и
доля форм зависят от концентрации металла в растворе
Кривые образования
гидроксокомплексов тория
(IV) для растворов с
различной общей
концентрацией иона металла
25. Условия образования полиядерных комплексов
Нижний концентрационный предел, после достижениякоторого должны образовываться только моноядерные
комплексы, зависит от общей константы устойчивости
первого образующегося полиядерного комплекса (т.е.
биядерного) и от общей константы устойчивости комплекса,
последнего в ряду моноядерных, который имеет
одинаковое с биядерным число лигандов.
Чтобы концентрация моноядерного комплекса M(OH)n была
выше концентрации биядерного должно выполняться
следующее неравенство:
2[ M 2(OH ) n [ M (OH ) n ] или
2[ M ]2 [OH ]n 2 n [ M ] [OH ]n n
[M ]
n
2 2 n
, тогда
или lg[ M ] lg n lg 2 n lg 2 .
lg n lg 2 n = - 5,
Если
то чтобы моноядерная
форма преобладала, надо,
чтобы [M] < 10-5,3
26. Процесс образования полиядерных гидроксокомплексов уранил-иона
Схематически процессперехода от мономерного
иона к полимерному можно
представить следующим
образом:
[UO2(H2O)6]2+
[(UO2)2(OH)2(H2O)8]2+
[(UO2)3(OH)4(H2O)10]2+
мономер
димер
тример
UO22+
U2O52+
U3O82+
27. Оляция, оксоляция, замещение анионами
Последовательный переход от мономерного ионаполимерному происходит в результате протолиза
полимеризации.
к
и
Процесс полимеризации осуществляется путем образования
ол-связи, в результате чего образуются оловые соединения.
Оловые соединения – это комплексные соединения, в
которых атомы металла связаны между собой посредством
мостиковых ОН-групп:
Оляция часто сопровождается оксоляцией и/или замещение
анионами.
Оксоляция – это превращение оловых групп в мостиковые
оксогруппы:
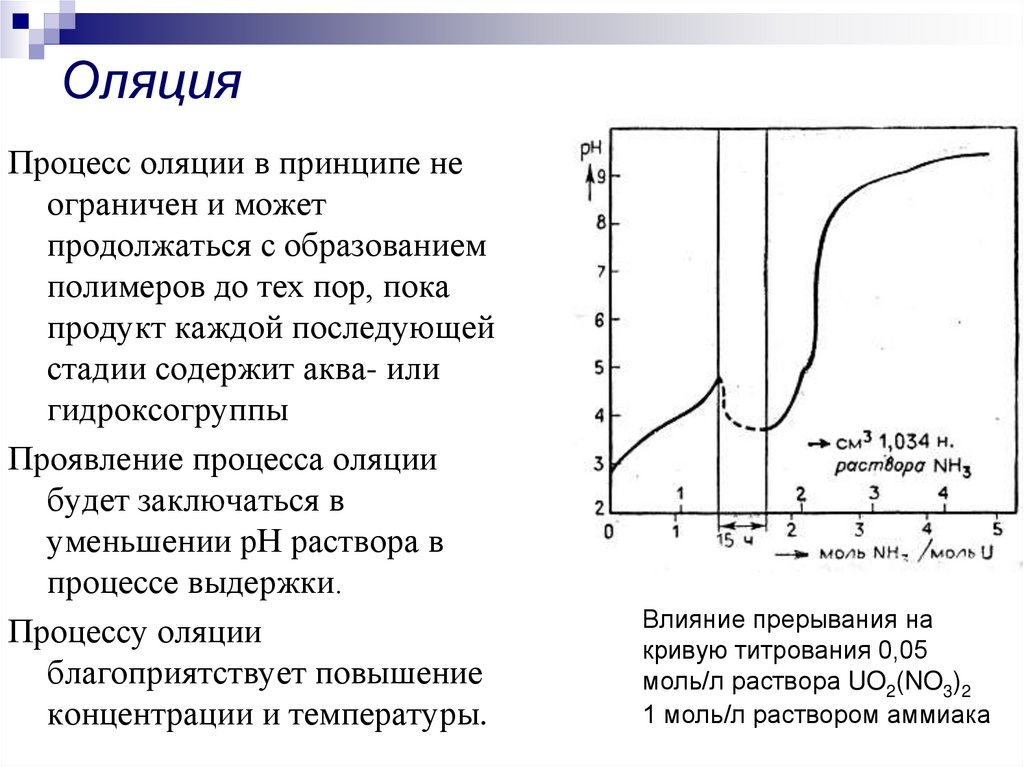
28. Оляция
Процесс оляции в принципе неограничен и может
продолжаться с образованием
полимеров до тех пор, пока
продукт каждой последующей
стадии содержит аква- или
гидроксогруппы
Проявление процесса оляции
будет заключаться в
уменьшении рН раствора в
процессе выдержки.
Процессу оляции
благоприятствует повышение
концентрации и температуры.
Влияние прерывания на
кривую титрования 0,05
моль/л раствора UO2(NO3)2
1 моль/л раствором аммиака
29. Оксоляция. Замещение анионами
Процесс оксоляции - превращение оловых групп в оксо-группы путемотщепления ионов водорода:
→
+ Н+.
Деоксоляция необычайно медленный процесс.
Если комплексный катион находится в равновесии с анионами, то возможно
осуществление следующих реакций с изменением рН среды:
Замещение
анионами позволяет
предотвратить
углубление процесса
гидролиза, рост
агрегатов и
коллоидных частиц
30. Выводы
Рассмотрены основные закономерности образования ионодисперсных формПроанализирован алгоритм расчета
микрокомпонентов в растворе.
Рассмотрены процессы,
гидроксосоединений
Показана
возможность
образования
полимерных
гидроксокомплексов
в
результате
последовательного
осуществления реакций протолиза и полимеризации.
С точки зрения закономерностей образования комплексных
соединений можно объяснить многие процессы межфазного
распределения,
реализуемые
в
сорбционных
и
экстракционных
системах,
которые
могут
быть
интерпретированы
как
процессы
гетерополярного
комплексообразования.
приводящие
форм
к
состояния
образованию
31. Библиографический список
Инцеди Я. Применение комплексов в аналитической химии/ Я.Инцеди. М.: Мир. 1979. 376 с.
Петерс Д. Химическое разделение и измерение. Теория и
практика аналитической химии/ Д. Петерс, Дж. Хайес, Г.
Хифтье. Пер. с англ. М.: Химия. 1978. 816 с.
Назаренко В.А. Гидролиз ионов металлов в разбавленных
растворах/ В.А. Назаренко, В.П. Антонович, Е.М. Невская.
Гидролиз ионов металлов в разбавленных растворах. М.:
Атомиздат. 1979. 192с.
Строение и свойства адсорбентов и катализаторов/ Под ред. Б.Г.
Линсена. М.: Мир. 1973. 653 с.




























 chemistry
chemistry








