Similar presentations:
Методы интенсификации гетерогенного процесса, протекающего в диффузионной области
1. Методы интенсификации гетерогенного процесса, протекающего в диффузионной области
2.
Если гетерогенный процесс протекает в кинетическойобласти, его скорость определяется скоростью
химической реакции.
Управлять таким процессом означает регулировать
скорость химической реакции с помощью
кинетических факторов (t, p, C, kat и др.).
Если процесс протекает в диффузионной области,
объектом управления становится скорость
массопередачи; и появляются новые инструменты
управления, такие как
-скорость перемешивания,
-поверхность контакта фаз
-и др. (гидродинамические факторы).
Концентрация реагентов и температура оказывают
уже меньшее влияние на процесс.
3.
Анализ влияния различных факторов наинтенсивность процесса должен быть основан на
законах массопередачи.
Основное уравнение массопередачи отражает
зависимость скорости массопередачи от
движущей силы процесса, в качестве которой
выступает разность концентраций вещества в
разных точках системы.
R = Kм f ∆C ,
где Км – коэффициент массопередачи, f – удельная
поверхность контакта фаз, ∆C – движущая сила
процесса.
4.
В случае гетерогенного процесса массоперенососуществляется не только внутри фазы, но и через
границу раздела фаз.
Рассмотрим последовательность и предел протекания
этих процессов, используя так называемую
двухпленочную модель массопереноса.
5.
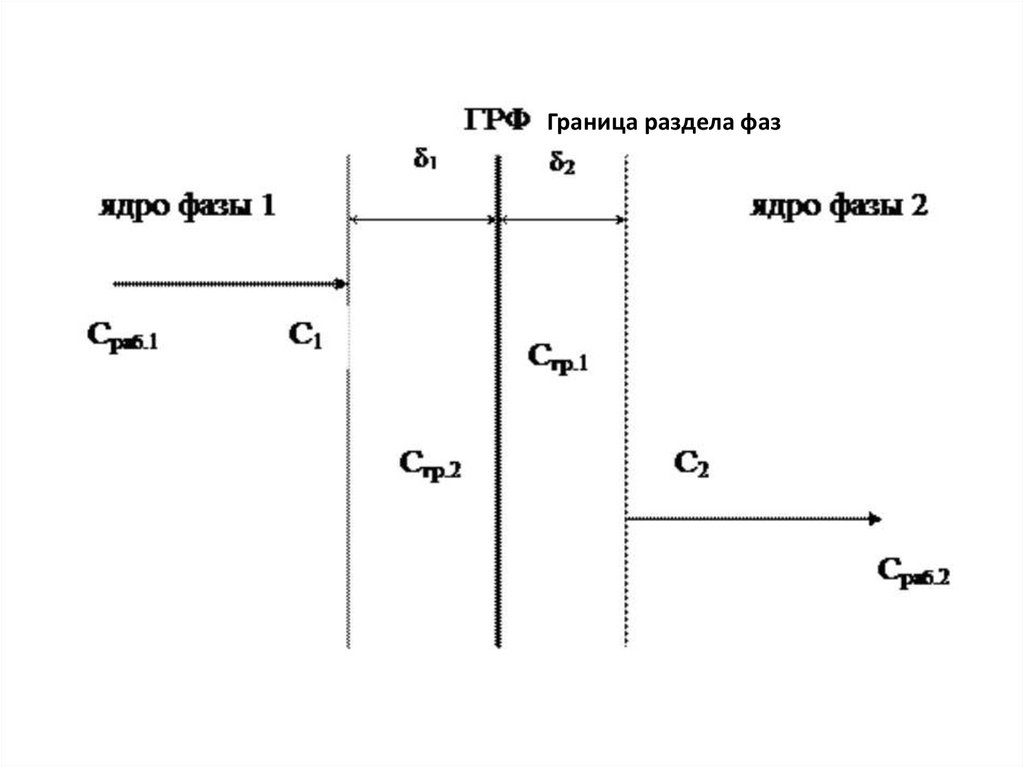
Граница раздела фаз6.
Согласно этой модели, в каждой фазе можно выделитьядро фазы, в котором перенос вещества
осуществляется как молекулярной, так и
конвективной диффузией, и пограничные слои
толщиной δ1 и δ2, расположенные у границы раздела
фаз.
В этих слоях, независимо от гидродинамики внешнего
потока, течение будет ламинарным, массоперенос
происходит только за счет молекулярной диффузии.
Очевидно, что медленной стадией является перенос
вещества через пограничные слои, так как скорость
молекулярной диффузии намного ниже скорости
конвективной диффузии.
7.
Пусть вещество переходит А из фазы 1 в фазу 2. Выделимосновные стадии процесса.
1 стадия – перенос из ядра фазы 1 к пограничному слою этой
фазы.
∆С1 = Сраб.1 – С1
При правильной организации конвективного переноса внутри
фазы концентрация выравнивается очень быстро. Сраб.1 = С1.
2 стадия – перенос через пограничный слой 1 фазы
(медленная стадия).
∆С2 = С1 – Сгр.1
3 стадия – перенос через границу раздела фаз.
Процесс перехода вещества через границу раздела фаз
возникает самопроизвольно и протекает до тех пор, пока
между фазами при данных внешних условиях (t и р) не
установится подвижное фазовое равновесие, при котором
скорость перехода вещества А из первой фазы во вторую будет
равна скорости перехода этого вещества из фазы 2 в фазу 1.
8.
Например, для системы«г-ж» эта связь определяется законом Генри,
для систем «г-т» и «ж-т» - изотермами адсорбции.
В общем случае можно записать
Сравн гран2 = F(Сравн гран 1 )
.
4 стадия – перенос через пограничный слой 2 фазы
(медленная стадия).
∆С3 = Сгр.2 – С2
5 стадия – перенос от пограничного слоя в ядро фазы 2.
∆С4 = С2 – Сраб.2
Таким образом, мы получили систему взаимосвязанных
процессов с включенной стадией подвижного
равновесия.
Сраб.1 → С1 → Сгр.1 ↔ Сгр.2 → С2 → Сраб.2
9.
Когда начинается процесс массопередачи?При организации конвективного переноса в ядре фазы
1 движущей силой процесса является разница
концентраций вещества А в ядре фазы 1 и на границе
раздела фаз.
∆С = Сраб.1 – Сгр.1
В момент соприкосновения фаз Сгр.1 =0, ∆С –max.
Когда процесс массопередачи закончится? Когда Сраб.1
станет равной Сгр.1. Это равенство может быть
достигнуто только при установлении динамического
равновесия, когда Сгр.1 и Сгр.2 достигают своих
равновесных значений и не изменяются во времени. А
это, в свою очередь, возможно, когда Сраб.2 = С2, а С2 =
Сгр.2.
10.
То есть, в конечном счете, величина движущейсилы процесса массопередачи равна разности
между рабочей и равновесной концентрацией
переходящего вещества в передающей фазе.
∆С =С раб1- Сравн гран 1
Как можно увеличить движущую силу, а,
следовательно, и скорость процесса?
1) повысить рабочую концентрацию вещества
(реагента), то есть работать с более
концентрированным сырьем;
2) понизить равновесную концентрацию вещества
на границе раздела фаз.
11.
Для этого нужно, изменяя внешние условия, сместить равновесиевправо.
Выбор способа смещения равновесия зависит от конкретного
типа равновесной системы.
Например, для системы «г-ж» сместить равновесие процесса
растворения газа в жидкости можно, увеличивая давление и
уменьшая температуру.
Для систем «г-т» и «ж-т» необходимо найти условия смещения
равновесия процесса адсорбции. Обычно для этого тоже
понижают температуру и повышают давление.
Для систем «ж-ж», обычно повышают температуру.
Принципы смещения равновесия в процессах массопереноса те
же, что для химических равновесий. Если процесс протекает с
выделением тепла (растворение газа в жидкости, адсорбция)
смещать равновесие вправо будет понижение температуры; в
случае эндотермического процесса (растворение жидкости и
твердого тела) – повышение температуры.
12.
В химических гетерогенных процессах мощнымфактором, смещающим фазовое равновесие, является
химическая реакция. Если скорость химической
реакции намного больше скорости массопередачи (то
есть процесс протекает в диффузионной области),
движущая сила процесса равна разнице между
рабочей концентрацией вещества в передающей
фазе и концентрацией его в зоне реакции.
∆С = Сраб.1 – Сз.р.,
так как фазовое равновесие практически не
устанавливается до тех пор, пока осуществляется
химическая реакция. В этом случае скорость процесса
можно увеличить только путем повышения Сраб
13.
В переходной области, при соизмеримых скоростях процессамассопередачи и химической реакции, изменяя технологические параметры, следует ожидать, что это окажет влияние
и на скорость химической реакции, и на состояние фазового
равновесия. Например,
А(т) ↔ А(раств.)
А(раств.) + В → С
Повышение температуры в этом случае приводит к
повышению константы скорости химической реакции и к
увеличению концентрации растворенного вещества А в
результате смещения фазового равновесия. Скорость
процесса однозначно будет возрастать.
А(г) ↔ А(раств.)
А(раств.) + В → С
Во втором случае повышение температуры увеличит
константу скорости химической реакции, но уменьшит
концентрацию растворенного вещества А. Предсказать, как
изменится скорость процесса, трудно.
14.
Наиболее эффективным способоминтенсификации гетерогенных процессов,
протекающих в диффузионной области,
является увеличение поверхности раздела
фаз.
Не следует стремиться к максимально
возможной величине межфазной поверхности.
Она должна быть оптимальной, так как слишком
сильное диспергирование одной из фаз
приводит, обычно к уносу ее из аппарата и
другим нежелательным эффектам.
15.
Например, пылевидное состояние твердой фазыувеличивает ее гидравлическое сопротивление и
приводит к значительным потерям в результате уноса
при больших скоростях потока газа или жидкости;
чрезмерное увеличение кратности вспенивания при
организации пенного режима снижает эффективность
использования объема реактора и т.д.
Следует отметить, что наличие высокоразвитой
поверхности не гарантирует высокой скоростипроцесса.
Накопление продуктов реакции на поверхности контакта
фаз часто является причиной уменьшения скорости
процесса, а иногда и полного его ингибирования, то есть
лимитирующей стадией может стать стадия диффузионного отвода продуктов реакции с поверхности.














 physics
physics








