Similar presentations:
Антибиотики в нейрореаниматологии
1.
Антибиотики внейрореаниматологии
Царенко С.В.
2. Две задачи антибиотикотерапии
Тактическая – вылечить конкретного больногоСтратегическая – предупредить формирование
полирезистентной микрофлоры
«Нейрореанимация – чашка Петри для
выращивания резистентной флоры»
3. Центральное противоречие АБ терапии – антибиотики широкого спектра
Широкий спектр антибактериальной терапии –путь к спасению одного больного и угроза для
сотен других
PRO: Первичная неэффективная АБ терапия
увеличивает летальность в 3 раза
CONTRA: Использование комбинаций АБ и АБ
широкого спектра ведет к формированию
полирезистентной микрофлоры
4. Парадоксально, но факт…
Чем больше выживает больных в остром периодеЧМТ или инсульта...
...тем больше их умирает от септических
осложнений из-за нарастающей резистентности
микрофлоры данного отделения реанимации
5. Парадоксально, но факт…
Чем ниже уровень здравоохранения, чем меньшеактуальность проблемы
В Европе ситуация хуже, чем в России
6. Инфекции – смерть современной медицины
Нарастающая полирезистентность микрофлоры –появление мульти- и панрезистентных штаммов:
MRSA, VRSA, VRE
ESBL – штаммы E.coli, Klebs.pneum, Enterobacter
KPC – Ps.auerog., Acinetobacter
7. Снижение числа инфекций
Оргмеры: чем дольше больной ожидает операции встационаре, тем больше инфекций
Кислород: послеоперационный СРАР и
оксигенотерапия (70-80%-ный О2) снижает число
пневмоний и хирургических инфекций
Рестриктивная тактика гемотрансфузий
Мероприятия асептики
Рациональная антибиотикотерапия
8. Способы решения проблемы
Экстенсивный – новые и хорошо забытые старыеАБ
Интенсивный – повышение эффективных доз
(фармакокинетика и фармакодинамика) и ротация
9. Резистентность, связанная с неадекватной антибиотикотерапией
Клинический и экономический ущерб резистентности P aeruginosa вкогорте госпитализированных пациентов (N=489)
Появление резистентных P. aeruginosa привело к:
Росту числа случаев неадекватной терапии
Росту летальности в 3,1 раза
Удлинение госпитализации в 2,1 раза
Дополнительные расходы 7340 долл. США
Carmeli Y. Arch Intern Med. 1999.
10. Как это происходит?
Экпоненциальный рост микроорганизмовЧастота спонтанных мутаций постоянна
Вывод 1 – чем больше микробный пул, чем больше
вероятность мутаций
Вывод 2 – чем быстрее снижается величина
микробного пула, тем меньше вероятность
мутаций
11. Экстенсивный путь
12. Рабочая классификация
Бета-лактамыПенициллины
Цефалоспорины
Карбапенемы
Фторхинолоны
Аминогликозиды
Отдельные АБ
13. Бета-лактамы
Активность против Ps.aerugenosae *Бета-лактамы
Активность против Enterobactericea*
Активность против MRSA*
Пенициллины – амоксициллин, пиперациллин *,
тикарциллин *
Цефалоспорины
Грам +
Грам -
Цеф 1 – цефазолин
Цеф 2 – цефокситин
Цеф 3 – цефотаксим *, цефтриаксон *,
цефоперазон * *, цефтазидим * * *
Цеф 4 – цефепим * * *
Карбапенемы – имипинем * *, меропенем * * *,
эртапенем, дорипинем * * *
14. Аминогликозиды
Активность против Ps.aerugenosae *Активность против Enterobactericea*
Аминогликозиды
Активность против MRSA*
Амг 1 – не используют
Амг 2 – тобрамицин *, гентамицин *
Амг 3 – амикацин * *, нетилмицин * *
Амг 4 - исепацин * * *
15. Фторхинолоны
Активность против Ps.aerugenosae *Активность против Enterobactericea*
Фторхинолоны
Активность против MRSA*
Фтх 1 – норфлоксацин
Фтх 2 - офлоксацин * *, пефлоксацин * *,
ципрофлоксацин * *
Фтх3 – левофлоксацин * * *
Фтх 4- «респираторные» Фтх:
гатифлоксацин, спарфлоксацин и др.
16. Отдельные АБ
Активность против Ps.aerugenosae *Отдельные АБ
Активность против Enterobactericea*
Активность против MRSA*
Ванкомицин * *
Полимиксин * * *
Бисептол * + активен против Sternotrophomonas malt.
Рифампицин *
17. Новые антибиотики
Активность против MRSA*Против Грам+
Линезолид (зивокс) * *
Эртапенем
Кубицин * *
18. Новые антибиотики
Активность против Ps.aerugenosae *Активность против Enterobactericea*
Новые антибиотики
Теория: бета-лактамазы разрушают
цефалоспорины и пенициллины
Цефаперазон+сульбактам * *(ингибитор бета-лактамаз)
Сульперазон, Сульперацеф
+антианаэробная активность
Тикарциллин + клавуланат – Тиментин * *
Пиперациллин + тазобактам – Тазоцин * *
19. Новые антибиотики
Активность против Enterobactericea*Активность против MRSA*
Новые антибиотики
Гликоциклины
Похожи на тетрациклины - те же побочные эффекты
Первый представитель гликоциклинов – тигацил
(тигециклин , Tigecyclin) * *
Хороший спектр антимикробной активности: все
анаэробы, MRSA, VRE (включающий оба Enterococcus –
faecium et faecalis), E.coli, Klebsiella (включая EBSL –
продуценты)
Активен против Sternotrophomonas, микроорганизма,
природно устойчивого даже к карбапенемам. Несмотря
на активность против Acinetobacter, препарат не
действует на Ps. aurogenosa
Плохо проникает в легочную ткань!!!??
20. Новые антибиотики
Активность против Ps.aerugenosae *Активность против Enterobactericea*
Активность против MRSA*
Новые антибиотики
Новые цефалоспорины – Зинфоро (цефтаролин) * *,
цефтобирол (Сeftobirol) * *, активны против MRSA и
E.faecalis.
По отношению к Грам-минус флоре активность похожа на
цефалоспорины III поколения
Новый карбапенем (дорипенем) * * - аккумулирует
преимущества имипенема и меропенема.
Sternotrophomonas устойчива к дорипенему!
21. Новые антибиотики
Разработка новых антибиотиков идет также путемусовершенствования старых препаратов:
рифампицин – рифапентин
ванкомицин – полусинтетические гликопептиды
виржиамицин - полусинтетические стрептограмины
имипенем - новые карбапенемы и тринемы
22. «Старые антибиотики»
Активность против Ps.aerugenosae *Активность против Enterobactericea*
«Старые антибиотики»
Полимиксины В и Е * *против неферментирующих
Грам – минус бактерий – не такие токсичные, как
считали ранее, нуждается в нагрузочной дозе (до 8 г)
Сочетание полимиксина с рифампицином против
карбапенем – устойчивой Kl. Pneumonia
Специальная форма полимиксина В, «прикрепленная»
к сорбенту (торамиксин) для абсорбции LPS
23. Интенсивный путь
Для начала разберемся в микробиологии ифармакологии…
….или зачем реаниматологу минимальная
подавляющая концентрация?
24. Свойства микроорганизмов
Учет природной устойчивостиУчет приобретенной устойчивости
25. Учет природной устойчивости
Грам+ флора устойчива к Цеф 3Синегнойная палочка устойчива к большинству
пенициллинов и цефалоспоринов
(исключения – тикарциллин, пиперациллин,
цефтазидим, цефепим, цефоперазон)
MRSA устойчивы ко всем! бета-лактамам
26. Учет приобретенной устойчивости
Устойчивость Enterobactericea к любому Цеф3предполагает неэффективность остальных
цефалоспоринов (кроме цефепима и цефокситина)
Устойчивость Ps. aerugenosae к одному из
антисинегнойных препаратов не предполагает
устойчивости к другим
Неэффективность одних аминогликозидов и
фторхинолонов не предполагает неэффективности
других препаратов этих групп
Повторное использование некоторых антибиотиков у
того же больного возможно! (эффект de ja vu
аминогликозидов и карбапенемов)
27. Определение МПК методом серийных разведений (1 этап)
Минимальная подавляющая концентрация (МПК), илиminimal inhibitory concentration (MIC) – это самая
низкая концентрация антибиотика, выражаемая в
мкг/мл, при которой полностью подавляется видимый
рост микроорганизма.
28. Оценка полученной величины МПК (2 этап)
Полученную МПК сравнивают со стандартом –предельными МПК антибиотика в отношении
данного микроорганизма, установленными
международной организацией
химиотерапевтов
В англоязычной литературе предельное
значение МПК называется breakpoint («точка
перелома»)
29. Оценка полученной величины МПК (2 этап)
Две стандартные точки перелома – верхний и нижнийбрейкпойнты.
Величины брейкпойнтов МПК учитывают примерную
концентрацию антибиотика в плазме при введении
рекомендуемых производителем доз
(обычная величина брейкпойнтов от 2 до 8 мкг/мл)
30. Оценка полученной величины МПК (2 этап)
Если для подавления роста тестируемого микроорганизманеобходимы концентрации антибиотика, меньшие или
равные нижнему брейкпойнту МПК, то он считается
чувствительным к данному антибактериальному препарату
«S» - действует всегда!
Если величина МПК находится между нижним и верхним
брейкпойнтом, то чувствительность – промежуточная «I» действует иногда!
Если МПК превышает верхний брейкпойнт, то
микроорганизм считается устойчивым к данному
антибиотику «R» -не действует никогда!
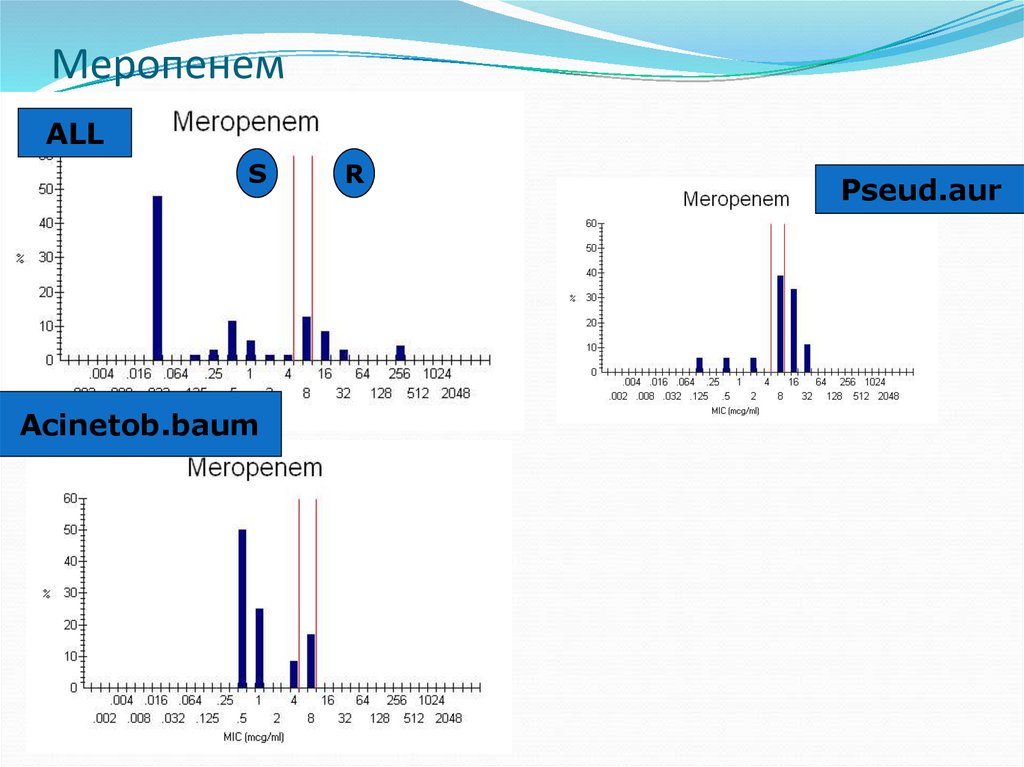
31. Меропенем
ALLS
Acinetob.baum
R
Pseud.aur
32. «Антистафилококковые» АБ
SR
33. Обычная клиническая практика – дискодиффузионный метод
Приблизительнаяоценка МПК
тестируемого
микроорганизма
величине верхнего и
нижнего
брейкпойнтов
1. Нет зоны подавления роста – «R»
1. Большая зона подавления роста – «S»
2. Умеренная зона подавления роста – «I»
34. Никогда не говори «никогда» …
35. 1 предварительный вывод
Понятие чувствительности и устойчивостимикроорганизма чаще всего условное (как
договорились…)
Разные микроорганизмы могут иметь разные МПК
36. 2 предварительный вывод
Если повысить МПК in vivo, то эффективность АБ-терапии возрастет
37. Суть проблемы интенсификации – повысить концентрацию АБ в тканях макроорганизма
Неправильные режимывведения
и низкие дозы АБ
Недостаточная
МПК (MIC)
Полирезистентная
флора
Неэффективность
лечения
38. Что делать? Безопасное увеличение концентрации антибиотиков!
Учет фармакокинетических свойствПовышение суточных доз
39. Немного фармакокинетики
Дозо-зависимое воздействие АБВремя-зависимое воздействие АБ
Или как самого себя вытащить за волосы из
болота….
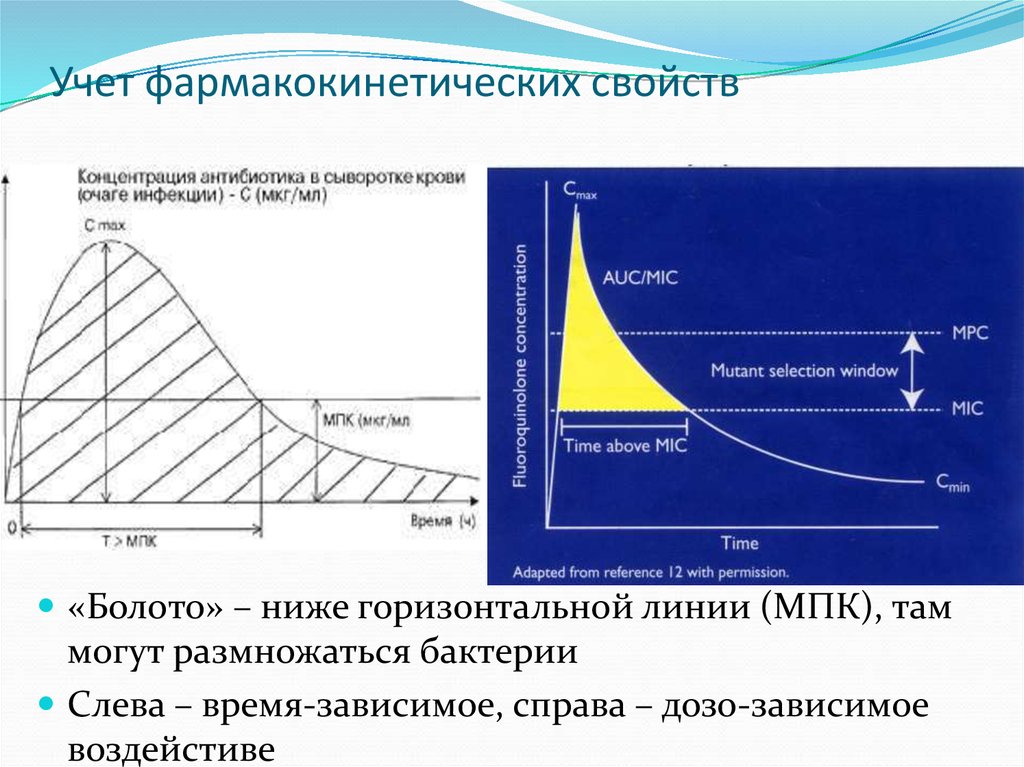
40. Учет фармакокинетических свойств
«Болото» – ниже горизонтальной линии (МПК), таммогут размножаться бактерии
Слева – время-зависимое, справа – дозо-зависимое
воздейстиве
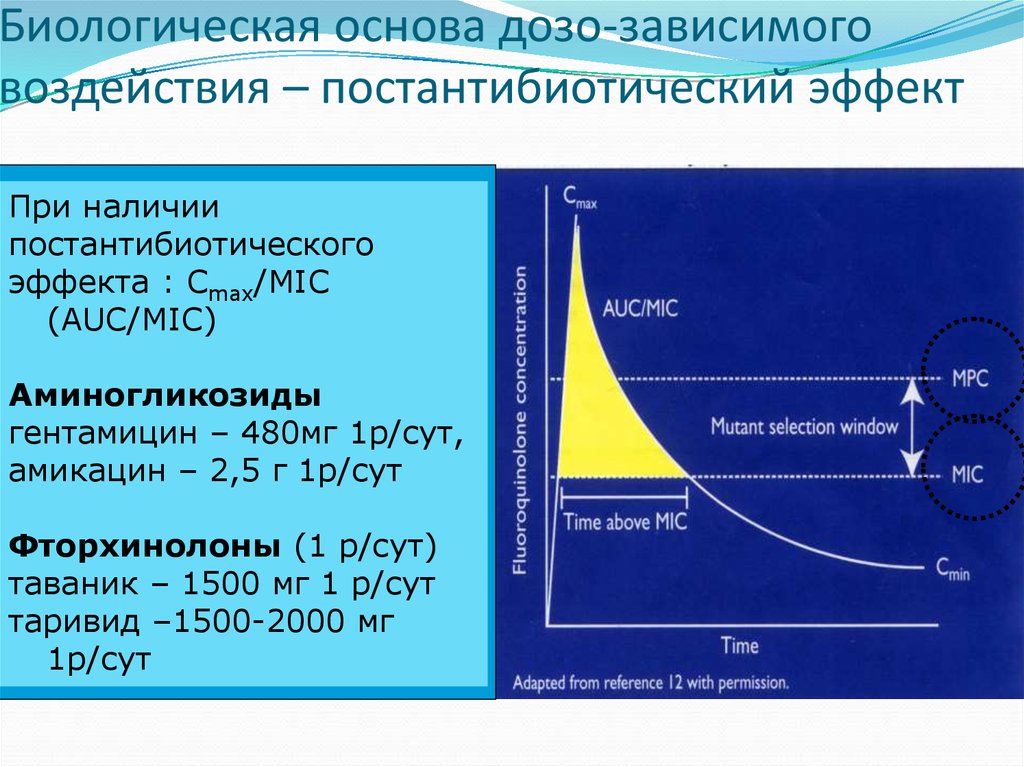
41. Биологическая основа дозо-зависимого воздействия – постантибиотический эффект
При наличиипостантибиотического
эффекта : Сmax/MIC
(AUC/MIC)
Аминогликозиды
гентамицин – 480мг 1р/сут,
амикацин – 2,5 г 1р/сут
Фторхинолоны (1 р/сут)
таваник – 1500 мг 1 р/сут
таривид –1500-2000 мг
1р/сут
42. Clyde I. Miyagawa. Aminoglycosides in the Intensive Care Unit: An Old Drug in a Dynamic Environment // New Horizons 1993; 2:172-180
Clyde I. Miyagawa. Aminoglycosides in the Intensive Care Unit: AnOld Drug in a Dynamic Environment // New Horizons 1993; 2:172180
CONCENTRATION (mg/dL)
C
Нефротоксический эффект
(впадина)
Концентрация гентамицина при разном режиме введения суточной дозы:
трехкратном и однократном. Нефротоксичекий эффект зависит от времени
поддержания концентрации выше впадины (обозначена горизонтальной линией)
По оси абсцисс – время, по оси ординат – концентрация антибиотика. В мг/100мл
43. Нет (или почти нет) постантибиотического эффекта – время-зависимое воздействие АБ
MICБез постантибиотического эффекта: бета-лактамы,
ванкомицин
время-зависимый эффект (time-dependent) – %T>MIC
Частое введение, длительная инфузия
44. Карбапенемы – самые эффективные антибиотики!! ????
Лучший АБ спектр (в недавнем прошлом)«Time- dependent effect» в сочетании с небольшим
постантибиотическим
Нагрузочный болюс + длительная инфузия
ОГРАНИЧЕННОЕ ВРЕМЯ ХРАНЕНИЯ ПОСЛЕ
РАЗВЕДЕНИЯ!!! (охлаждение шприца?).
%T>MIC >40% - бактериостатический эффект
%T>MIC >70% - бактерицидный эффект
45. Очень важно при использовании карбапенемов…
Не потерять темпа в соревновании смикроорганизмами - предупредить формирование
резистентности…
Для этого…
46. Меропенем – длительная инфузия
МПК2МПК1
Mattoes HM, Kuti JL, Drusano GL, Nicolau DP.
Optimizing antimicrobial pharmacodynamics:
Dosage strategies for meropenem.
Clinical Therapeutics 2004;26(8):1187-98.
47. Концентрация в плазме дорипенема (500 мг в/в) при введении в течение 1 часа и 4 часов
500 мг вводить в/в в течение часа500 мг вводить в/в в течение 4 часов
Концентрация (мкг/мл)
25
20
15
10
5
0
0
1
2
3
4
Время (ч)
5
6
7
8
48. Повышение суточных доз !?
Контроль и профилактика побочных эффектов:лабораторный мониторинг, инфузионная
терапия 40-60 мл/кг)
49. Эффективность in vivo (нестандартные режимы) при «неэффективности» in vitro
Нестандартные режимыАБ
Всего
больных
Эффект in
vitro
Эффект in
vivo
Гентамицин 320-480 мг
1р/сут
26
4 (15%)
21 (88%)
Амикацин 2,5-3 г 1р/сут
12
3 (25%)
11 (92%)
Офлоксацин (таривид)
500-700 мг 3р/сут
12
2 (17%)
6 (50%)
Левофлоксацин
(таваник) 500 мг 3р/сут
19
8 (42%)
18 (95%)
1 (17%)
1 (17%)
Ципрофлоксацин 1000 мг 6
2р/сут
50. Повышения эффективности АБ-терапии
Резкое расширение к использованию комбинацийАБ для снижения вероятности спонтанных
мутаций проблемных микроорганизмов (не для
расширения спектра действия!!!) :
меронем с полимиксином
полимиксин с рифампицином
карбапенем с аминогликозидом
два карбапенема?
Надо не всегда: напр., зачем метронидазол добавлять
к карбапенему или сульперазону?
51. 4 тактики антибиотикотерапии
Профилактическая (плановые операции в nonemergency hospital) – не путать профилактику илечение!!!
Эскалация (больные без начальных признаков ГСО, тяжесть
состояния которых не предполагает улучшения в течение
ближайших недель) – все реже и все уже спектр стартовых АБ
Деэскалация (больные с явными признаками ГСО,
угрожающими жизни) – все чаще и все меньше возможностей
Рестрикция (больные с быстрым восстановлением сознания, без
явных признаков ГСО, а также «выздоравливающие больные»?)
52. Меньше антибиотиков?
Неинфекционная причина SIRSОграничить, по-возможности, использование
препаратов широкого спектра
Не затягивать сроки АБ терапии
Не забыть про неклостридиальный колит!
53. Антигрибковые антибиотики?
Нет иммунодефицита – не нужны антигрибковыепрепараты!!!
54. Заключение
Или что делать, когда в анализе из баклабораториинет буковок «Ч» и «S»
55. Пути повышения эффективности АБ-терапии
Пути повышения эффективности АБтерапииКонтроль микрофлоры отделения
Повышение МПК за счет новых доз и новых
режимов введения
Комбинации АБ против проблемных
микроорганизмов
Новые и «забытые» АБ
Ограничение использования АБ
56. Take home message
Использование принципов фармакокинетики ифармакодинамики (длительные инфузии βлактамов и ванкомицина, большие
однократные дозы аминогликозидов и
фторхинолонов)
Максимально допустимые дозы АБ
Полихимиотерапия проблемных
микроорганизмов





















































 medicine
medicine








