Similar presentations:
Функциональные производные углеводородов. Галогенопроизводные углеводородов
1.
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕУГЛЕВОДОРОДОВ
Галогенопроизводные
углеводородов
Классификация
1. От природы галогена:
Различают фтористые, хлористые,
бромистые, иодистые
галогенорпроизводные.
1
2.
2. От природы углеводородногоостатка R:
Алифатические (алкилгалогениды или
галогеналканы) R-Hal, ароматические Ar-Hal и
жирно-ароматические, содержащие галоген в
боковой цепи.
Br
H2C
I
Cl
H3C
CH
CH3
изопропилхлорид
хлористый изопропил
2-хлорпропан
фенилбромид
бензилиодид
бромистый фенил иодистый бензил
бромбензол
фенилиодметан
иодметилбензол
2
3.
3. По характеру С в sp3-гибридномсостоянии, с которым связан галоген:
Первичные – R-СН2- Hal,
вторичные (R)2СН- Hal,
третичные (R)3С- Hal.
3
4.
ГалогенуглеводородыАлкилгалогениды
Винилгалогениды
Аллилгалогениды
первичные
вторичные
Арилгалогениды
Бензилгалогениды
третичные
4
5.
НоменклатураРадикально-функциональные
названия: строятся путем
прибавления названия галогена в
форме прилагательного перед
названием R, или после него с
окончанием –ид.
По ИЮПАК галогены перечисляются
в префиксной части названия .
5
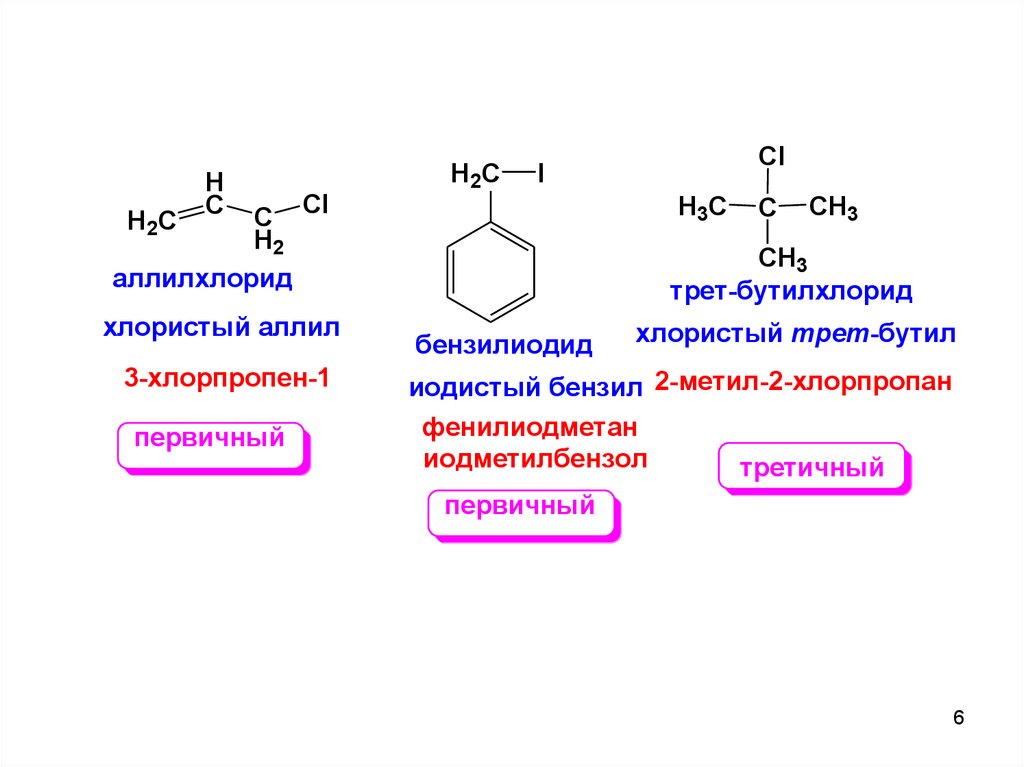
6.
HC
C Cl
H2
аллилхлорид
H2C
хлористый аллил
3-хлорпропен-1
первичный
H2C
Cl
I
H3C
C
CH3
CH3
трет-бутилхлорид
бензилиодид
хлористый трет-бутил
иодистый бензил 2-метил-2-хлорпропан
фенилиодметан
иодметилбензол
третичный
первичный
6
7.
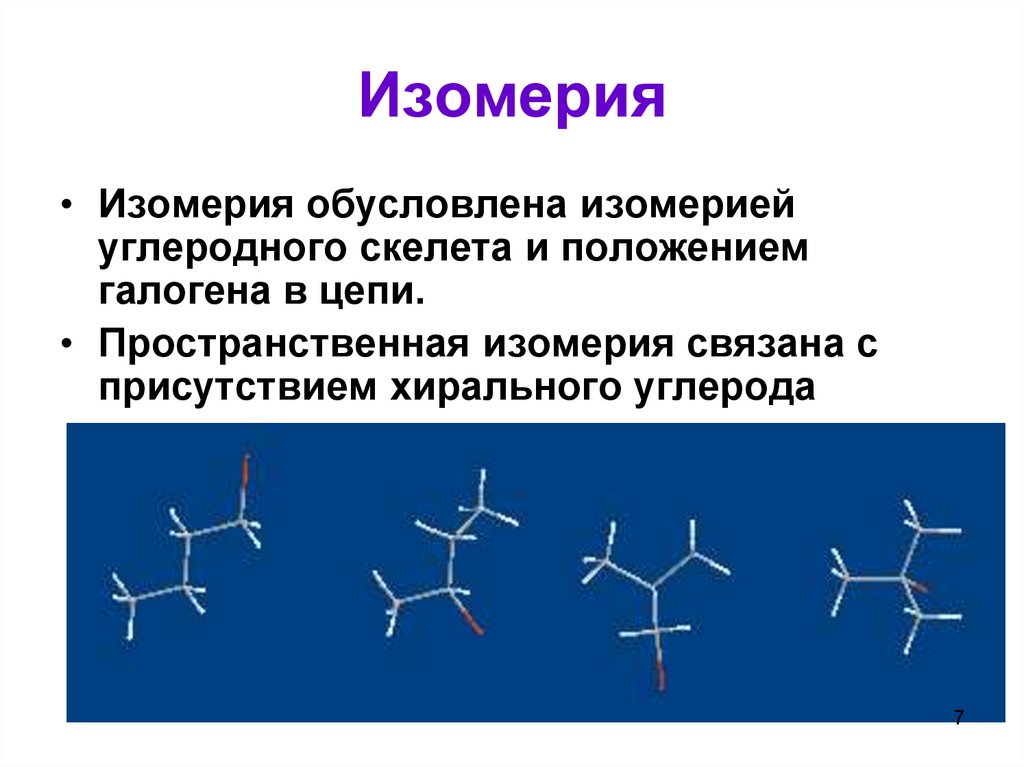
Изомерия• Изомерия обусловлена изомерией
углеродного скелета и положением
галогена в цепи.
• Пространственная изомерия связана с
присутствием хирального углерода
7
8.
Способы получения галогенуглеводородов✔ Галогенирование насыщенных углеводородов
✔ Галогенирование ненасыщенных углеводородов
8
9.
Способы получения галогенуглеводородов✔
Гидрогалогенирование ненасыщенных
углеводородов
✔
Галогенирование ароматических углеводородов
9
10.
Способы получения галогенуглеводородов✔
Замещение гидроксигруппы в спиртах на галоген
Удобные реагенты для замещения ОН-группы в спиртах –
галогениды фосфора (III), фосфора (V), тионилхлорид.
10
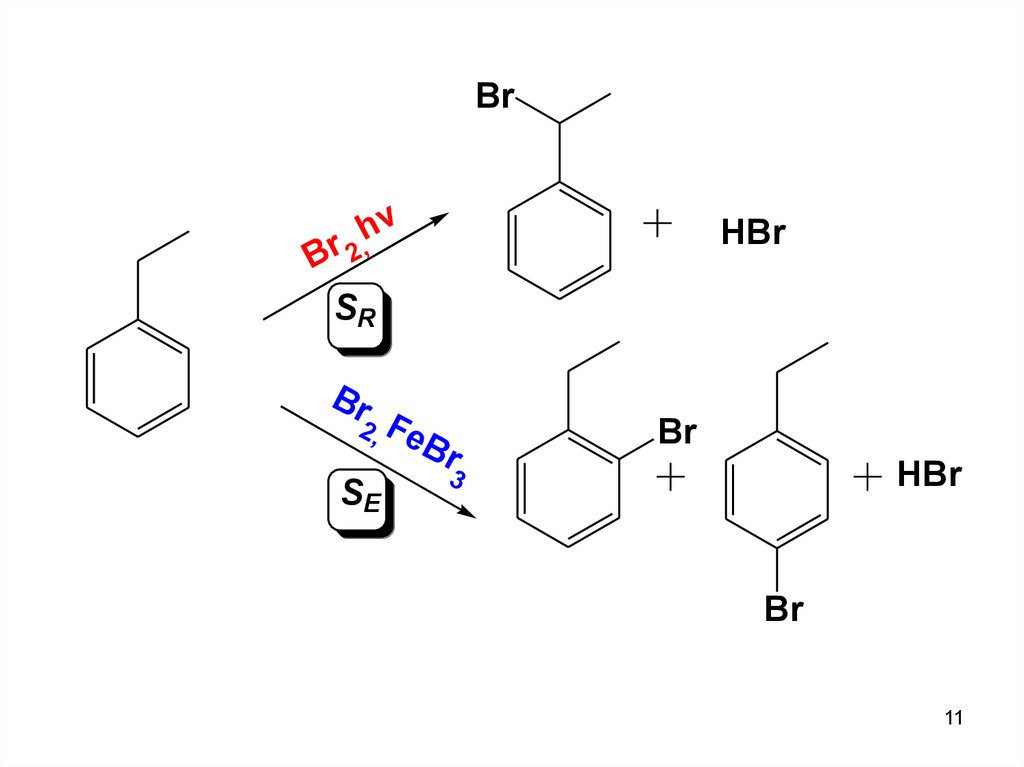
11.
Brv
h
Br 2,
SR
Br
2, Fe
B
SE
HBr
r
Br
HBr
3
Br
11
12.
Дегидрогалогенированиедигалогеналканов.
Это способ получения
винилгалогенидов:
X
X
R
R
KOH
спирт
R
R
KX
H 2O
X
12
13.
Галогенпроизводные углеводородовПолучение из альдегидов и кетонов
O
CH3 C
H
PCl5
ацетальдегид
CH3CHCl2 + POCl3
1,1-дихлорэтан
Br
CH3 C
O
ацетон
CH3 + PBr5
CH3 C
CH3 + POBr3
Br
2,2-дибромпропан
13
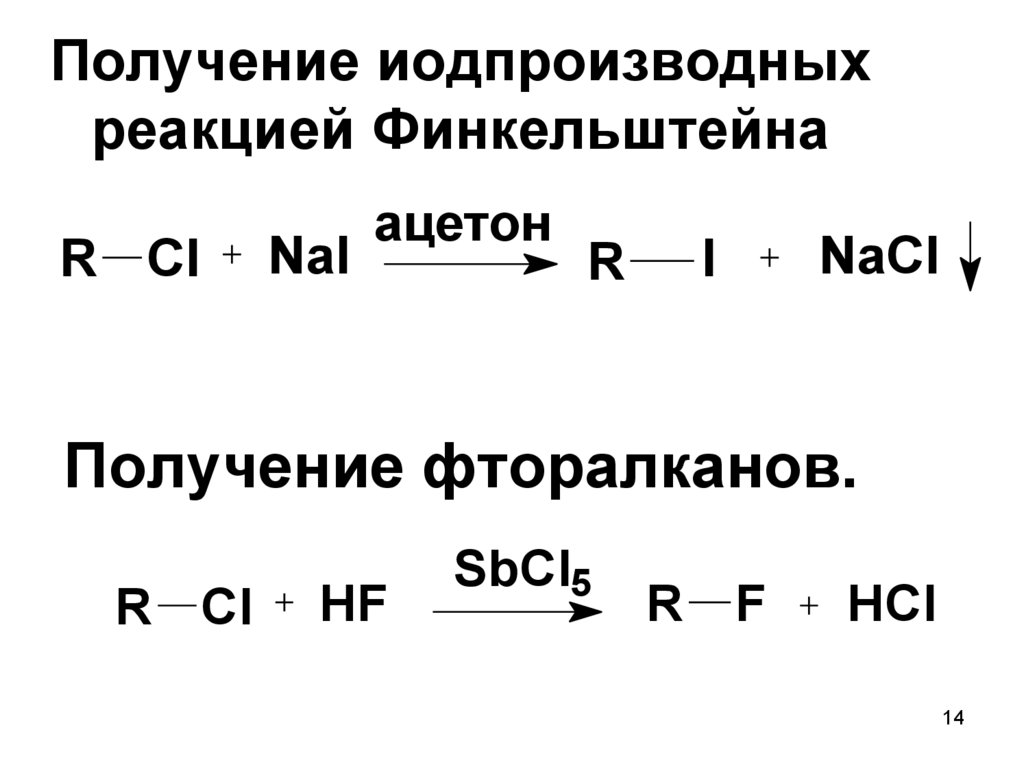
14.
Получение иодпроизводныхреакцией Финкельштейна
R Cl
NaI
ацетон
NaCl
I
R
Получение фторалканов.
R Cl
HF
SbCl5
R
F
HCl
14
15.
ФИЗИЧЕСКИЕ СВОЙСТВА• Физические свойства галогеналканов
зависят от природы и числа атомов
галогена в молекуле. Низшие и средние
галагеналканы – бесцветные газы или
жидкости со своеобразным сладковатым
запахом.
• Т. кип. галогеналканов с одинаковым R
повышаются с увеличением атомной
массы галогена в ряду F<Cl<Br<I.
• Высшие гомологи , а также
полигалогенпроизводные – бесцветные
крист. в-ва.
15
16.
• Полифторалканы заметно отличаются посвойствам от других галогеналканов.
• Переход от одного галогена к другому заметно
отражается на изменении относительной
плотности веществ. Однозамещенные
хлороалканы легче воды, Br- и I-производные
– тяжелее.
• С увеличением атомного радиуса галогена
увеличивается показатель преломления. Iпроизводные имеют наиболее высокие
показатели преломления.
16
17.
• Галогеноуглеводороды – полярныесоединения, но они почти
нерастворимы в воде , так как не
образуют с ней водородных связей, и
растворимы в спиртах и других орг.
растворителях.
17
18.
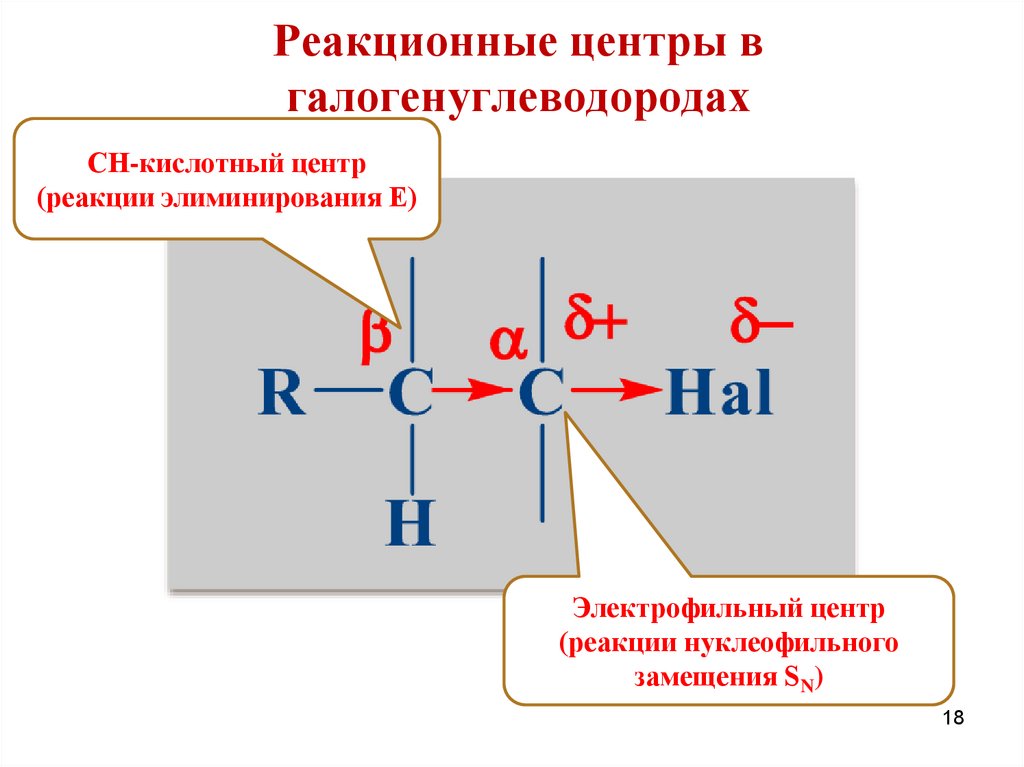
Реакционные центры вгалогенуглеводородах
СН-кислотный центр
(реакции элиминирования Е)
Электрофильный центр
(реакции нуклеофильного
замещения SN)
18
19.
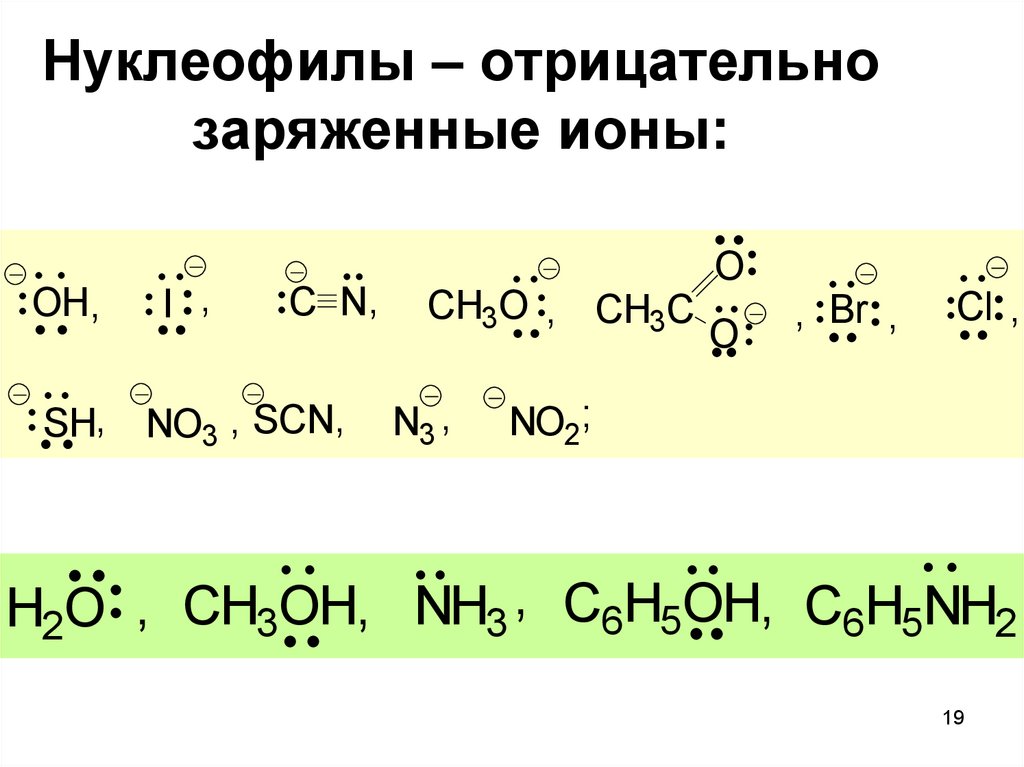
Нуклеофилы – отрицательнозаряженные ионы:
OH,
I ,
C N,
SH, NO3 , SCN,
CH3O , CH3C
N3 ,
O
O
, Br ,
Cl ,
NO2;
H2O , CH3OH, NH3 , C6H5OH, C6H5NH2
19
20.
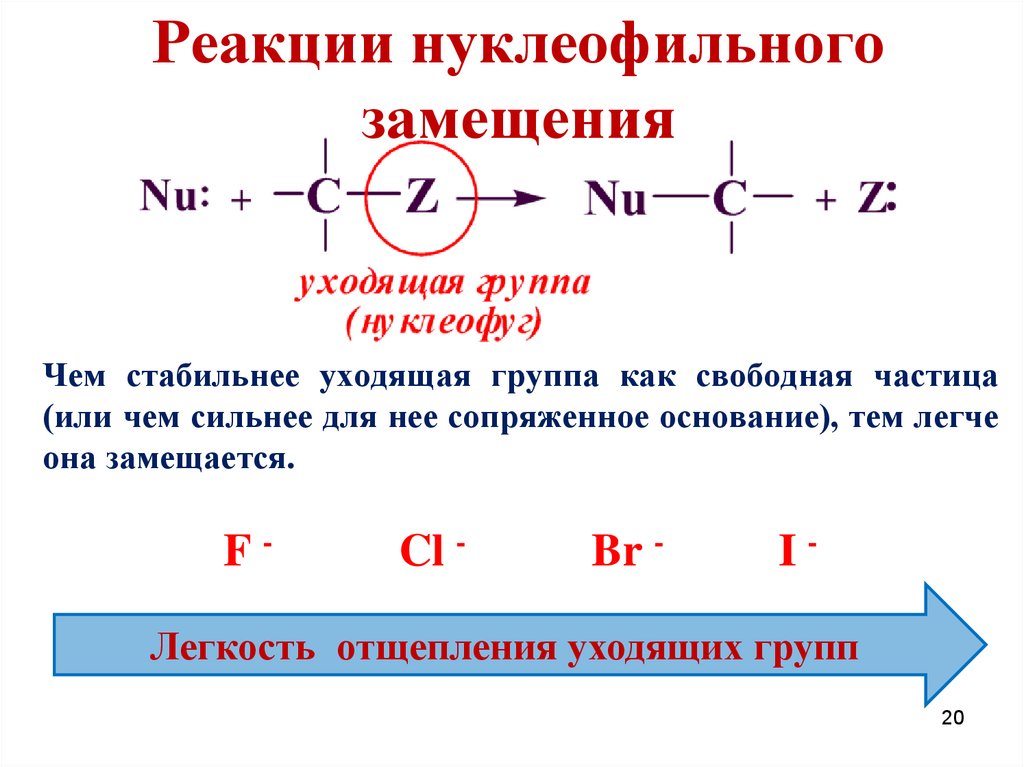
Реакции нуклеофильногозамещения
Чем стабильнее уходящая группа как свободная частица
(или чем сильнее для нее сопряженное основание), тем легче
она замещается.
F-
Cl -
Br -
I-
Легкость отщепления уходящих групп
20
21.
Мономолекулярноенуклеофильное замещение (SN1)
✔ Лимитирующей стадией реакции является ионизация субстрата,
приводящая к образованию плоского карбокатиона. Чем стабильнее
образующийся карбокатион, тем выше скорость реакции. Т.о.,
реакционная способность алкилгалогенидов увеличивается в ряду:
первичный < вторичный < третичный.
✔ Скорость реакции
нуклеофила.
не
зависит
от
природы
и
концентрации
✔ Стереохимическим результатом реакции является рацемизация.
✔ Реакция может сопровождаться перегруппировками карбокатионов
21
на промежуточной стадии.
22.
Бимолекулярное нуклеофильноезамещение (SN2)
✔ Реакция
является
одностадийным
синхронным
процессом,
протекающим через переходное состояние с пентакоординированным
атомом углерода.
Чем доступнее реакционный центр для атаки
нуклеофилом,
тем выше скорость реакции. Т.о., реакционная
способность алкилгалогенидов увеличивается в ряду: третичный <
вторичный < первичный.
✔ Скорость реакции зависит от природы и концентрации нуклеофила.
✔ Стереохимическим результатом реакции является
конфигурации (нуклеофил осуществляет атаку «с тыла»).
обращение
22
23.
НуклеофильностьНуклеофильность – это способность отдать пару электронов
электрофильному атому углерода или другому положительно
заряженному атому, кроме протона.
нуклеофильность отрицательно заряженных нуклеофилов
выше, чем у соответствующих сопряженных кислот;
✔
в периоде ПСЭ нуклеофильность изменяется параллельно с
основностью
NH2− > RO− > OH− > R2NH > ArO− > NH3 > F− …
✔
в группе ПСЭ нуклеофильность возрастает сверху вниз (тогда
как основность падает)
✔
I− > Br− > Cl− > F−
23
24.
Влияние нуклеофильности реагента.Активность нуклеофила
сказывается на скорости реакций типа
SN2, поскольку он принимает участие
в лимитирующей стадии процесса.
Нуклеофильность зависит от:
а) основности реагента,
б) поляризуемости реагента,
в) природы растворителя.
24
25.
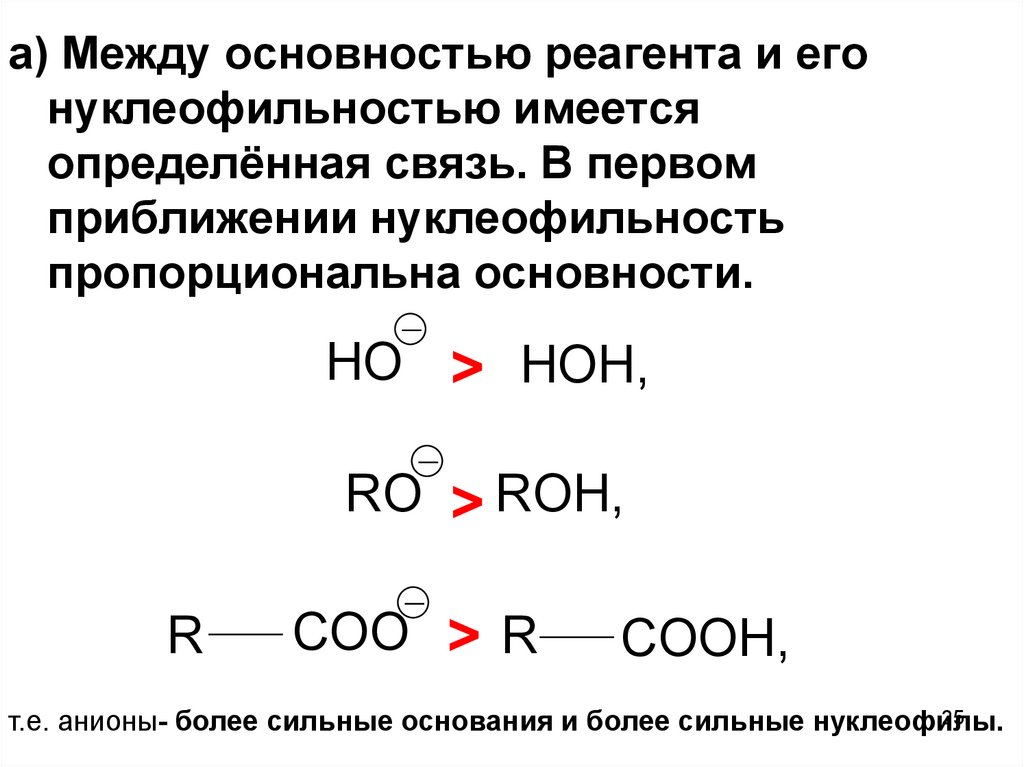
а) Между основностью реагента и егонуклеофильностью имеется
определённая связь. В первом
приближении нуклеофильность
пропорциональна основности.
HO > HOH,
RO > ROH,
R
COO > R
COOH,
25
т.е. анионы- более сильные основания и более сильные нуклеофилы.
26.
б) Нуклеофильность определяется ещё иполяризуемостью. Чем больше размер
атома, тем выше его нуклеофильность.
Легкополяризуемые реагенты
SH, SCN, I, S2O3
обладают высокой нуклеофильностью в
растворителях различного типа.
26
27.
в) На нуклеофильностьслабополяризуемых ионов значительное
влияние оказывает природа
растворителя.
H O H X
• В полярных растворителях ионы
находятся в сольватированном
состоянии, и чем сильнее сольватирован
анион, тем меньше его нуклеофильность.
В больших анионах степень сольватации
меньше. Поэтому больший анион
освобождается от растворителя с
меньшей затратой энергии.
27
28.
Сильное взаимодействие междурастворителем и анионом малого размера
подавляет его нуклеофильность.
28
29.
Реагенты по возрастанию ихнуклеофильности в SN2-реакциях в
протонных растворителях можно
расположить таким образом:
F < H2O < Cl < C6H5O < Br < OH < OR < NH3 < CN
< I
Нуклеофильность возрастает с увеличением поляризуемости
29
30.
Апротонный растворитель не способенсольватировать анионы за счёт
образования водородных связей с ними,
поэтому анионы в этом случае
«обнажённые», т.е. без сольватных
оболочек. Поэтому анион малого размера,
имеющий большой «-» заряд, является
более сильным нуклеофилом.
30
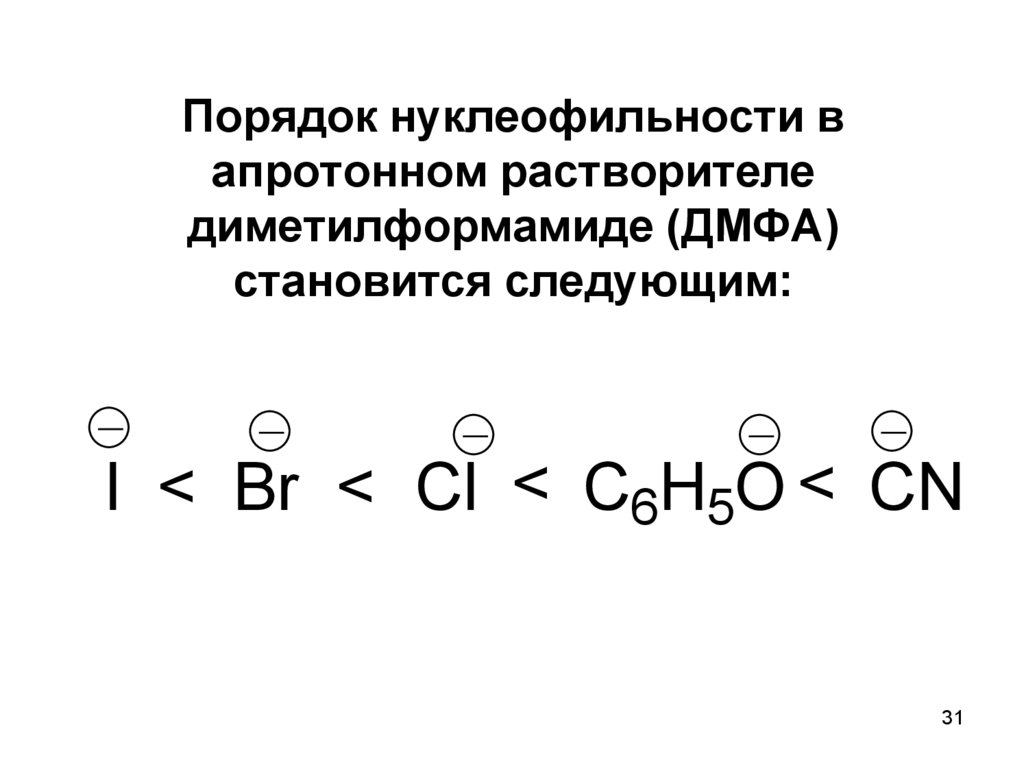
31.
Порядок нуклеофильности вапротонном растворителе
диметилформамиде (ДМФА)
становится следующим:
I < Br < Cl < C6H5O < CN
31
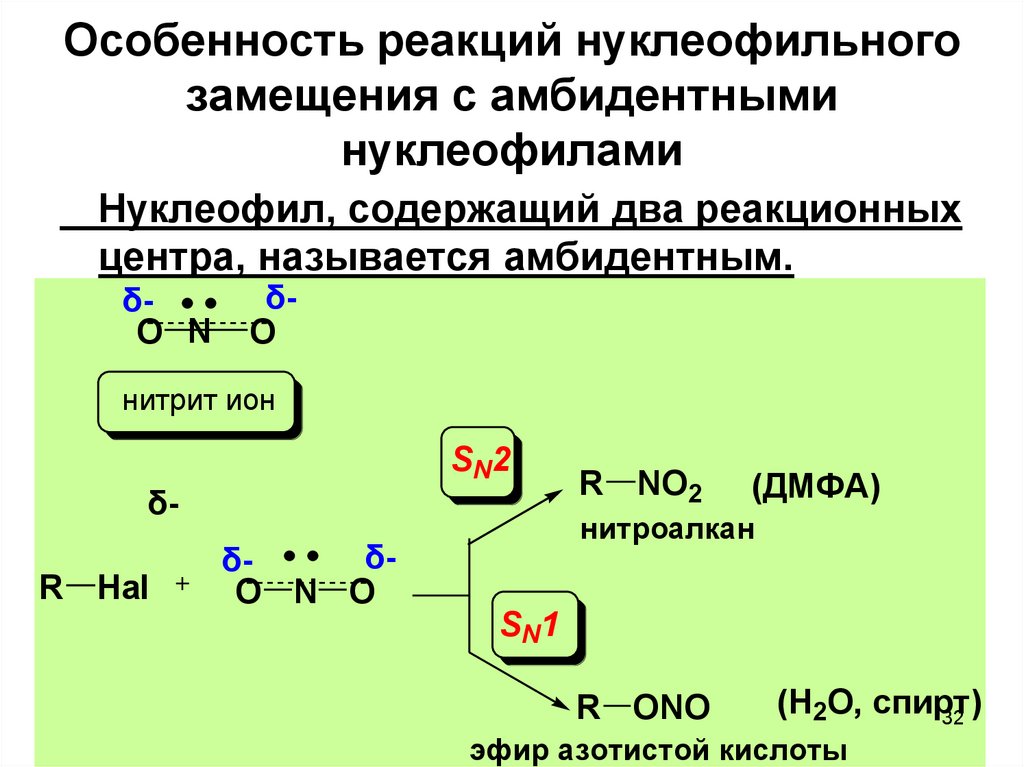
32.
Особенность реакций нуклеофильногозамещения с амбидентными
нуклеофилами
Нуклеофил, содержащий два реакционных
центра, называется амбидентным.
δO N
δO
нитрит ион
SN2
δR Hal
δδO N O
R NO2
(ДМФА)
нитроалкан
SN1
R ONO
(Н2О, спирт)
32
эфир азотистой кислоты
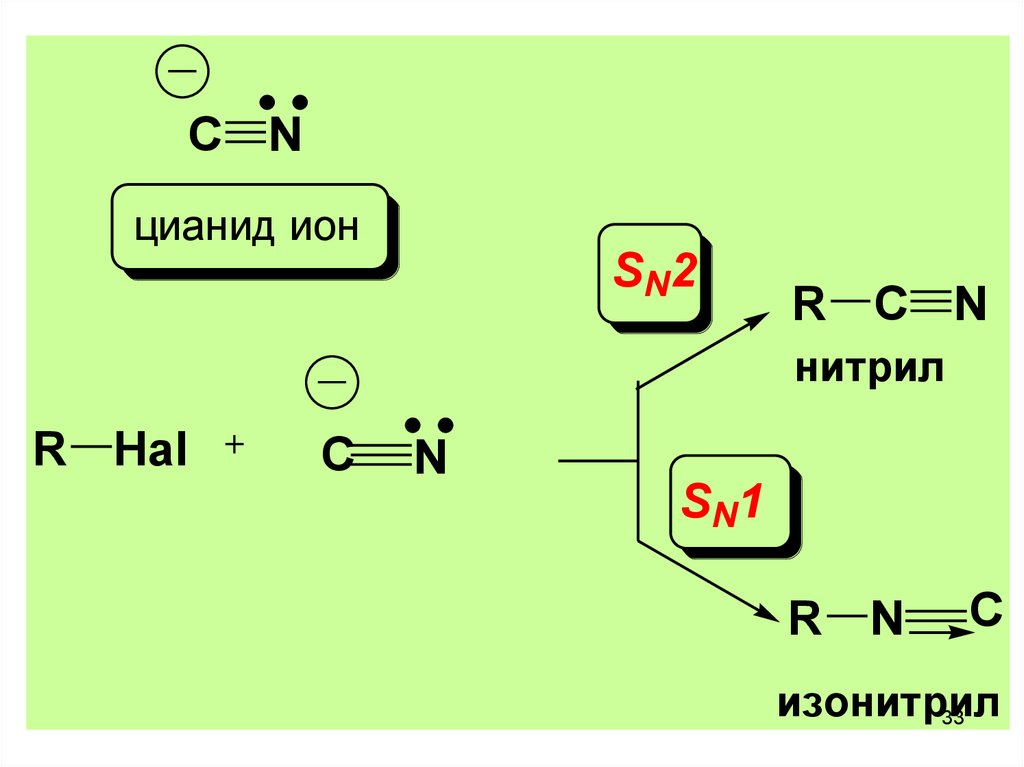
33.
C Nцианид ион
SN2
R C N
нитрил
R Hal
C
N
SN1
R N
C
изонитрил
33
34.
Правило Корнблюма:• В SN2-реакциях атакующим атомом
амбидентного нуклеофила будет
более нуклеофильный атом, а в SN1реакциях – более основный (более
электроотрицательный).
34
35.
Реакции элиминирования✔
α-Элиминирование
✔
β-Элиминирование
✔
γ-Элиминирование
35
36.
Мономолекулярноеэлиминирование Е1
✔Лимитирующей стадией реакции является ионизация субстрата.
Реакционная способность алкилгалогенидов увеличивается в ряду:
первичный < вторичный < третичный.
✔ Реакция
сопровождается
образующихся карбокатионов.
перегруппировками
промежуточно
✔ Реакция подчиняется правилу Зайцева.
36
37.
Бимолекулярноеэлиминирование Е2
✔ Реакция
является
одностадийным
синхронным
процессом.
Реакционная способность алкилгалогенидов увеличивается в ряду:
третичный < вторичный < первичный.
✔ Реакция является стереоспецифической, так как уходящая группа и
протон могут одновременно отщепиться только из анти-конформации.
37
38.
Конкурентность реакций SN и E✔В
более полярных растворителях
протекают реакции нуклефильного
элиминирования
предпочтительнее
замещения, чем
(спиртовой раствор щелочи – реакция элиминирования;
водный раствор щелочи – реакция замещения).
✔ Нуклеофилы, являющиеся сильными основаниями,
направляют реакцию предпочтительнее в сторону
элиминирования по механизму Е2, чем в сторону
нуклеофильного замещения.
✔ Повышение
температуры
элиминирования.
способствует
реакции
38
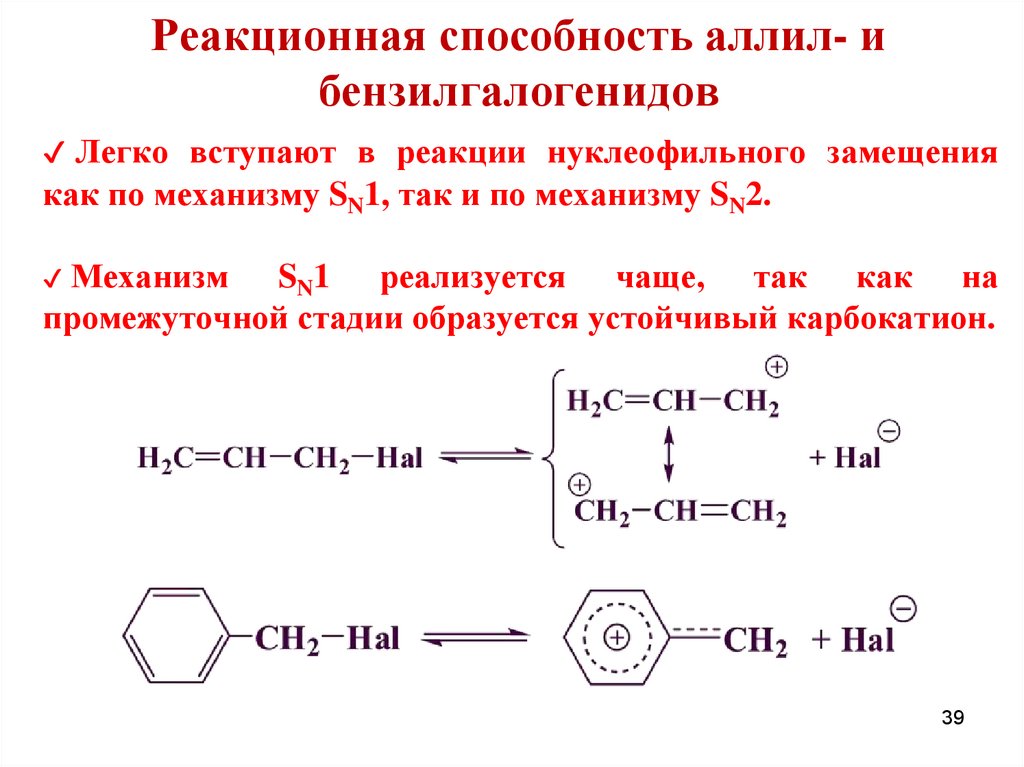
39.
Реакционная способность аллил- ибензилгалогенидов
✔ Легко вступают в реакции нуклеофильного замещения
как по механизму SN1, так и по механизму SN2.
Механизм SN1 реализуется чаще, так как на
промежуточной стадии образуется устойчивый карбокатион.
✔
39
40.
Реакционная способность винил- иарилгалогенидов
✔ Винил- и арилгалогениды содержат атом галогена,
находящийся в сопряжении с кратной связью или
бензольным кольцом, поэтому они устойчивы к
нуклеофильному замещению по механизмам SN1 и SN2.
✔ Арилгалогениды вступают в реакции нуклеофильного
замещения по альтернативным механизмам:
- присоединения-отщепления (SNAr);
- отщепления-присоединения.
40
41.
Ряд активности активированныхарилгалогенидов в зависимости от природы
галогена обращается:
Cl
F
>
NO2
>
NO2
I
Br
>
NO2
NO2
R F << R Cl < R Br < R
I
41
42.
3.РЕАКЦИИГАЛОГЕНПРОИЗВОДНЫХ С
МЕТАЛЛАМИ
• Алкил- и арилгалогениды реагируют
с металлами с образованием
металлоорганических соединений.
Происходит образование связи
углерод-металл.
• Образование литийалкилов:
R
N2
Ha1 + 2Li растворитель R
Li + LiHa1
Литийарилы менее реакционноспособны, чем литийалкилы
42
43.
Li образует ковалентную связь сугдеродом, в то время как Na-производные
в основном ионные соединения. Они очень
реакционноспособны, и реакцию трудно
остановить на стадии образования Naалкилов: образовавшееся Na-органическое
соединение реагирует со второй
молекулой галогенопроизводного по
реакции Вюрца.
43
44.
При переходе от R-Ha1 к Li - и Naорганическим соединениям происходитобращение поляризации атома углерода
от карбокатионного типа к
карбанионному.
Поэтому Li -алкилы и Na-алкилы –
сильнейшие С-основания и Снуклеофилы.
44
45.
Mg-органические галогениды –реактивы Гриньяра ( 1912 г. Нобелевская премия).
C2H5
Br
Mg
C2H5OC2H5
C2H5
MgBr
этилмагнийбромид
Роль диэтилового эфира :
1) эфир растворяет RMgX, удаляя его с поверхности
металла, что способствует протеканию реакции до
конца. Растворение происходит за счёт сольватации
эфиром .
2) Диэтиловый эфир имеет низкую Т.кип. (34,8оС) и
«подушка» паров над раствором защищает RMgX от
окисления О2 воздуха.
Чаще для получения реактивов Гриньяра
используются R-Br, так как R-Cl реагируют вяло, R-I
дают малые выходы. Н- Алкилгалогениды дают
лучшие выходы, чем втор-, а втор- лучшие, чем трет45
алкилгалогениды.
46.
Реакции магнийорганических соединений.• В реактивах Гриньяра связь достаточно
полярна, что определяет карбанионный
характер атома углерода , и позволяет
рассматривать их как нуклеофильные
реагенты.
• 1). Взаимодействие с соединениями,
имеющими подвижный атом водорода.
46
47.
Соединения с подвижным атомом водородаразлагают реактивы Гриньяра с образованием
.
углеводорода и соли магния
H:OH
R Mg Br
H:OR
H:NHR
H:C CH
HO Mg Br
R H
RO
Mg Br
RHN
Mg Br
HC C
Mg Br
Если в реакции используют CH3MgI, образуется
метан. Измеряя его объём, можно
количественно определить соединения с
активным водородом (спирты, амины,
карбоновые кислоты и др.) – метод ЧугаеваЦеревитинова.
47
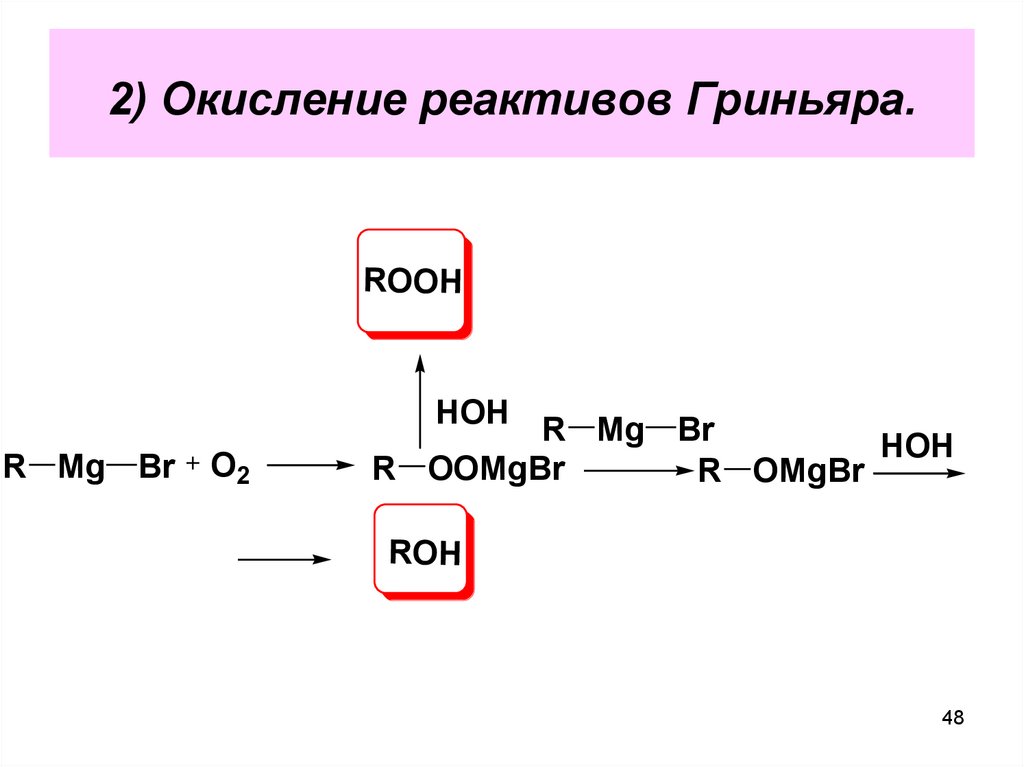
48.
2) Окисление реактивов Гриньяра.ROOH
HOH
R Mg Br
O2
R Mg Br
HOH
R OOMgBr
R OMgBr
ROH
48
49.
3.Присоединение к полярным кратнымсвязям.
H С
R1 С
O
H
O
H
R MgBr
OMgBr
HO
H C R 2
H
R MgBr
R1
O
R MgBr
CH2 R
Mg(OH)Br
первичный спирт
OMgBr
OH
H2O
C R
R1 CH R Mg(OH)Br
H
вторичный спирт
R
R1 C R2
OH
R1 C R2
H2O
OMgBr
R
R1 C R2
Mg(OH)Br
OH
третичный спирт
49




































 chemistry
chemistry








