Similar presentations:
Kлассификация органических соединений. Углеводороды (алканы, алкены, алкины) лекция 1.2
1.
1.Классификация органическихсоединений
2.Углеводороды (алканы,
алкены, алкины)
2.
23.
34.
45.
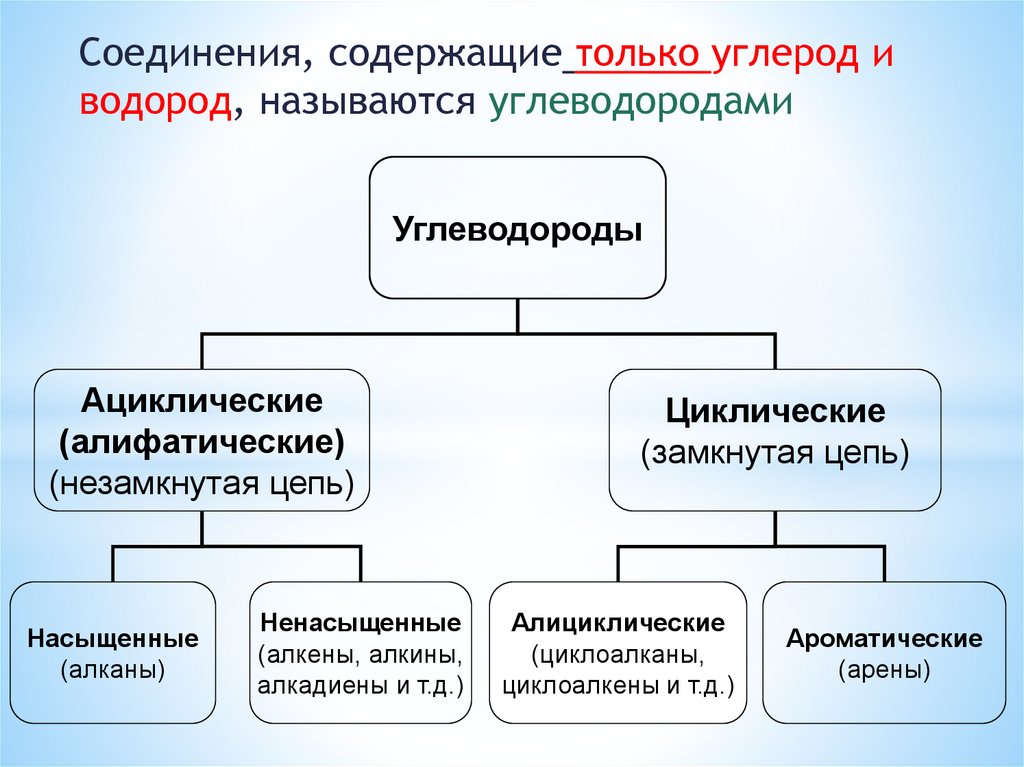
Соединения, содержащие только углерод иводород, называются углеводородами
Углеводороды
Ациклические
(алифатические)
(незамкнутая цепь)
Насыщенные
(алканы)
Ненасыщенные
(алкены, алкины,
алкадиены и т.д.)
Циклические
(замкнутая цепь)
Алициклические
(циклоалканы,
циклоалкены и т.д.)
Ароматические
(арены)
6.
Алканы имеют общую формулуСnH2n+2
Гомологический ряд алканов отличается
от предыдущего на постоянную группу
атомов,
которая
называется
гомологической
разностью:
(-CH2-).
Отдельные алканы этого ряда называются
гомологами.
7.
CH4Метан (первый член гомологического ряда )
CH3 CH3
Этан (второй гомолог)
CH3 CH2 CH3
Пропан (третий гомолог)
CH3 CH2 CH2 CH3
Бутан (четвёртый гомолог)
8.
*CH4 метан*C2H6 этан
*C3H8 пропан
*C4H10 бутан
*C5H12 пентан
*C6H14 гексан
*C7H16 гептан
*C8H18 октан
*C9H20 нонан
*C10H22 декан
*C11H24
*C12H26
*C13H28
*C14H30
*C15H32
*C16H34
*C17H36
*C18H38
*C19H40
*C20H42
ундекан
додекан
тридекан
тетрадекан
пентадекан
гексадекан
гептадекан
октадекан
нонадекан
эйкозан
9.
2. Строение алкановH
109o28'
C
H
H
H
10.
3. Изомерия алканов3.1. Структурная изомерия алканов
Для алканов характерна разновидность
структурной изомерии, называемая
изомерией углеродного скелета.
CH3 CH2 CH2 CH3
CH3 CH CH3
CH3
н-бутан
изобутан
11.
4. Номенклатура алкановЧтобы назвать алкан, необходимо:
1. Найти самую длинную углеводородную цепь.
2. Пронумеровать цепь, начиная с того конца цепи, к
которому ближе находится разветвление.
3. Назвать алкан, перечисляя алкильные заместители,
указывая их количество и положение.
2-метилпропан
12.
мeтилыCH3
CH3
CH3 CH CH CH2 CH CH3
CH2
CH3
этил
2,5-димeтил-3-этилгeксан
13.
5. Физические свойства алкановСН4 до С4Н10 – газы
С5Н12 до С17Н36 – жидкости
последующие члены гомологического ряда –
твердые вещества.
Алканы являются гидрофобными соединениями
14.
6. Химические свойства алканов1.Алканы являются насыщенными
углеводородами, поэтому НЕ вступают в
реакции присоединения.
2. Для реакций алканов характерны реакции
замещения и их радикальный механизм.
Условия проведения радикальных реакций:
высокая температура, действие света и т.д.
15.
6.5. Реакции замещенияГалогенирование
CH4 +
Cl2
метан
CH4
Cl2
h
h
хлор
хлорметан
CH3Cl
HCl
Cl2
h
CH2Cl2
HCl
+
CH3Cl
Cl2
h
хлороводород
h
CHCl3
HCl
HCl
Cl2
CCl4
HCl
16.
Механизм радикального замещения (SR) напримере монохлорирования метана
Реакция галогенирования алканов протекает по радикальному
цепному механизму, т.е. как цепь повторяющихся реакций с участием
свободно-радикальных частиц.
Цепные реакции –
химические реакции,
идущие путем
последовательного
протекания одних и тех же
элементарных стадий.
Н.Н. Семёнов (справа) и П.Л. Капица (слева),
портрет работы Б.М. Кустодиева, 1921
17.
Стадия 1. Инициирование. При облучении хлораУФ светом или при нагревании до 400o образуются атомы
хлора:
h
Cl
Cl
Cl . + . Cl
Стадия 2. Образование и рост цепи
Cl . +
CH4
CH3. + Cl
Cl . +
Cl
CH4
CH3. + Cl
Cl
HCl + CH3.
CH3Cl + Cl .
HCl + CH3.
CH3Cl + Cl .
18.
Стадия 3. Обрыв цепи..
.
C
l
C
l C
l
C
l
.
.
C
H
C
H
C
H
C
H
3
3
3
3
.
.
C
H
C
H
C
l
C
l
3
3
19.
6.2. Дегидрирование алкановПри нагревании алканов в присутствии катализаторов
(Pt, Pd, Ni, Fe, Cr2O3, Fe2O3, ZnO) происходит их
каталитическое дегидрирование :
CH3 CH3
Ni, 500o
CH3 CH2 CH3
CH3 CH2 CH2 CH3
H2C
CH2 + H2
H2C
CH CH3 + H2
CH3 CH CH CH3 + H2
20.
6.1. Реакции окисления алкановCH4 + 2 O2
CO2 + 2 H2O + 802,5 кДж
21.
Частичноеокисление алканов идёт с
разрывом связи C-H или связи С-С.
C H
3
C H
2
C H
2
C H
3
+
3 O
2
бутан
2 C H
3
C O O H
+
уксусная кислота
Получение синтез-газа:
CH4 + H2O
Ni, 800o
CO + 3H2
2 H
2
O
22.
6.4.Крекинг алканов
(англ. cracking – расщепление)
Термический − при температуре 500oС и под давлением
80 атм молекулы алканов расщепляются и образуются
алканы и алкены с меньшим числом атомов углерода.
CH3 CH2 CH2 CH2 CH2 CH3
500o
CH2 CH2 + CH3 CH2 CH2 CH3
CH3 CH CH2 + CH3 CH2 CH3
CH3 CH2 CH CH2 + CH3 CH3
Каталитический− в присутствии катализаторов (обычно
оксиды алюминия и кремния, монтмориллонит –
глинистый минерал) при температуре 450oС и меньшем
давлении.
23.
Межмолекулярное дегидрирование метана(пиролиз метана) используется для
промышленного получения ацетилена:
H CH3
H3C
H
1500o
H C
C
H
+
3 H2
24.
6.3. Изомеризация алкановCH3 CH2 CH2 CH2 CH3
AlCl3, 100o
CH3 CH CH2 CH3
CH3
н-пентан
2-метилбутан
25.
реакция Коновалова)R H +
алкан
HO NO2
150o
азотная кислота
R NO2 +
нитроалкан
H2O
26.
8. Нахождение алканов в природе8.1. Атмосфера планет Юпитера, Сатурна, Урана, Нептуна и
некоторых спутников содержит большое количество метана.
На спутнике Сатурна Титане идут метановые дожди, и есть
метаноёмы
http://science.compulenta.ru/167603/
27.
8.2.Природный газ. Метан является основной составной
частью природного газа. Используется в основном как
топливо.
8.3. Нефть. Пенсильванская и кувейтская нефти содержат в
основном алканы, а бакинская и калифорнийская нефти
содержат в основном нафтены (циклоалканы).
Путём перегонки из нефти получают: бензины, керосин,
дизельное топливо и мазут.
28.
*Применение алканов*Горючее;
*Сырьё для получения сажи и водорода;
*Сырьё для получения непредельных
углеводородов;
*Сырьё для получения растворителей,
хладагентов и лекарственных препаратов.
29.
Ненасыщенные углеводородысодержат
двойные или тройные связи,
которые
могут
насыщаться
водородом
30.
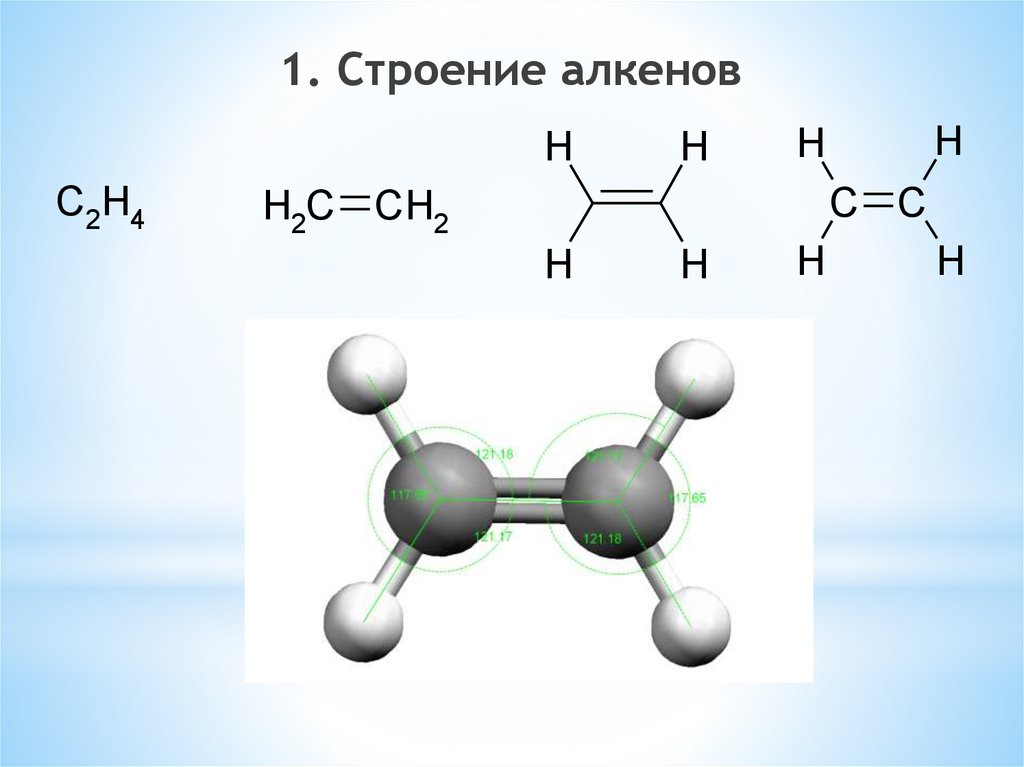
Алкены (олефины, этиленовые углеводороды)– непредельные алифатические
углеводороды, молекулы которых содержат
одну двойную связь
Общая формула гомологического
ряда алкенов
CnH2n
31.
*1669г. Немецкий ученый Иоганн Бехер, нагревая
этиловый спирт с серной кислотой получил
неизвестный ранее газ, названный «газ Бехера».
1795г. Голландский химик И. Дейман подробно
изучил «газ Бехера». Его состав: углерод и
водород, при взаимодействии с хлором
превращается в маслянистую жидкость – 1,2
дихлорэтан. Так произошло название ОЛЕФИНЫ,
что означает МАСЛОРОДНЫЙ.
32.
1. Строение алкеновH
C2H4
H
H
H
C C
H2C CH2
H
H
H
H
33.
* Три sp2-гибридные орбитали участвуют в образовании трёх s-связей:например в этилене:
o
1
2
0
H~
H
oC
C
~
1
2
0
H~
oH
1
2
0
Две негибридные орбитали перекрываются с образованием p-связи:
34.
2. Номенклатура алкеновэтан → этен (этилен)
пропан → пропен (пропилен)
Главная цепь обязательно должна включать в себя
двойную связь, поэтому она может быть и НЕ
самой длинной.
Нумерацию начинают с того конца цепи, который
ближе к двойной связи.
Локант, обозначающий положение двойной связи,
ставится после суффикса -ен.
35.
1H2C
2
CH
3
4
CH2 CH
5
6
CH2 CH3
CH3
*
*
*
4-метилгексен-1
4-метил-1-гексен
4-метилгекс-1-ен (современное название)
36.
3. Изомерия алкенов3.1. Структурная изомерия алкенов
3.1.1
Изомерия углеродного скелета
H2C
CH
CH2 CH3
H2C
C
CH3
CH3
бутен-1
метилпропен
37.
3.1.2 Изомерия положения кратнойсвязи
H3C
CH CH CH3
H2C
CH CH2 CH3
3.1.3 Межклассовая изомерия
H2C
CH
CH2
CH3
H2C
пропен
CH2
циклопропан
38.
39.
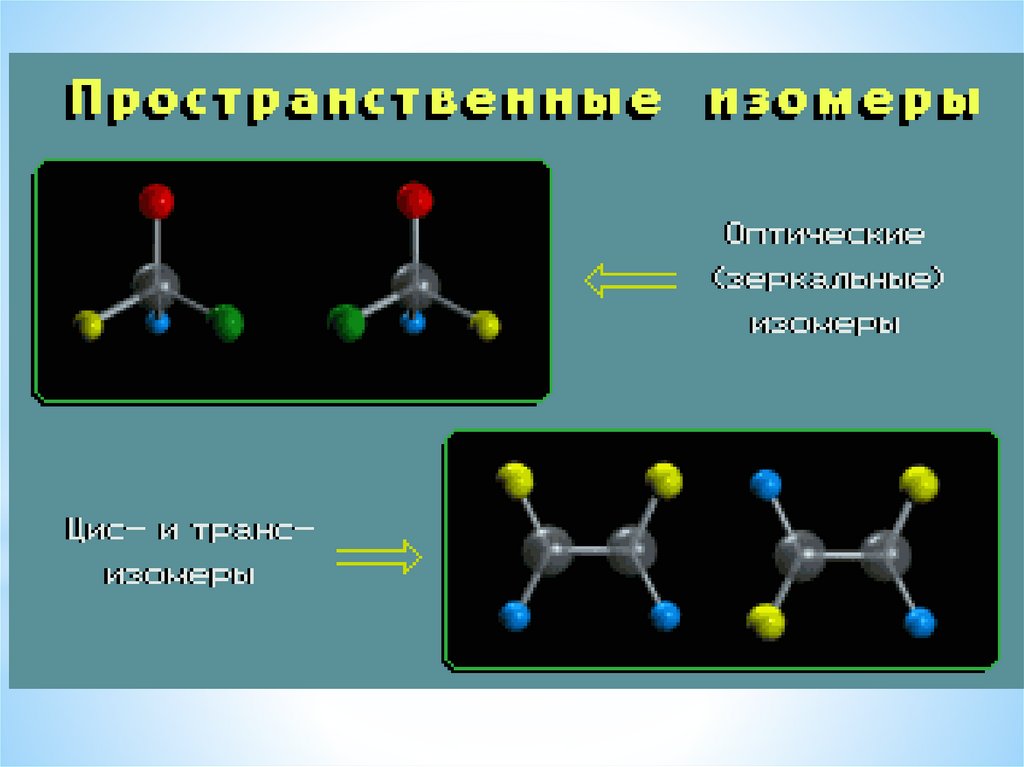
3.2. Пространственная изомерияалкенов
H3C
CH3
C C
H
CH3
H
C C
H
цис-бутен-2
H3C
H
транс-бутен-2
40.
4. Физические свойстваФизические свойства алкенов закономерно изменяются
в гомологическом ряду:
С2Н4 - С4Н8 – газы,
С5Н10 - С17Н34 – жидкости,
с С18Н36 – твердые вещества
• Алкены являются гидрофобными веществами.
Жидкие
запахом.
алкены
обладают
очень
своеобразным
41.
5. Химические свойстваДля алкенов характерны
реакции присоединения:
C C
+
A B
C C
A B
42.
5.1. Реакции присоединения к алкенам5.1.1. Гидрирование (присоединение водорода)
Алкены легко присоединяют водород при нагревании и
повышенном давлении в присутствии катализаторов, например
платины (Фокин, Вильштеттер) или порошкообразного никеля
(Сабатье) с образованием алканов:
H3C
CH CH CH3
+
H2
Ni, t
H3C
CH2 CH2 CH3
При комнатной температуре и обычном давлении алкены присоединяют
водород в присутствии катализатора Уилкинсона – ((C6H5)3P)3RhCl
(за открытие таких катализаторов Дж. Уилкинсон получил Нобелевскую
премию, 1973)
43.
5.1.2. Галогенирование (присоединениегалогенов)
H2C
CH
CH2 CH3
+
Br2
H2C
CH
CH2 CH3
Br Br
бутен-1
1,2-дибромбутан
Быстрое обесцвечивание коричневой окраски
раствора брома в воде (бромной воды) служит
качественной реакцией на наличие кратных
углерод-углеродных связей.
44.
5.1.3. Гидрогалогенирование(присоединение галогеноводородов)
Cl
H2C
CH
пропен
CH3
+
HCl
H3C
CH
CH3
2-хлорпропан
45.
правило Марковникова :При присоединении НХ к
алкенам, водород
присоединяется к более
гидрогенизированному атому
углерода при двойной связи
Cl
H2C
CH
CH3
+
HCl
H3C
CH
CH3
46.
5.1.4.Гидратация (присоединениеводы)
+
H2C CH2
+
H2O
H
H2C
CH3
OH
этилен
этанол
(этиловый спирт)
47.
5.2. Полимеризация алкеновПолимеризация – реакция образования
полимеров, то есть соединений, молекулы
которых состоят из большого числа
повторяющихся звеньев.
n H2C
CH2
H2C
CH2
Полиэтилен
Полиэтилен применяется в производстве пленок,
труб, емкостей, технических волокон и многого
др.
n
48.
*Отходы полиэтилена и его производные
отрицательно влияют на окружающую среду,
отравляя природу продуктами сгорания,
вызывают гибель животных (например, зубатых
китов и др.) при попадании полиэтилена внутрь
организма, не разлагаются почвенными
бактериями.
49.
Условия синтеза: 1500 атм, 200o , при использованиикатализатора Циглера-Натта (TiCl4, Al(C2H5)3):
атмосферное давление и температура 60-70o
(Циглер,1955, Нобелевская премия, 1963).
n H2C
CH
H2C CH
CH3
CH3
полипропилен
Полипропилен применяется в производстве
полипропиленового волокна и пленок.
n
50.
Полифторэтилен (фторпласт-4, фторлон-4,тефлон), является продуктом полимеризации
тетрафторэтилена:
n F2C
CF2
CF2 CF2
n
Тефлон является хорошим диэлектриком, очень
устойчив к действию окислителей, щелочей, кислот,
органических
растворителей.
Применяется
в
производстве
изделий
электротехнической,
радиотехнической и химической промышленности.
51.
Поливинилхлорид (ПВХ) получаютполимеризацией хлорэтилена (винилхлорида):
n H2C
CH
H2C CH
Cl
На основе поливинилхлорида получают:
• пластмассы,
• пластизоли,
• поливинилхлоридное волокно.
Cl
n
52.
5.3. Реакции окисления алкеновH2C
CH2
KMnO4 OH-MnO2
H2C
CH2
HO
OH
этилен
H3C HC
CH CH3
этиленгликоль
KMnO4 H+
-Mn2+
O
O
H3C
C
C
+
OH
HO
CH3
53.
54.
*• ускоренное созревание плодов,
• изготовление разовой посуды,
• синтетического каучука,
• антифризов,
• взрывчатых веществ,
• пластмасс,
• растворителей,
• пакетов, полиэтиленовой пленки,
• получение горючего.
55.
*1.В гомологическом ряду алкенов нормального строения
четвертый по счету гомолог называется:
а) бутен; б) пентен; в) гексен; г) гептен.
2.Укажите формулу пентена-2:
а)CH3─CH═CН─CH3;
б) CH2═ CH─CН2─CH3;
в) СН2═ СН─СН2─СН2 ─СН3;
г) CH3─CH═CН─СН2─CH3.
3. Пропен из пропилового спирта СН3─СН2─СН2─ОН можно
получить в результате
реакции:
а) дегидрирования; б) дегидратации;
в) гидрирования;
г) гидратации.
56.
*4. Качественной реакцией на непредельные углеводороды
является:
а) реакция горения;
б) взаимодействие с водородом;
в) реакция гидратации;
г) обесцвечивание бромной воды.
5. Этилен можно получить из этана в результате реакции:
а) дегидрирования;
б) дегидратации;
в) гидрирования;
г) гидратации.
57.
*1.В гомологическом ряду алкенов нормального строения
четвертый по счету гомолог называется:
б) пентен;
2.Укажите формулу пентена-2:
г) CH3─CH═CН─СН2─CH3.
3. Пропен из пропилового спирта СН3─СН2─СН2─ОН можно
получить в результате
реакции:
б) дегидратации;
4. Качественной реакцией на непредельные углеводороды
является:
г) обесцвечивание бромной воды.
5. Этилен можно получить из этана в результате реакции:
а) дегидрирования.
58.
АЛКИНЫнепредельные алифатические углеводороды,
молекулы которых содержат тройную связь .
Общая формула алкинов
СnH2n-2
59.
1. Номенклатура алкиновэтан → этин
пропан → пропин
Нумерацию углеродных атомов начинают с того
конца, к которому ближе тройная связь.
CH3
1
2
3
4
H3C
C
C
CH2 CH2 CH CH3
5
6-метилгептин-2
6
7
60.
Главная цепь обязательно должна включать всебя тройную связь
1
H3 C
2
3
C
C
4
C H
5
C H
C H
2
6
C H
2
7
C H
2
8
C H
3
4-пропилоктин-2
2
C H
2
C H
3
61.
2. Изомерия алкинов2.1. Структурная изомерия
2.1.1. Изомерия углеродного скелета:
CH3
CH3
H3C
C
C
CH2 CH2 CH2 CH3
гептин-2
H3C
C
C
CH CH2 CH3
H3C
4-метилгексин-2
C
C
CH2 CH CH3
5-метилгексин-2
2.1.2. Изомерия положения тройной связи
H3C
C
C
бутин-2
CH3
HC
C CH2 CH3
бутин-1
62.
2.1.3. Межклассовая изомерияАлкины изомерны алкадиенам, циклоалкенам,
бициклоалканам и спироалканам, то есть с соединениям,
имеющими ту же общую формулу СnH2n-2
H3C
C
C
CH2 CH3
H3C HC
CH CH CH2
2. Пространственная изомерия
Цис-транс изомерия в молекулах алкинов невозможна, т.к.
заместители при тройной связи могут располагаться только одним
способом – вдоль линии связи
63.
3. Строение алкиновC
H
2
2
H
C
C
H
H
H
64.
* Молекула ацетилена содержит атомы углерода в состоянии spгибридизации1 8 0
H
C
C
o
H
За счёт гибридных орбиталей образуют связи с атомами водорода и s-связь
между атомами углерода:
x
Негибридные p-орбитали перекрываются, образуя две p-связи:
H
C
C
H
H H
65.
4. Физические и биологические свойстваС2Н2-С4Н6 газы,
С5Н8-С16Н30 – жидкости,
начиная с С17Н32 – твердые вещества
Алкины
являются гидрофобными соединениями и поэтому
хорошо растворяются в органических растворителях
и
плохо растворимы в воде.
Низшие
алкины обладают наркотическим эффектом;
ацетилен использовался для ингаляционного наркоза под
названием нарцилен. Ацетилен также вызывает ускорение
созревания плодов.
66.
5. Химические свойства5.1. Образование металлоорганических соединений –
ацетиленидов
H3C
C
C
пропин
H
C
C
H
H + NaNH2
амид натрия
+
2 Cu(NH3)2OH
H3C
+
C Na
C
пропинид натрия
Cu
C
C
+
NH3
аммиак
Cu
+ 4NH3 + 2H2O
aцетиленид меди(I)
Образование красно-коричневого осадка ацетилена меди при добавлении
алкина в аммиачный водный раствор хлорида меди(I) является качественной
реакцией на концевую тройную связь
67.
5.2. Реакции присоединения к алкинам5.2.1. Гидрирование – присоединение
водорода.
H3C
C
C
CH3
бутин-2
H2 Ni, t
H3C HC
CH CH3
бутен-2
H2 Ni, t
H3C CH2 CH2 CH3
бутан
68.
*Гидрирование (в присутствии металлическихкатализаторов – Pt, Pd, Ni):
CH ––– C – CH3
|
|
+
H – H
пропин
CH2 –
– CH – CH3
|
|
пропен
CH2 = CH – CH3
пропен
+
H – H
CH3 – CH2 – CH3
пропан
69.
5.2.2. Присоединение галогеновH3C
C
C
CH3
Br2
H3C
C
C
CH3
Br
Br2
H3C C
Br Br
бутин-2
Br
Br
C
CH3
Br
2,3-дибромбутен-2
2,2,3,3-тетрабромбутан
70.
Галогенирование:–
CH –
– C – CH3
|
|
пропин
Br
Br
|
|
CH –
– C – CH3
|
|
1,2-дибромпропен
+
+
Br – Br
Br– Br
Br
Br
Br
1|
2|
3
CH = C – CH3
1,2-дибромпропен
(1,2-дибромпропилен)
Br
Br
1|
2|
3
CH – C – CH3
|
|
Br
Br
1,1,2,2,-тетрабромпропан
I стадия
II стадия
Реакция с бромной водой – качественная
реакция на
алкины (бромная вода обесцвечивается).
71.
5.2.3. Гидрогалогенирование –присоединение галогеноводородов
(HCl, HBr, HI)
Cl
H3C
C
C
H
HCl
H3C
C
CH2
Cl
пропин
2-хлорпропен
HCl
H3C
C
CH3
Cl
2,2-дихлорпропан
72.
5.2.4. Гидратация – присоединение воды(реакция Кучерова)
H
C
C
H + H2O
HgSO4
O
H2C
C
H
H3C
C
H
OH
виниловый спирт
H
C
C
CH3 + H2O
HgSO4
H2C
C
CH3
OH
пропин
пропенол-2
этаналь
H3C
C
CH3
O
ацетон
73.
Гидратация:|
CH3 – C –
OH
– C – H + H –OH
|
пропин
OH
|2
3
1
–
–
CH3 C C – H
|
H
(пропенол-2)
вторичный пропенол
–
этин
–
|
–
H– C –
– C – H + H – OH
|
OH
|
H – C– C – H
|
H
этенол
(виниловый спирт)
H O
|
//
H – C– C
|
\
H
H
этаналь
O
||
CH3 – C – CH3
пропанон
диметилкетон
74.
5.3. ПолимеризацияАцетилен димеризуется под действием водно-аммиачного раствора CuCl,
при этом образуется винилацетилен (Ньюленд):
H
C
C
H
+
H
C
C
H2C
H
CH
C
CH
винилацетилен
H2C
CH
C
CH + HCl
H2C
CH
C
CH2
Cl
хлоропрен
75.
* При пропускании ацетилена через раскаленные стеклянныетрубки происходит его тримеризация и образуется бензол
(Бертло):
H
C
H
H
H
C
C
C
C
C
H
H
H
H
H
C
C
C
C
C
C
H
H
H
при использовании Ni(CO)3·P(C6H5)3 и Ni(CO)2·2P(C6H5)3 процесс идёт под
давлением 15 атм и при температуре всего 60-70oC (Реппе).
76.
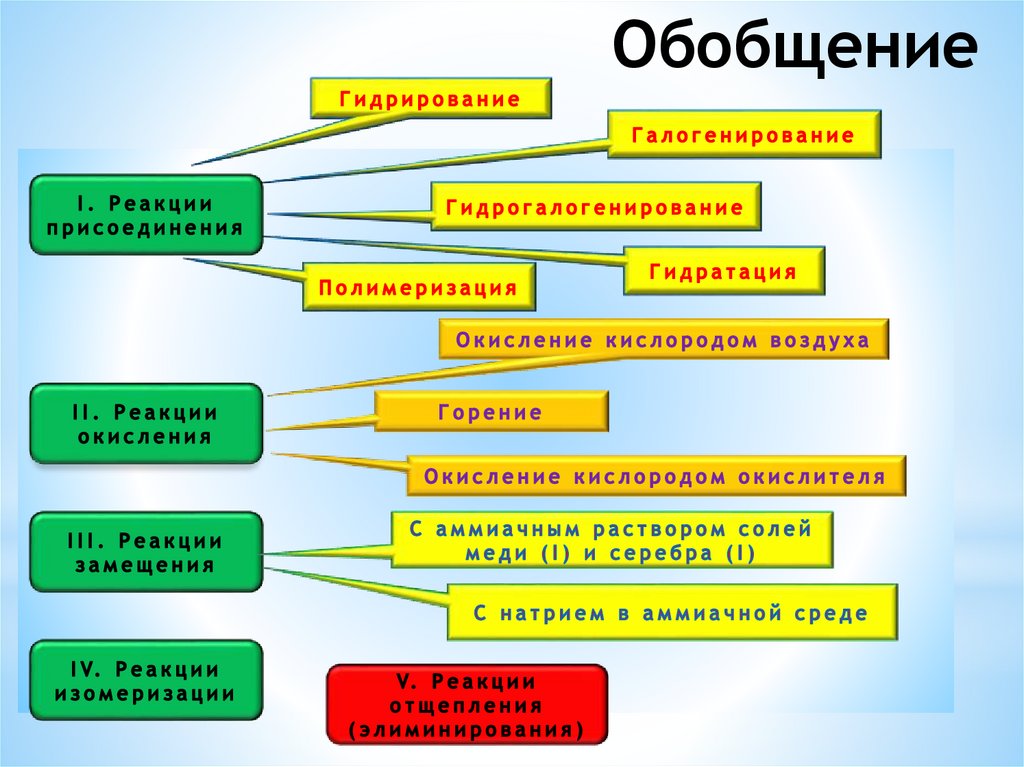
Обобщение77.
Обобщение78.
*Этиленовые и ацетиленовые углеводороды
отличаются от предельных по составу,
строению и свойствам.
79.
АлканАлкен
Алкин
80.
1.Классификация органическихсоединений
2.Углеводороды (алканы,
алкены, алкины)












































































 chemistry
chemistry








