Similar presentations:
Первый закон термодинамики
1.
2.
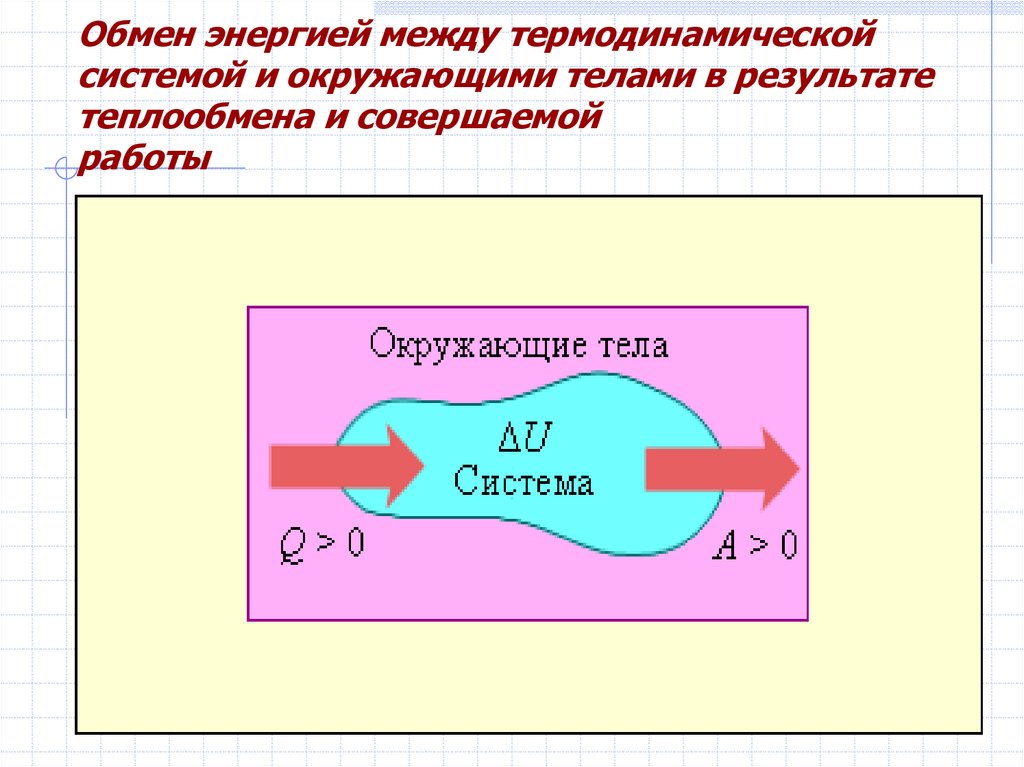
Обмен энергией между термодинамическойсистемой и окружающими телами в результате
теплообмена и совершаемой
работы
3.
Первый законтермодинамики
Количество теплоты сообщенное
системе расходуется на изменение ее
внутренней энергии и совершение
системой работы против внешних сил.
Q=ΔU + A
4.
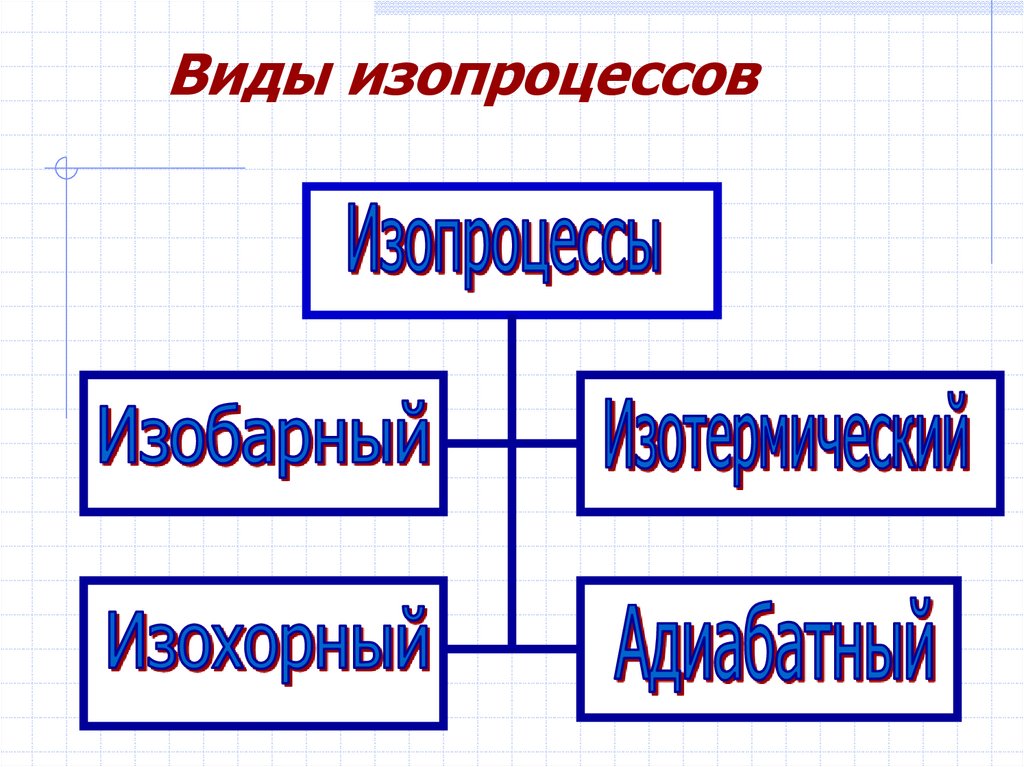
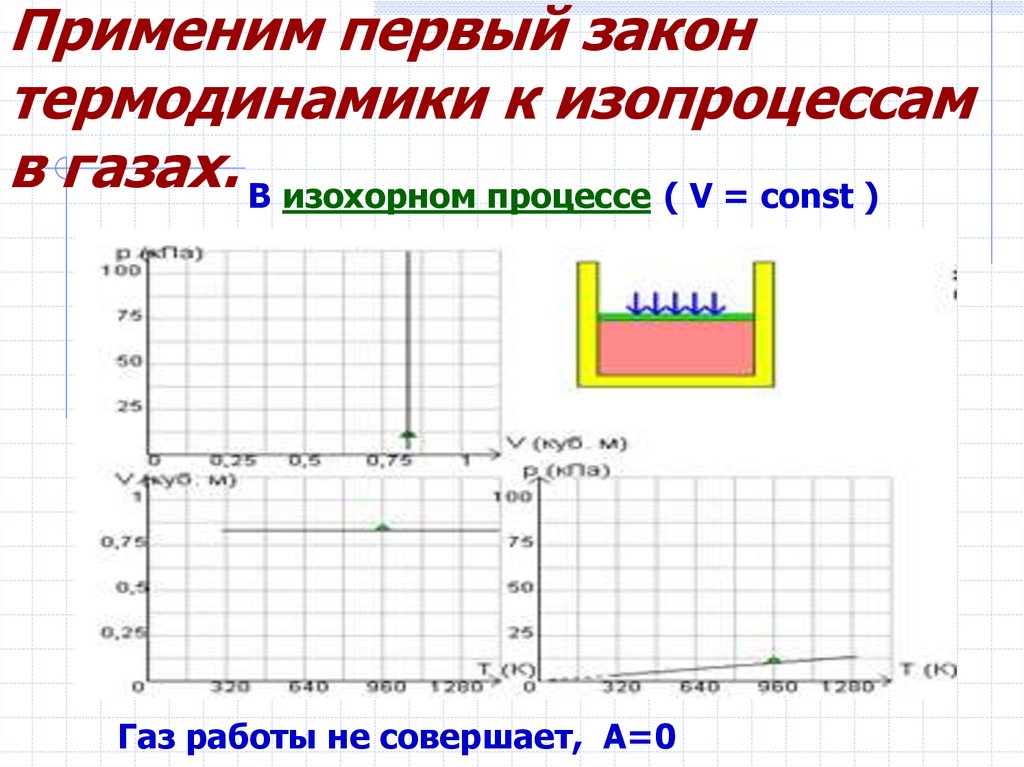
Виды изопроцессов5. Применим первый закон термодинамики к изопроцессам в газах.
В изохорном процессе ( V = const )Газ работы не совершает, А=0
6.
Первый законтермодинамики для
изохорного процесса
Q = ΔU = U (T2) – U (T1)
Здесь U (T1) и U (T2) – внутренние энергии
газа в начальном и конечном состояниях.
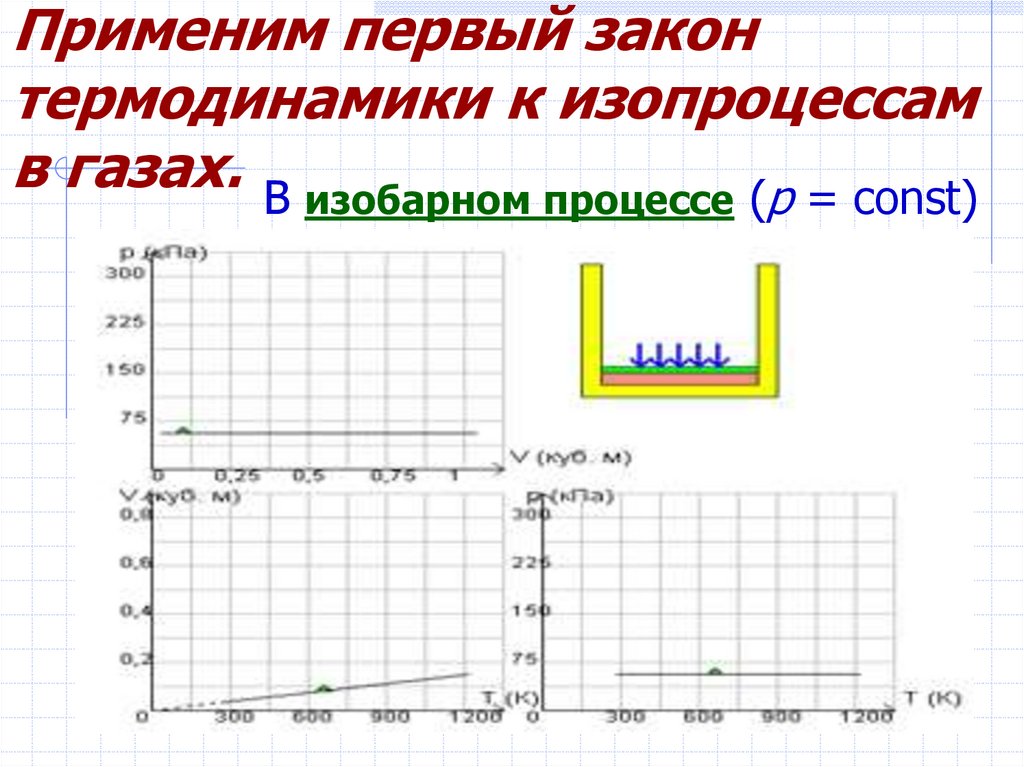
7. Применим первый закон термодинамики к изопроцессам в газах.
В изобарном процессе (p = const)8.
Работа, совершаемая газом,выражается соотношением
p-давление
V1,V2- объем в начальном и конечном
состояниях соответственно
A = p (V2 – V1) = p ΔV
9. Применим первый закон термодинамики к изопроцессам в газах.
Первый закон термодинамики дляизобарного процесса :
Q = U (T2) – U (T1) + p (V2 –
V1) = ΔU + p ΔV
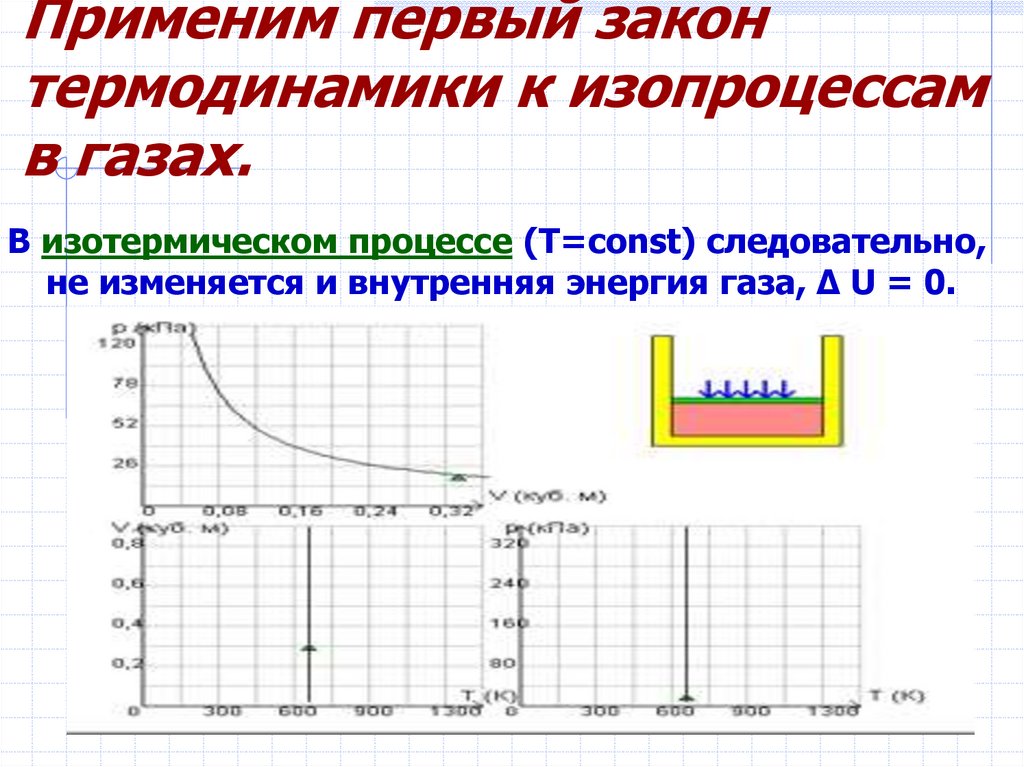
10. Применим первый закон термодинамики к изопроцессам в газах.
В изотермическом процессе (T=const) следовательно,не изменяется и внутренняя энергия газа, Δ U = 0.
11.
Первый закон термодинамикидля изотермического процесса
выражается соотношением
Q=A
Количество теплоты Q, полученной газом в
процессе изотермического расширения,
превращается в работу системы против внешних
сил.
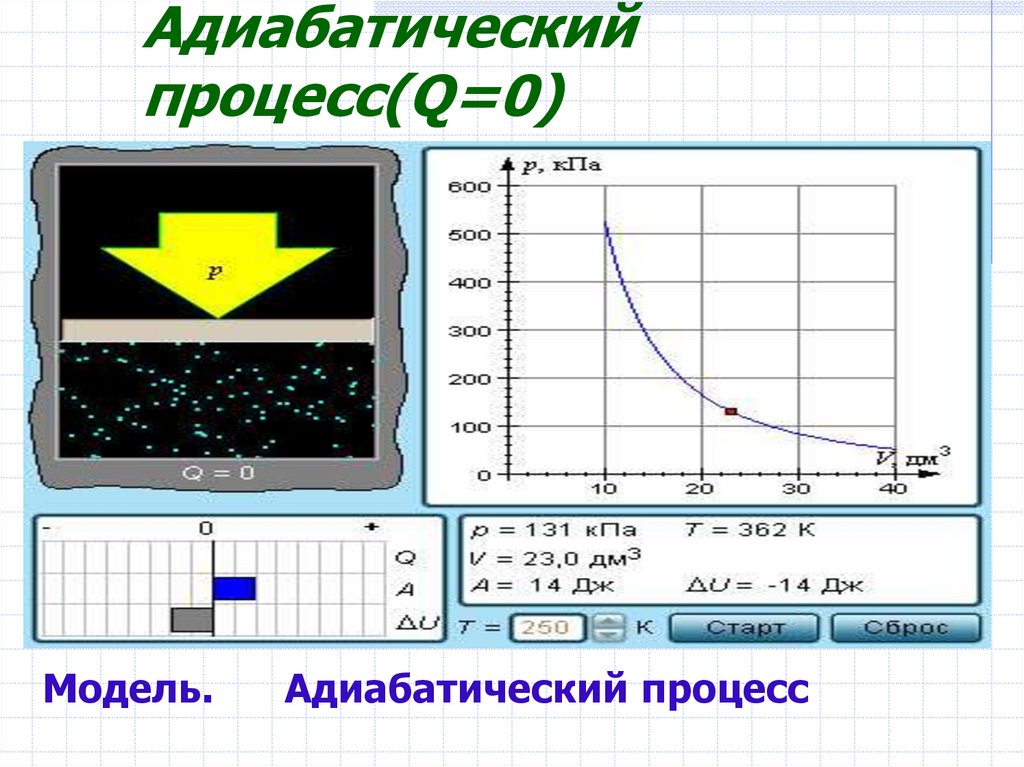
12. Адиабатический процесс(Q=0)
Модель.Адиабатический процесс
13.
В адиабатическом процессеQ = 0; поэтому первый
закон термодинамики
принимает вид
A = –ΔU
газ совершает работу за счет убыли его
внутренней энергии.
14. Семейства изотерм (красные кривые) и адиабат (синие кривые) идеального газа
(A > 0) (Δ U < 0)15.
Работа газа в адиабатическомпроцессе просто выражается
через температуры T 1 и T 2
начального и конечного
состояний
CV – теплоемкость при постоянном объеме газа
A = CV (T2 – T1)
16.
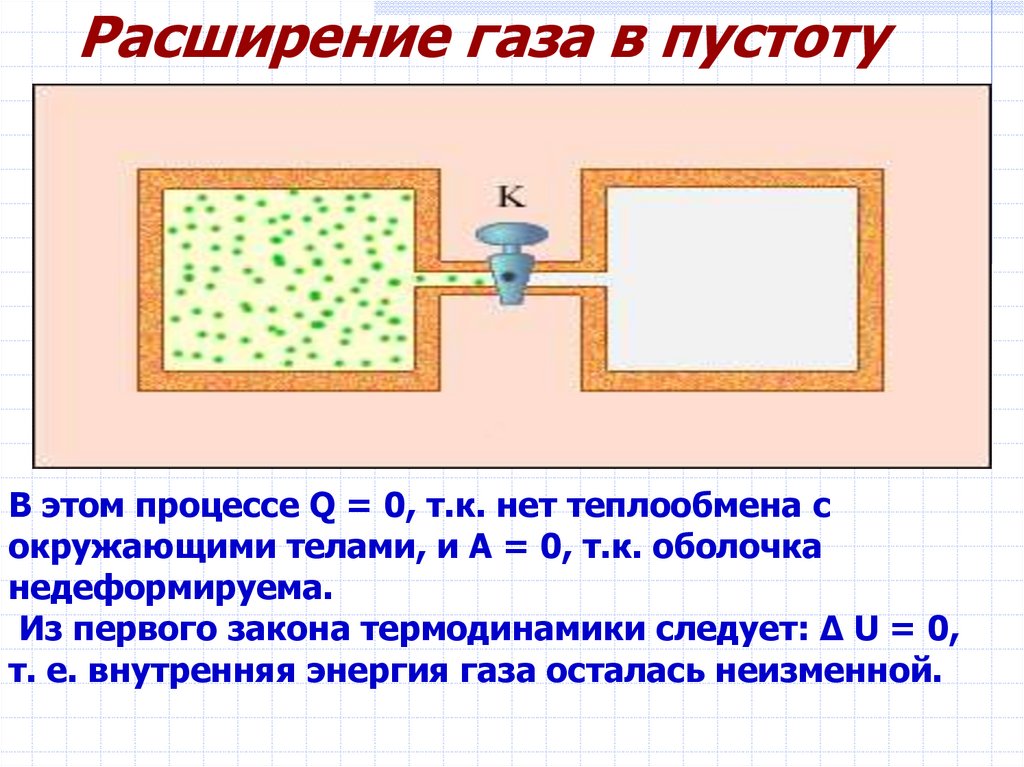
Расширение газа в пустотуВ этом процессе Q = 0, т.к. нет теплообмена с
окружающими телами, и A = 0, т.к. оболочка
недеформируема.
Из первого закона термодинамики следует: Δ U = 0,
т. е. внутренняя энергия газа осталась неизменной.









 physics
physics








