Similar presentations:
Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление )
1. Тема урока: Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление и). Принцип Ле
Шателье.Роль смещения химического равновесия в
увеличении выхода продукта в химической
промышленности
Л. О. №1 Смещение химического равновесия при изменении
концентрации реагирующих веществ
2.
Состояние химического равновесияобратимой реакции сохраняется при
неизменных условиях (концентрация,
температура и давление), но стоит
только хотя изменить хотя бы одно из
условий протекания реакции, как
равновесие быстро перейдет в другое
состояние, соответствующее новым
условиям.
3. Переход реакции из одного равновесного состояния в другое равновесное состояние, отвечающее изменившимся условиям, называют
смещениемравновесия
4. Принцип Ле Шателье
Если изменить одно из условий, прикоторых реакция находится в состоянии
равновесия (концентрация,
температура или давление), то
равновесие сместится в направлении
той реакции, которая сместится в
направлении той реакции, которая
противодействует этому изменению
5. Ле Шателье Анри Луи
(1850 - 1936)Французский физикохимик и
металловед. Сформулировал
(1884) общий закон смещения
термодинамического
равновесия (принцип Ле
Шателье). Исследовал
процессы, происходящие при
высоких температурах,
металлические сплавы,
сконструировал
металлографический
микроскоп
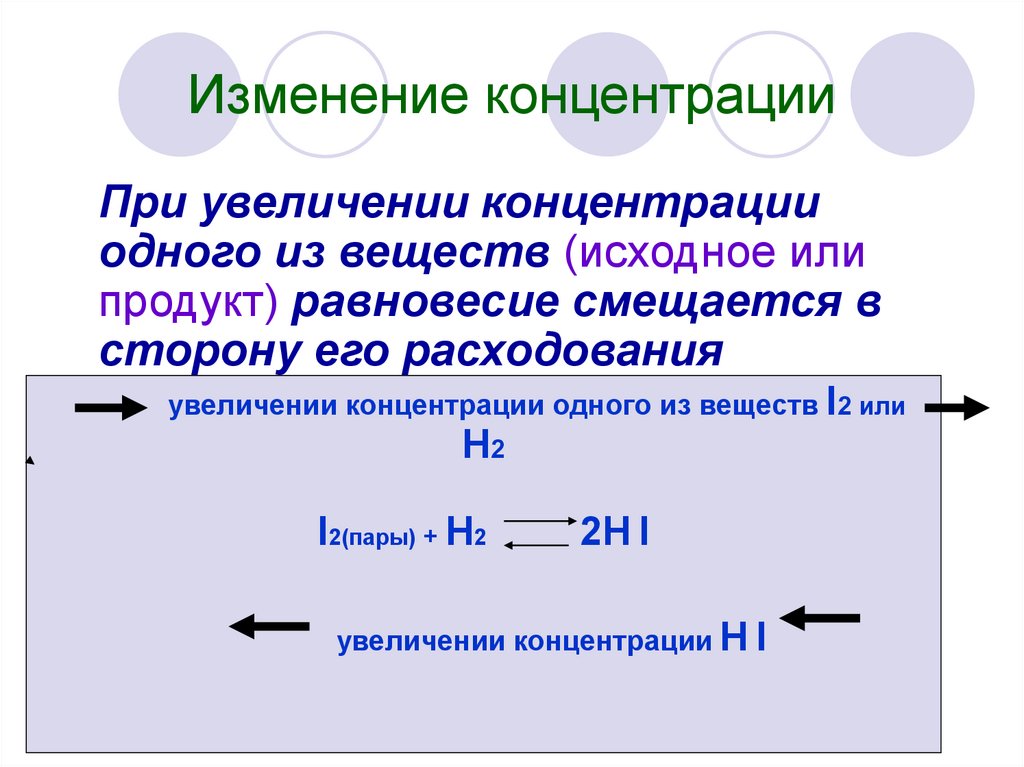
6. Изменение концентрации
При увеличении концентрацииодного из веществ (исходное или
продукт) равновесие смещается в
сторону его расходования
увеличении концентрации одного из веществ I2 или
H2
I2(пары) + H2
2H I
увеличении концентрации H I
7. Изменение концентрации
При уменьшении концентрациивещества равновесие смещается в
сторону его образования
уменьшение концентрации
I2(пары) + H2
IH
2IH
уменьшение концентрации
I2 или H2
8. В обратимых гетерогенных реакциях введение дополнительной массы твердого вещества не влияет на состояние равновесия
tCaCO3(тв.)
СaO(тв.) + CO2 (г)
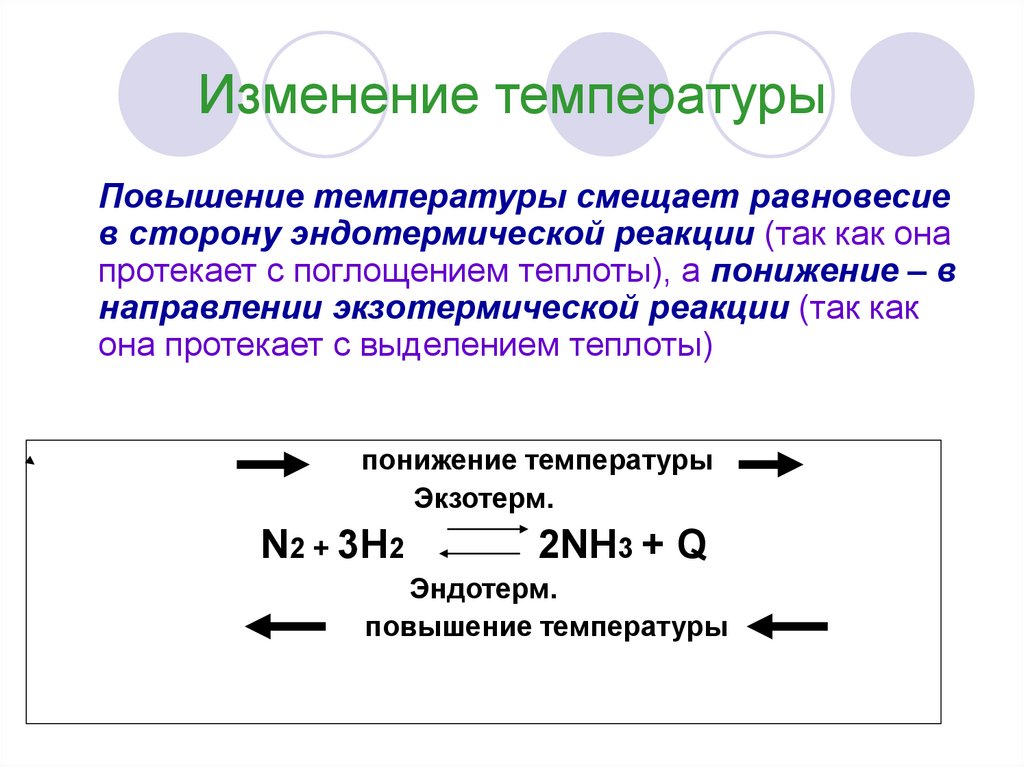
9. Изменение температуры
Повышение температуры смещает равновесиев сторону эндотермической реакции (так как она
протекает с поглощением теплоты), а понижение – в
направлении экзотермической реакции (так как
она протекает с выделением теплоты)
понижение температуры
Экзотерм.
N2 + 3H2
2NH3 + Q
Эндотерм.
повышение температуры
10. Изменение давления
Сжимаемы только газообразныевещества, поэтому изменением
давления можно смещать равновесие в
реакциях, где хотя бы одно
вещество находится в
газообразном состоянии и
изменяется число молекул
газообразных веществ
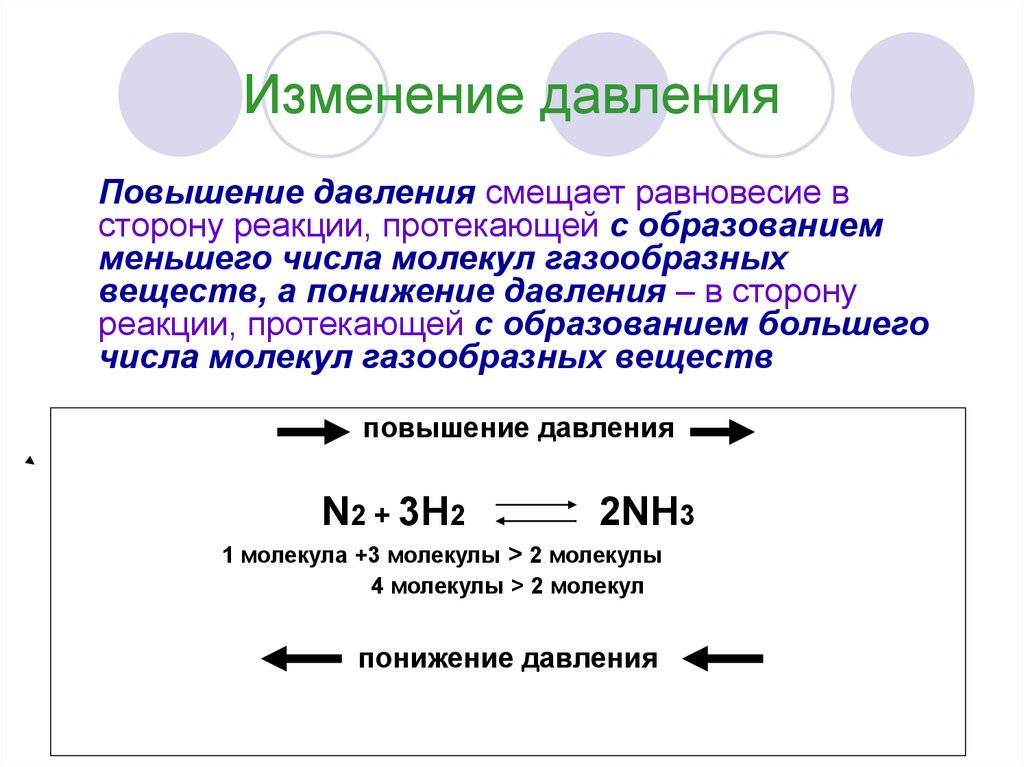
11. Изменение давления
Повышение давления смещает равновесие всторону реакции, протекающей с образованием
меньшего числа молекул газообразных
веществ, а понижение давления – в сторону
реакции, протекающей с образованием большего
числа молекул газообразных веществ
повышение давления
N2 + 3H2
2NH3
1 молекула +3 молекулы > 2 молекулы
4 молекулы > 2 молекул
понижение давления
12. Изменение давления
Если реакция протекает без изменениячисла молекул газообразных веществ, то
изменение давления не влияет на
состояние равновесия этой системы,
так как давление в системе не изменяется
I2(пары) + H2
1 молекула +1 молекулы
2 молекулы
2IH
=
2 молекулы
= 2 молекул
13. Введение катализатора
Введение в реакцию катализатора невлияет на состояние химического
равновесия, так как катализатор снижает
энергию активации прямой и обратной
реакций на одну и туже величину,
следовательно он в одинаковой степени
изменяет скорость как прямой, так и обратной
реакции. Катализатор только ускоряет
достижение химического равновесия
14. Роль смещения химического равновесия в увеличении выхода продукта в химической промышленности
15.
Применение принципаЛе Шателье к обратимым
химическим реакциям
позволяет управлять
химическими процессами
16.
Производство серной кислотыконтактным способом
Химизм производства серной кислоты состоит
из трех стадий:
1)Получение оксида серы (IV);
2)Каталитического окисления оксида серы (IV)
до оксида серы (VI);
3)Образование серной кислоты из оксида серы
(VI)
17. Рассмотрим вторую стадию получения серной кислоты: Каталитическое окисление оксида серы (IV) до оксида серы (VI)
2SO2 + O22SO3 + Q
Реакция между оксида серы (IV) и
кислородом экзотермическая и
равновесная.
Задание: В соответствии с принципом Ле
Шателье смещению равновесия в
сторону образования SO3
способствует:
Правильные ответы:
а) повышение температуры;
б) понижение температуры;
в) понижение давления;
г) повышение давления
18. Рассмотрим Производство аммиака
N2 + 3H22NH3 + Q
Реакция синтеза NH3
экзотермическая, обратимая и
протекает с уменьшение объема
Задание: В соответствии с принципом Ле
Шателье смещению равновесия в
сторону образования NH3
способствует:
Правильные ответы:
а) повышение температуры;
б) понижение температуры;
в) понижение давления;
г) повышение давления
19. Л. О. №1 Смещение химического равновесия при изменении концентрации реагирующих веществ
Влияние изменения концентрацииреагирующих веществ на химическое
равновесие исследуем на примере
реакции между хлоридом железа (III) и
роданитом калия:
FeCL3 + 3KSCN
Fe(SCN)3 + 3 KCL
3+
Fe + 3SCN
Fe(SCN)3
20. Л. О. №1 Смещение химического равновесия при изменении концентрации реагирующих веществ
Красное окрашивание роданида железа(III) позволяет следить за сдвигом
химического равновесия при изменении
концентрации реагирующих веществ.
21. Описание опыта №1 Смещение химического равновесия при изменении концентрации реагирующих веществ
1. Смешайте приблизительно по 3 см 0,5 - 1 % ныйраствор хлорида железа(III) и радонида калия
2. Разлейте полученный раствор по четырем пробиркам
3. В первую пробирку добавьте 2-3 капли
концентрированного раствора хлорида железа(III);
во вторую - 2-3 капли концентрированного радонида калия;
в третью насыпьте немного твердого хлорида калия и
встряхните пробирку несколько раз, чтобы ускорить
растворение соли
4. Сравните окраску растворов в этих трех пробирках с
окраской исходного раствора в четвертой пробирке
22.
Л. О. №1 Смещение химического равновесия при измененииконцентрации реагирующих веществ
Напишите выражение для константы химического
равновесия данной реакции.
Укажите, как изменилась концентрация роданида
железа (III) в каждой из трех пробирок, и объясните
происходящие изменения, исходя из принципа Ле
Шателье.
Укажите направление смещения
равновесия, а также оформите результаты
согласно предложенной таблице:
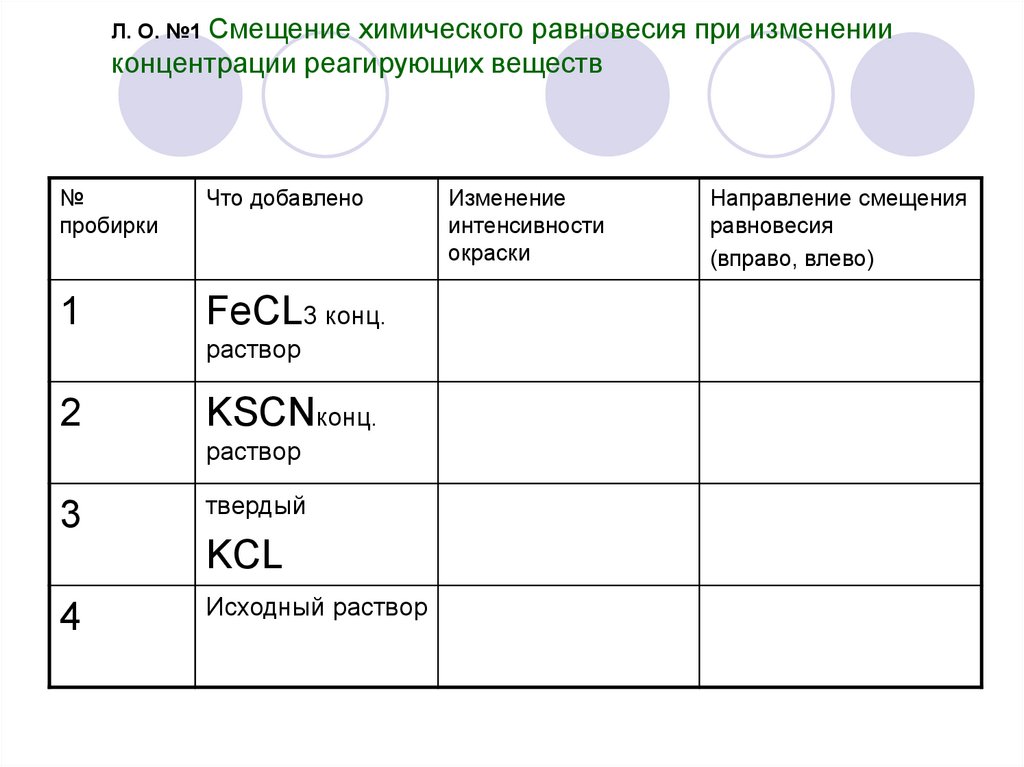
23. Л. О. №1 Смещение химического равновесия при изменении концентрации реагирующих веществ
№пробирки
Что добавлено
1
FeCL3 конц.
раствор
2
KSCNконц.
раствор
3
твердый
KCL
4
Исходный раствор
Изменение
интенсивности
окраски
Направление смещения
равновесия
(вправо, влево)




















 chemistry
chemistry








