Similar presentations:
Комплексные соединения. (Лекция 7)
1.
ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙУНИВЕРСИТЕТ
КАФЕДРА ХИМИИ
Лекция 7
Комплексные соединения
1. Строение комплексных соединений. Классификация. Номенклатура.
2. Устойчивость комплексных соединений.
3. Изомерия.
4. Комплексоны. Хелаты. Краун-эфиры.
Лектор: Степанова Ирина Петровна, доктор
биологических наук, профессор, зав. кафедрой химии
2.
ЦЕЛИ ЛЕКЦИИОБУЧАЮЩАЯ: сформировать знания о
координационной теории строения,
классификации, номенклатуре, изомерии и
устойчивости комплексных соединений.
РАЗВИВАЮЩАЯ: расширить кругозор
обучающихся на основе интеграции знаний, развить
логическое мышление.
ВОСПИТАТЕЛЬНАЯ: содействовать формированию
у обучающихся устойчивого интереса к изучению
дисциплины.
3.
Медико-биологическое значение темы[Ni(CO)4]
[Fe(C5H5)2]
4. Они связывают катионы металлов в различные биологически важные комплексные соединения. Пример: Порфирины - азотосодержащие пигменты, вход
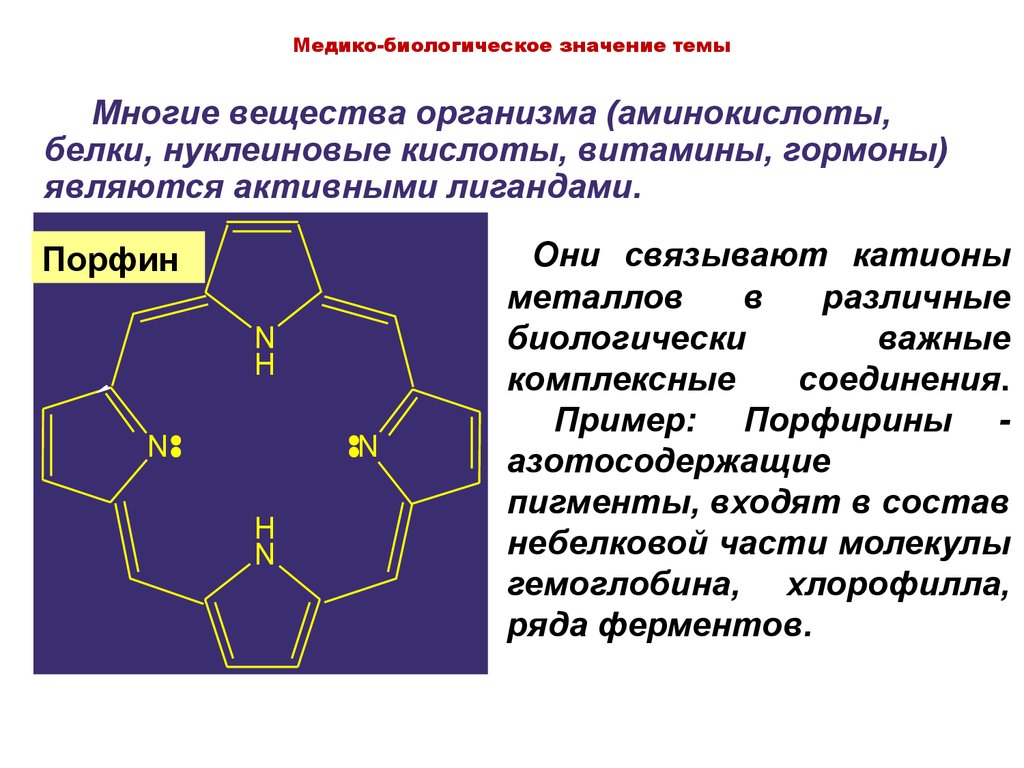
Медико-биологическое значение темыМногие вещества организма (аминокислоты,
белки, нуклеиновые кислоты, витамины, гормоны)
являются активными лигандами.
Порфин
N
H
N
N
H
N
Они связывают катионы
металлов
в
различные
биологически
важные
комплексные
соединения.
Пример: Порфирины азотосодержащие
пигменты, входят в состав
небелковой части молекулы
гемоглобина, хлорофилла,
ряда ферментов.
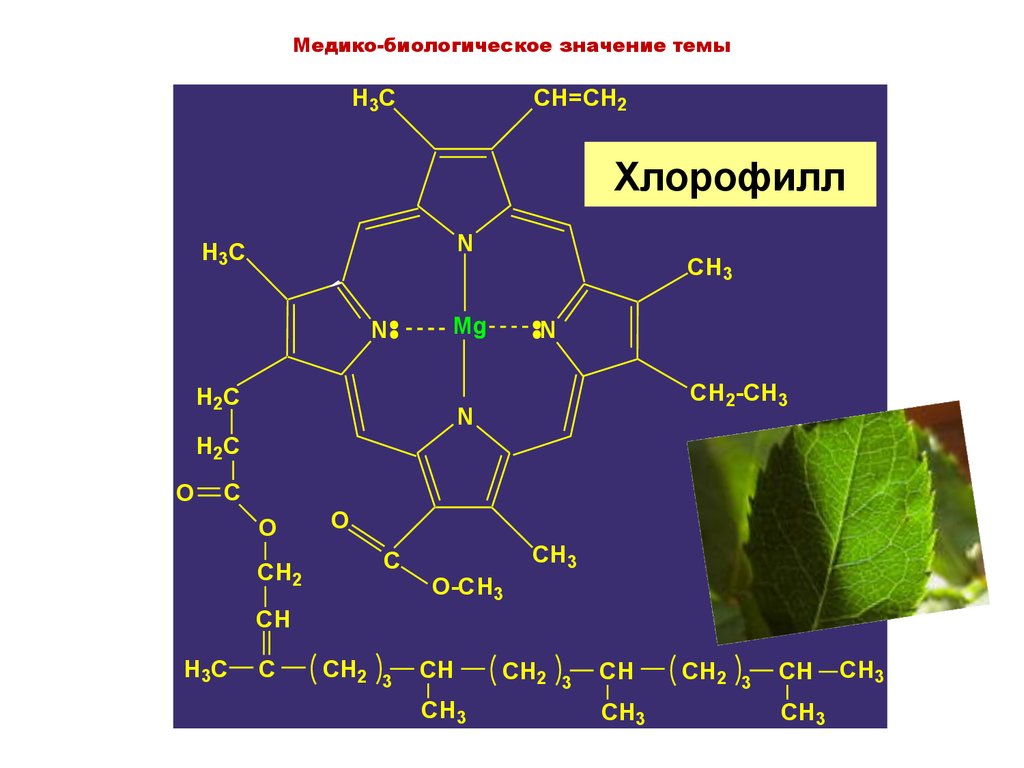
5. Хлорофилл
Медико-биологическое значение темыH3C
CH=CH2
Хлорофилл
N
H3C
N
CH3
Mg
H2C
N
CH2-CH3
N
H2C
O
C
O
O
C
CH2
CH3
O-CH3
CH
H3C
C
CH2
3
CH
CH3
CH2
3
CH
CH3
CH2
3
CH
CH3
CH3
6.
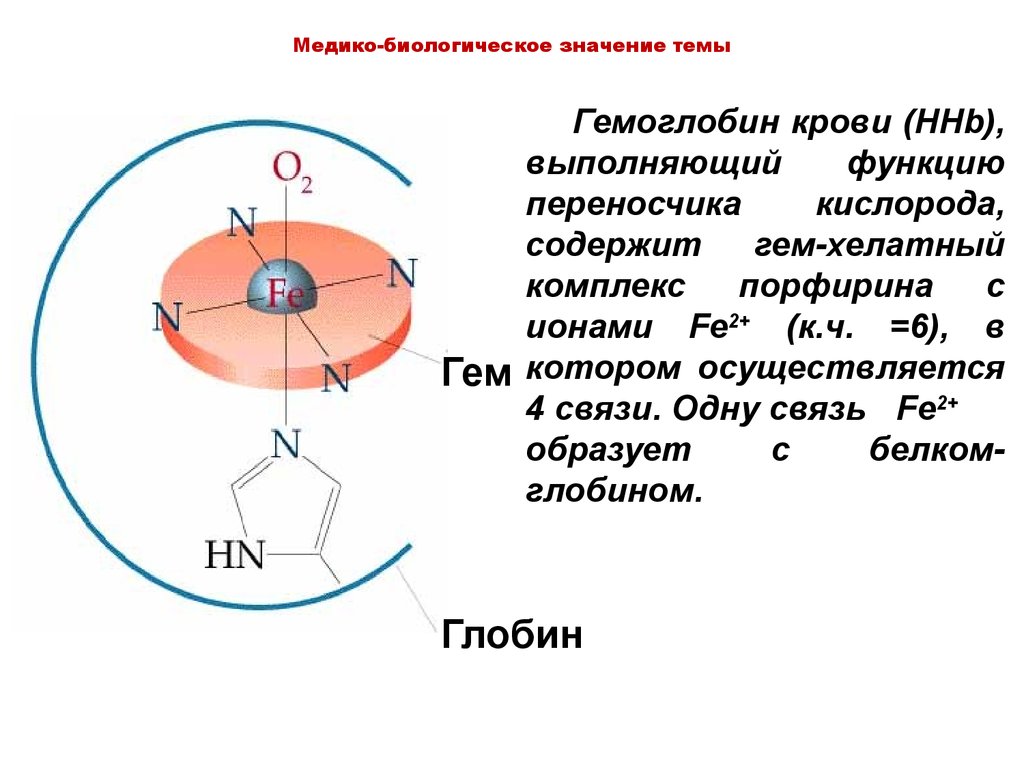
Медико-биологическое значение темыГемоглобин крови (HHb),
выполняющий
функцию
переносчика
кислорода,
содержит
гем-хелатный
комплекс
порфирина
с
ионами Fe2+ (к.ч. =6), в
Гем котором осуществляется
4 связи. Одну связь Fe2+
образует
с
белкомглобином.
Глобин
7.
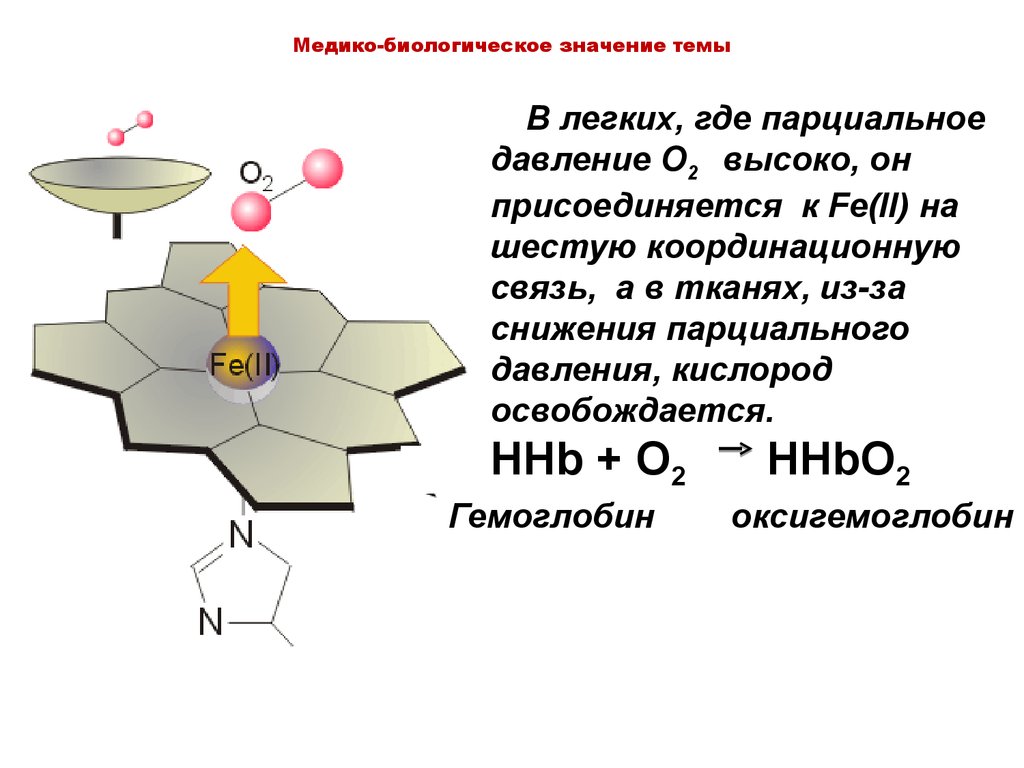
Медико-биологическое значение темыВ легких, где парциальное
давление O2 высоко, он
присоединяется к Fe(II) на
шестую координационную
связь, а в тканях, из-за
снижения парциального
давления, кислород
освобождается.
HHb + O2
Гемоглобин
HHbO2
оксигемоглобин
8.
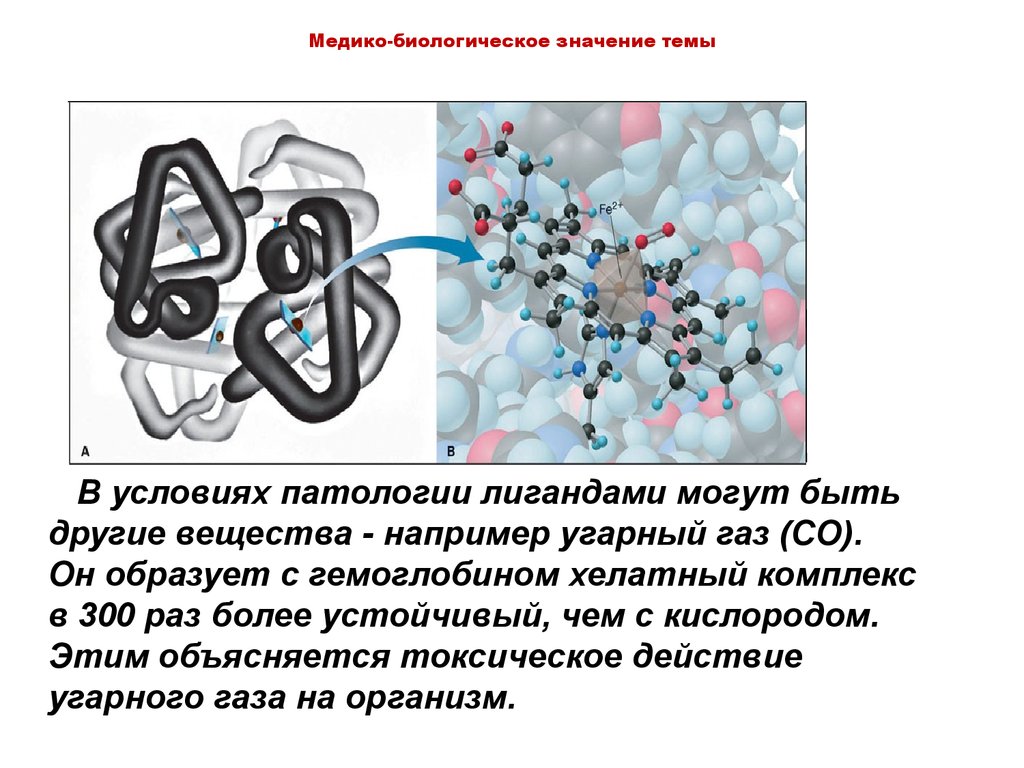
Медико-биологическое значение темыВ условиях патологии лигандами могут быть
другие вещества - например угарный газ (CO).
Он образует с гемоглобином хелатный комплекс
в 300 раз более устойчивый, чем с кислородом.
Этим объясняется токсическое действие
угарного газа на организм.
9.
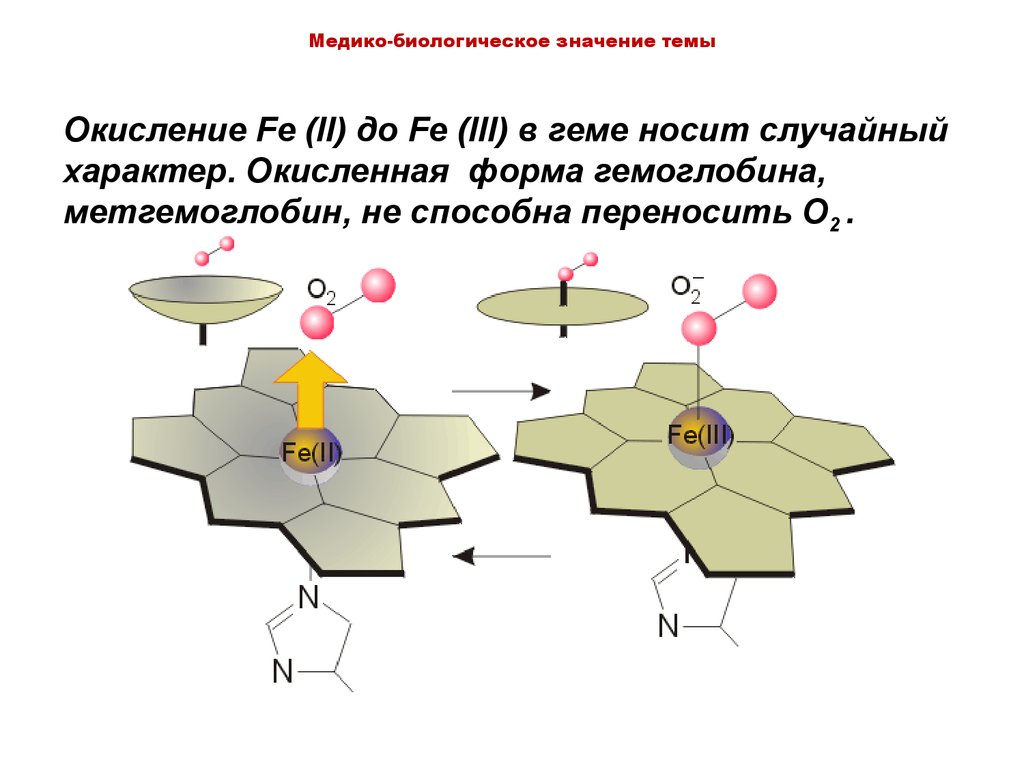
Медико-биологическое значение темыОкисление Fe (II) до Fe (III) в геме носит случайный
характер. Окисленная форма гемоглобина,
метгемоглобин, не способна переносить O2 .
10.
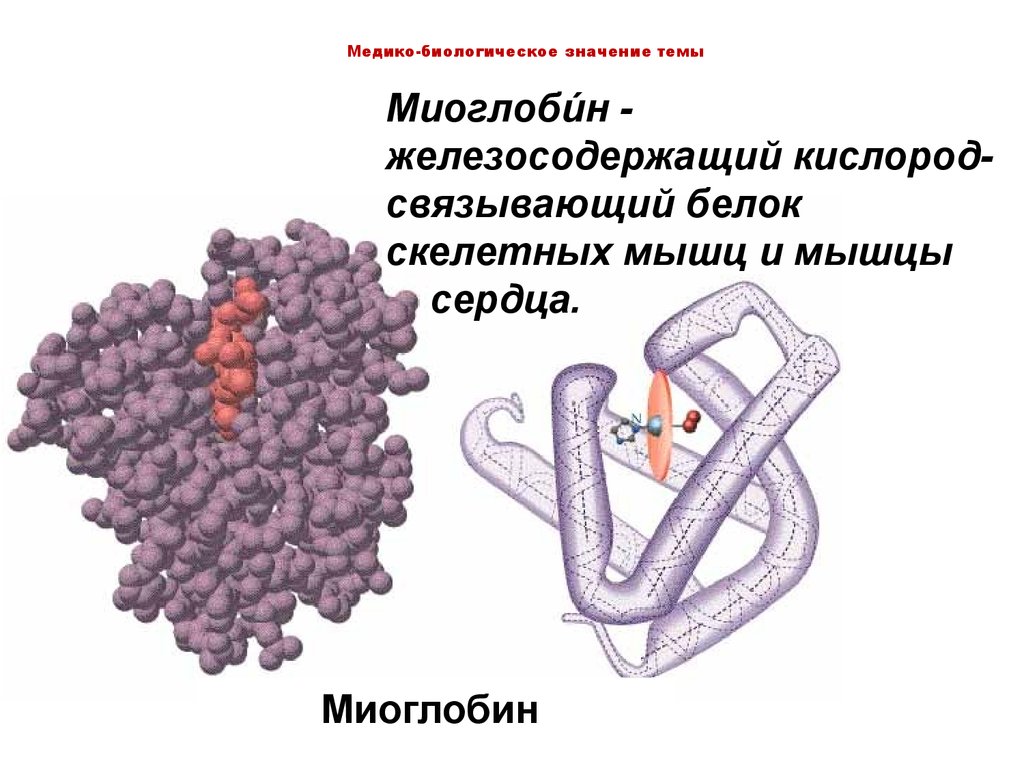
Медико-биологическое значение темыМиоглобиин железосодержащий кислородсвязывающий белок
скелетных мышц и мышцы
сердца.
Миоглобин
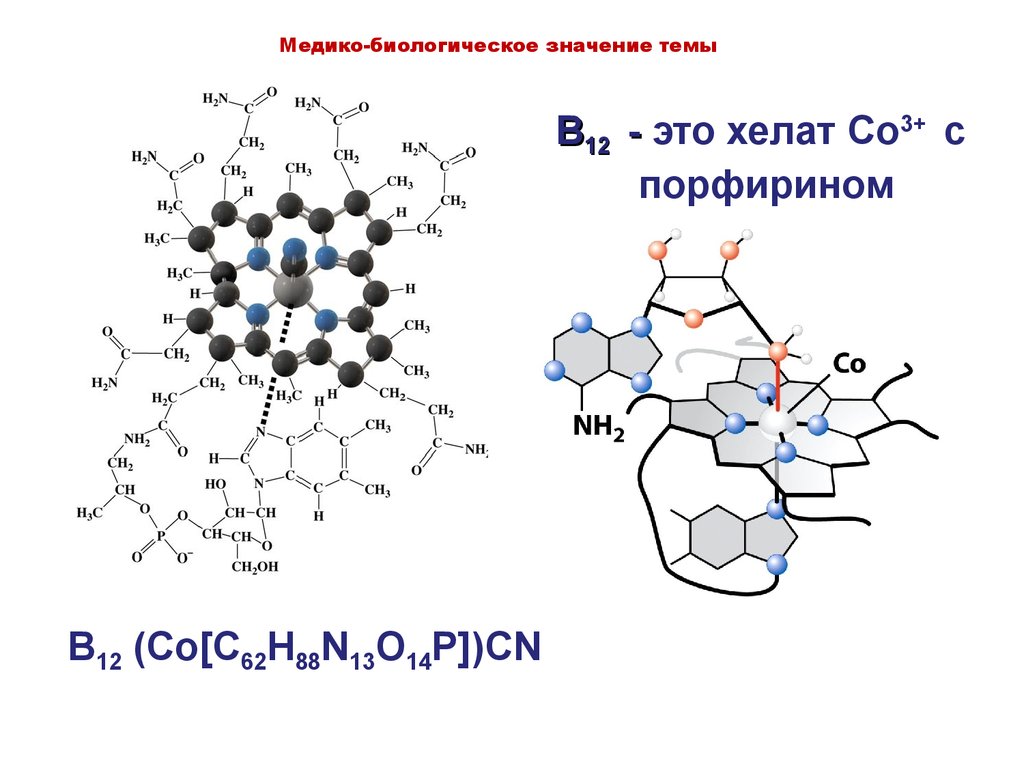
11. B12 - это хелат Co3+ c порфирином
Медико-биологическое значение темыB12 - это хелат Co3+ c
порфирином
B12 (Co[C62H88N13O14P])CN
12.
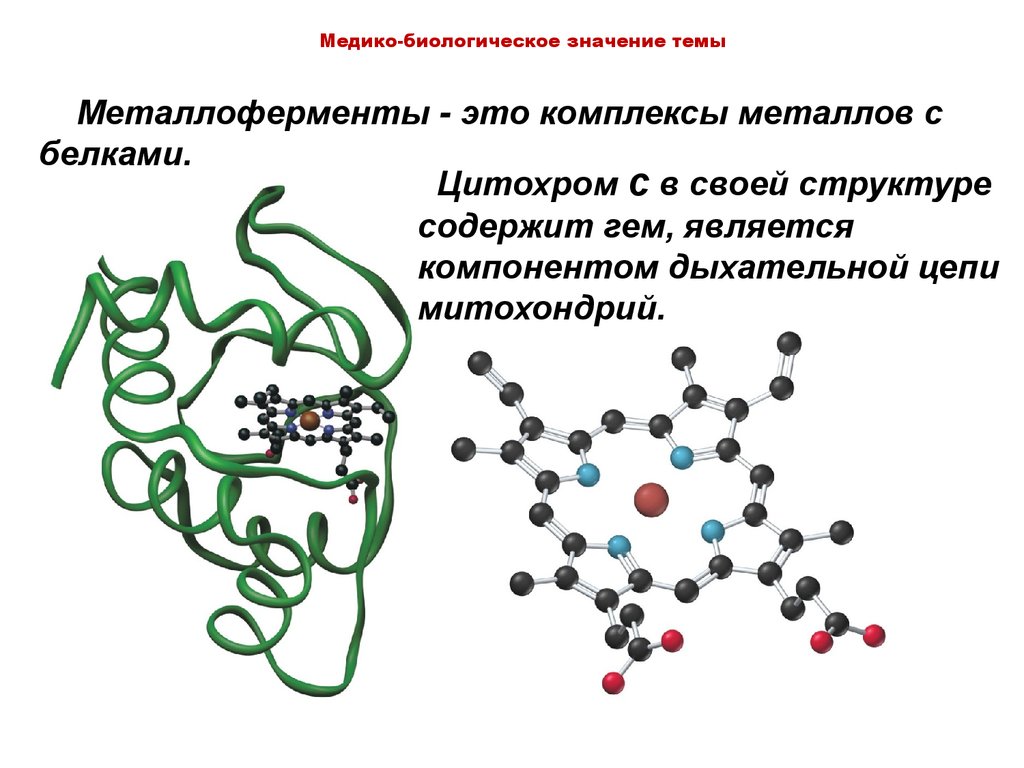
Медико-биологическое значение темыМеталлоферменты - это комплексы металлов с
белками.
Цитохром с в своей структуре
содержит гем, является
компонентом дыхательной цепи
митохондрий.
13.
Медико-биологическое значение темыКарбоксипептидазы
относятся к Znметаллоферментам.
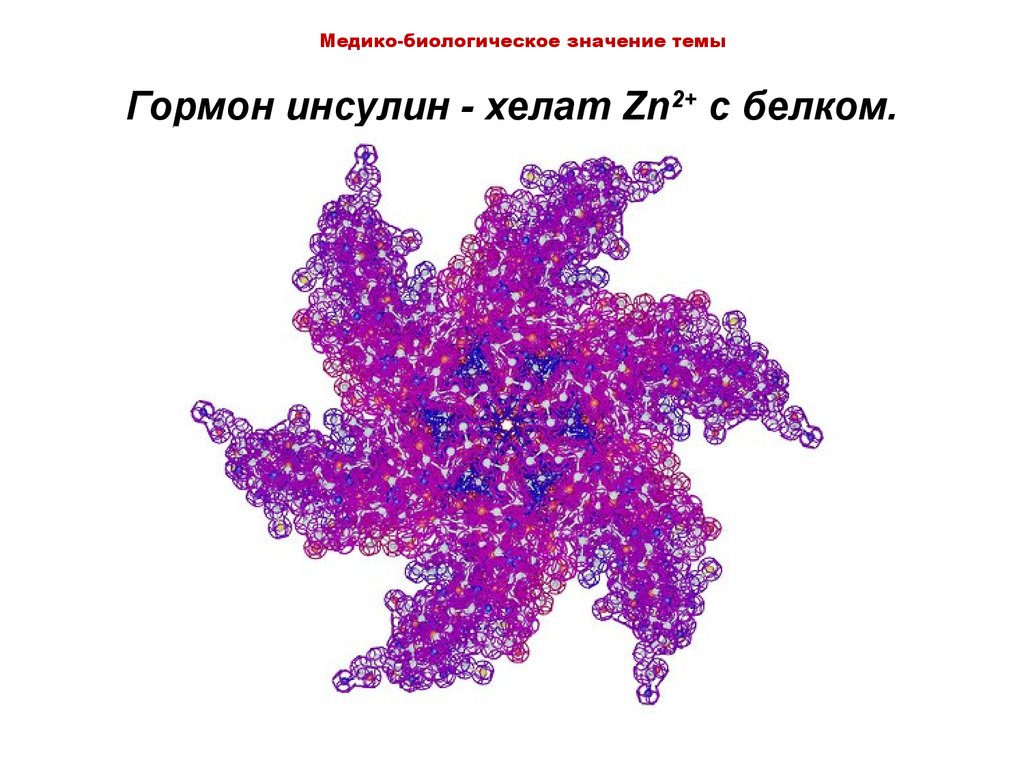
14. Гормон инсулин - хелат Zn2+ c белком.
Медико-биологическое значение темыГормон инсулин - хелат Zn2+ c белком.
15.
Медико-биологическое значение темыКомплексные соединения входят в состав фарм.
препаратов: применяются для растворения
камней в почках, печени и желчном пузыре.
Гликозидные комплексы с ионами Ca2+ и Mg2+
играют важную роль в механизме действия
сердечных препаратов.
Соль Пейроне обладает противоопухолевой
активностью.
Cl
Pt
Cl
NH3
NH3
Соль Пейроне
16.
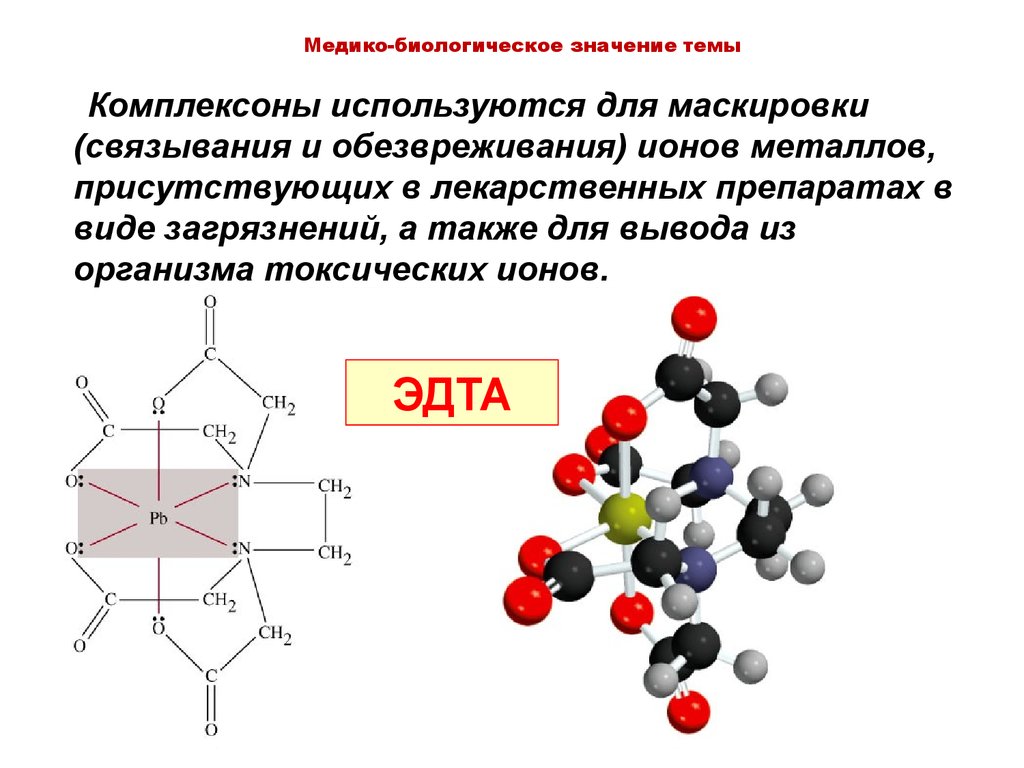
Медико-биологическое значение темыКомплексоны используются для маскировки
(связывания и обезвреживания) ионов металлов,
присутствующих в лекарственных препаратах в
виде загрязнений, а также для вывода из
организма токсических ионов.
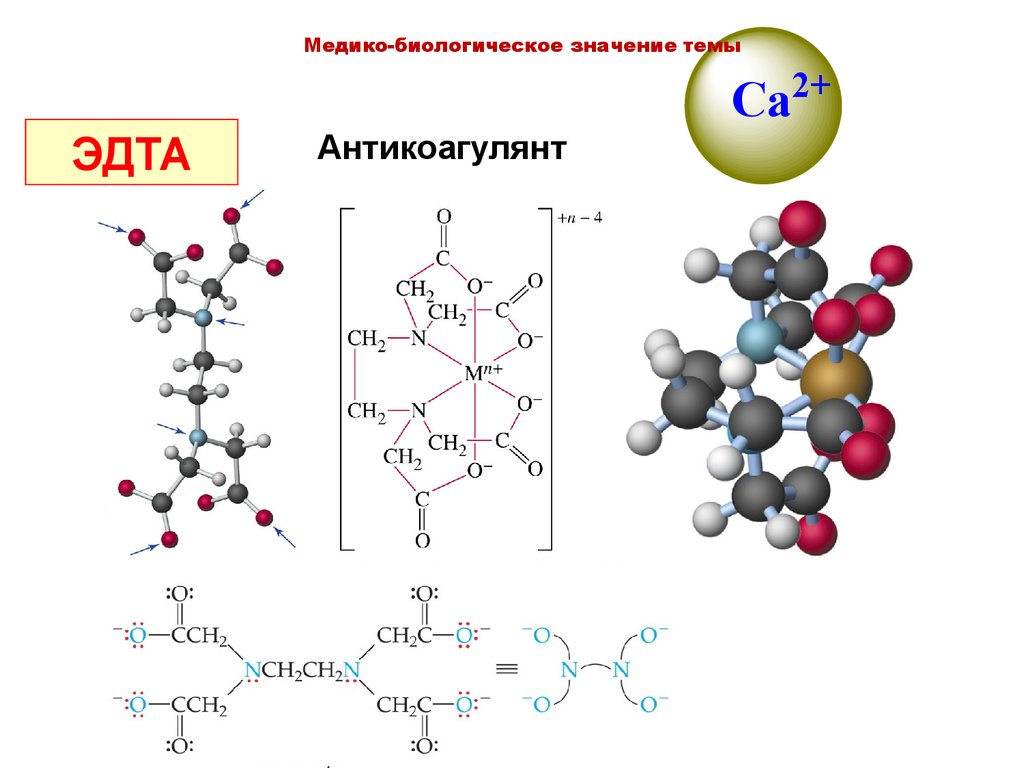
ЭДТА
17.
Медико-биологическое значение темыCa2+
ЭДТА
Антикоагулянт
18.
Медико-биологическое значение темыКомплексные соединения часто имеют яркую
окраску, поэтому их используют для
проведения качественных реакций
CuSO4 · 5 H2O
NiSO4 · 7 H2O INTRODUCCION
Co(NO3)2 ·7 H2O
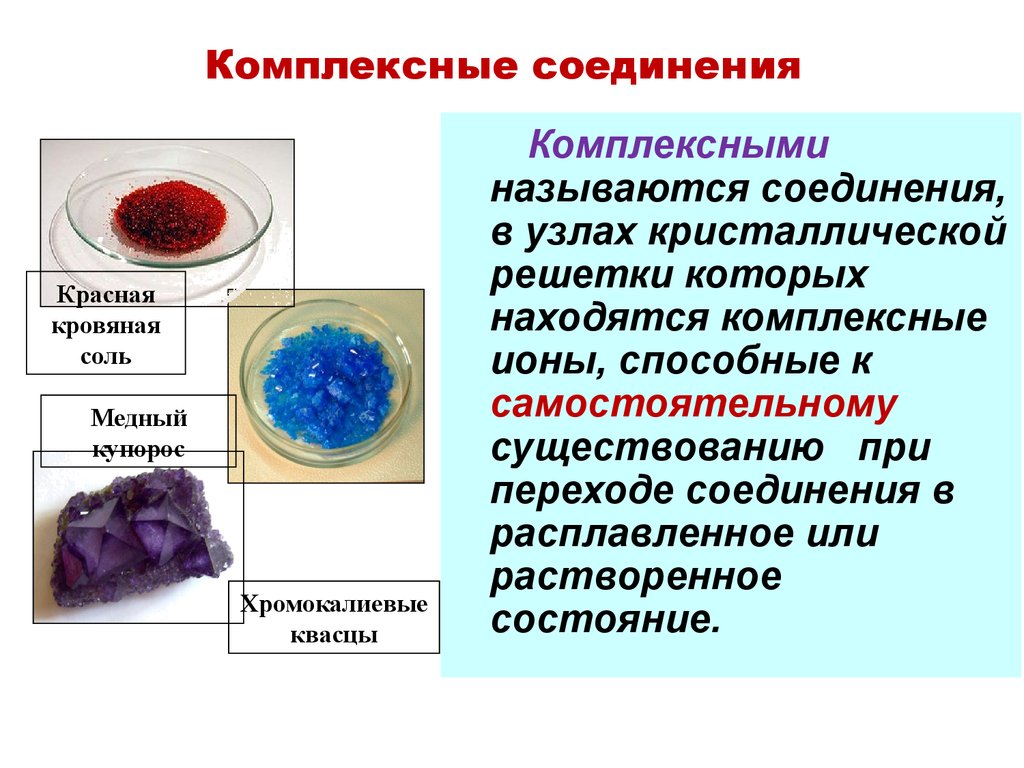
19. Комплексные соединения
Краснаякровяная
соль
Медный
купорос
Хромокалиевые
квасцы
Комплексными
называются соединения,
в узлах кристаллической
решетки которых
находятся комплексные
ионы, способные к
самостоятельному
существованию при
переходе соединения в
расплавленное или
растворенное
состояние.
20. Координационная теория А. Вернера (1893 г. )
"Меня часто охватываетэкстаз пред красотой
моей науки. Чем
дальше я погружаюсь в
ее тайны, тем более
она кажется мне
огромной,
величественной,
слишком красивой для
простого смертного."
Альфред
Вернер
(1866-1919),
швейцарский
химик
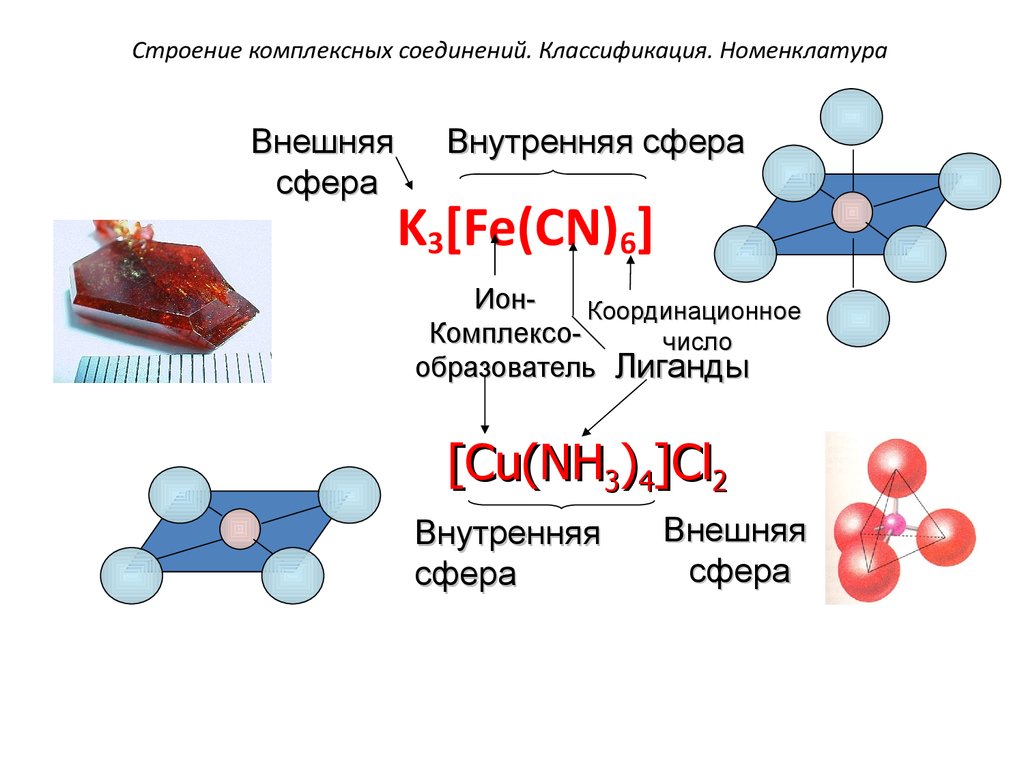
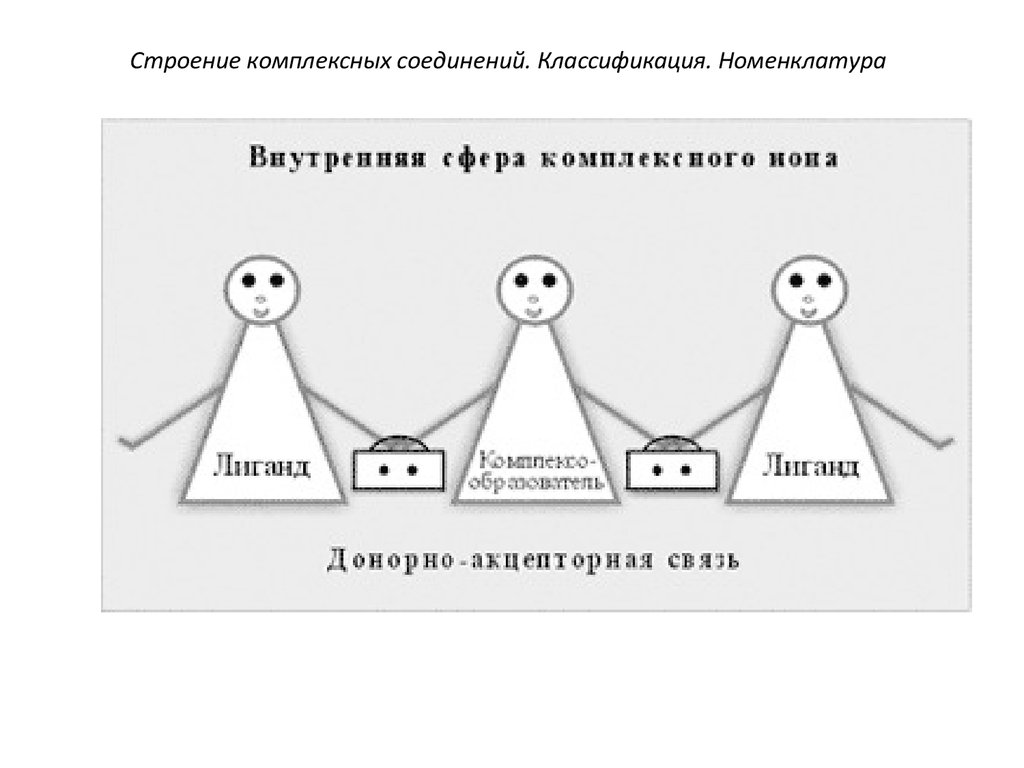
21. Строение комплексных соединений. Классификация. Номенклатура
Внешняясфера
Внутренняя сфера
K3[Fe(CN)6]
ИонКоординационное
Комплексочисло
образователь Лиганды
[Cu(NH3)4]Cl2
Внутренняя
сфера
Внешняя
сфера
22.
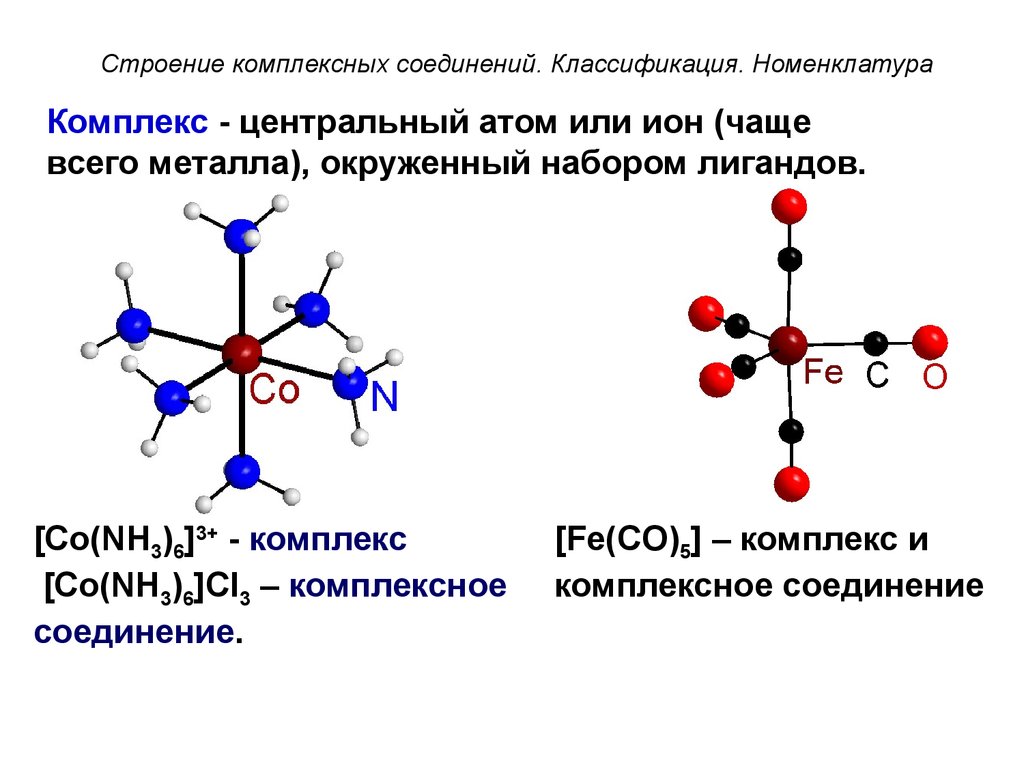
Строение комплексных соединений. Классификация. НоменклатураКомплекс - центральный атом или ион (чаще
всего металла), окруженный набором лигандов.
[Co(NH3)6]3+ - комплекс
[Co(NH3)6]Cl3 – комплексное
соединение.
[Fe(CO)5] – комплекс и
комплексное соединение
23. Строение комплексных соединений. Классификация. Номенклатура
1.Внутренняя
сфера
комплекса
включает центральный атом или ионкомплексообразователя,
вокруг
которого находятся связанные с ним
лиганды - молекулы или ионы. При
записи формул внутреннюю сферу
выделяют квадратными скобками.
24. Строение комплексных соединений. Классификация. Номенклатура
2. Внешняя сфера - это совокупностьионов, непосредственно не связанных с
центральным
атомом
комплексообразователя
и
удерживаемых
около
внутренней
сферы электростатическими силами.
25. Строение комплексных соединений. Классификация. Номенклатура
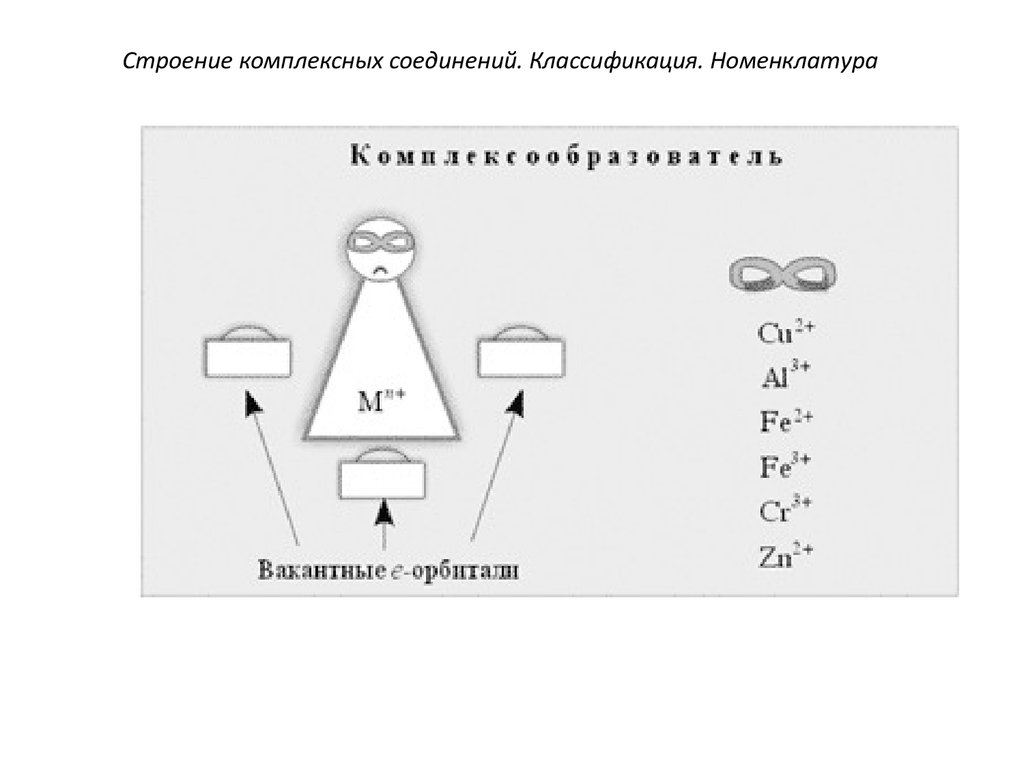
3.Комплексообразователями
являются атомы или ионы металлов,
имеющие свободные орбитали (чаще
металлы d-элементы Co3+, Cu2+, Cu+,
Fe3+, Pt2+ и др.), т.е. они являются
акцепторами электронов.
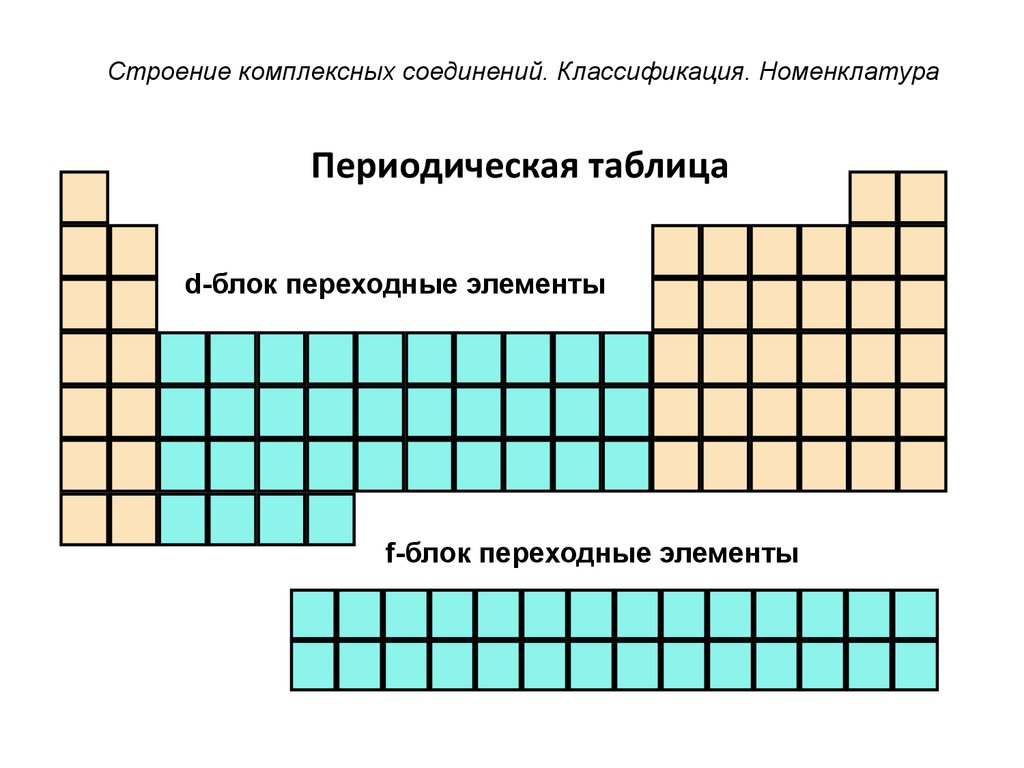
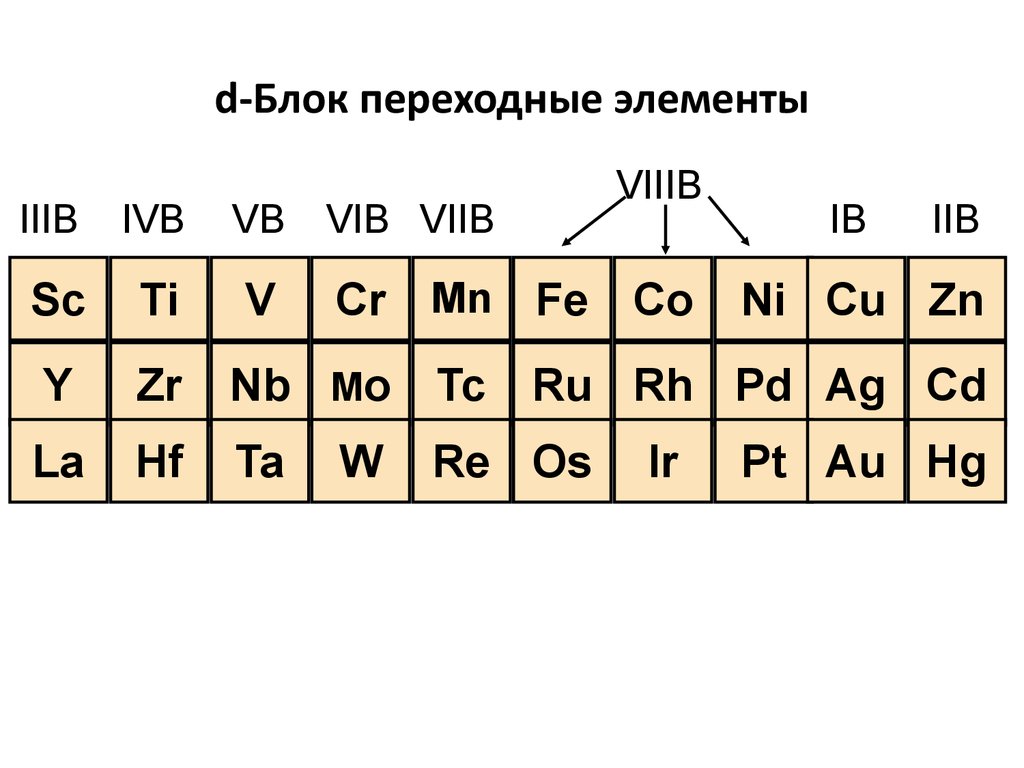
26. Периодическая таблица
Строение комплексных соединений. Классификация. НоменклатураПериодическая таблица
d-блок переходные элементы
f-блок переходные элементы
27. d-Блок переходные элементы
IIIBIVB
VB
Sc
Ti
V
Y
Zr
Nb Mo Tc
La
Hf
Ta
VIIIB
VIB VIIB
Cr Mn Fe Co
W
IB
IIB
Ni Cu Zn
Ru Rh Pd Ag Cd
Re Os
Ir
Pt Au Hg
28. Электронные конфигурации
ЭлементSc
Ti
V
Cr
Mn
Конфигурация
[Ar]3d14s2
[Ar]3d24s2
[Ar]3d34s2
[Ar]3d54s1
[Ar]3d54s2
[Ar] = 1s22s22p63s23p6
29. Электронные конфигурации
ЭлементFe
Co
Ni
Cu
Zn
Конфигурация
[Ar] 3d64s2
[Ar] 3d74s2
[Ar] 3d84s2
[Ar]3d104s1
[Ar]3d104s2
[Ar] = 1s22s22p63s23p6
30. Строение комплексных соединений. Классификация. Номенклатура
31. Строение комплексных соединений. Классификация. Номенклатура
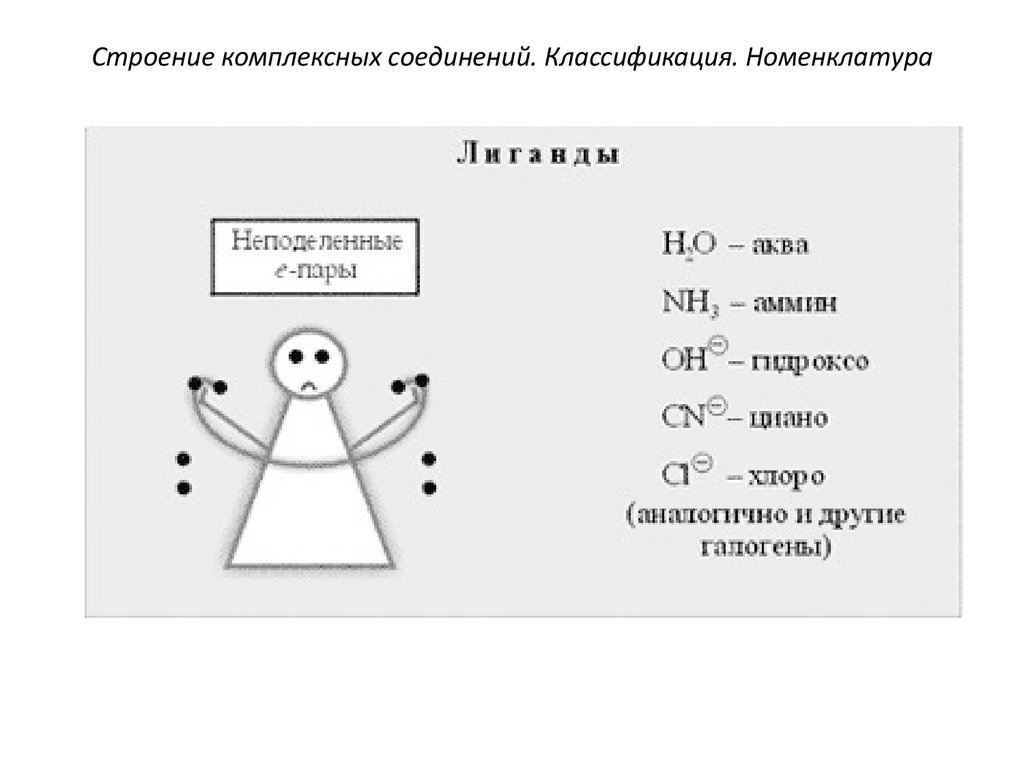
4. Лиганды (от лат. ligo – привязываю)имеют неподеленные электронные пары,
т.е. являются донорами электронов(или
адденами) - гидроксо-группы (OH-),
кислотные остатки (Cl, Br-, J-, NO2-,
CN-,SO42- и др.), а также нейтральные
полярные молекулы (H2O, NH3, CO и др.).
32. Строение комплексных соединений. Классификация. Номенклатура
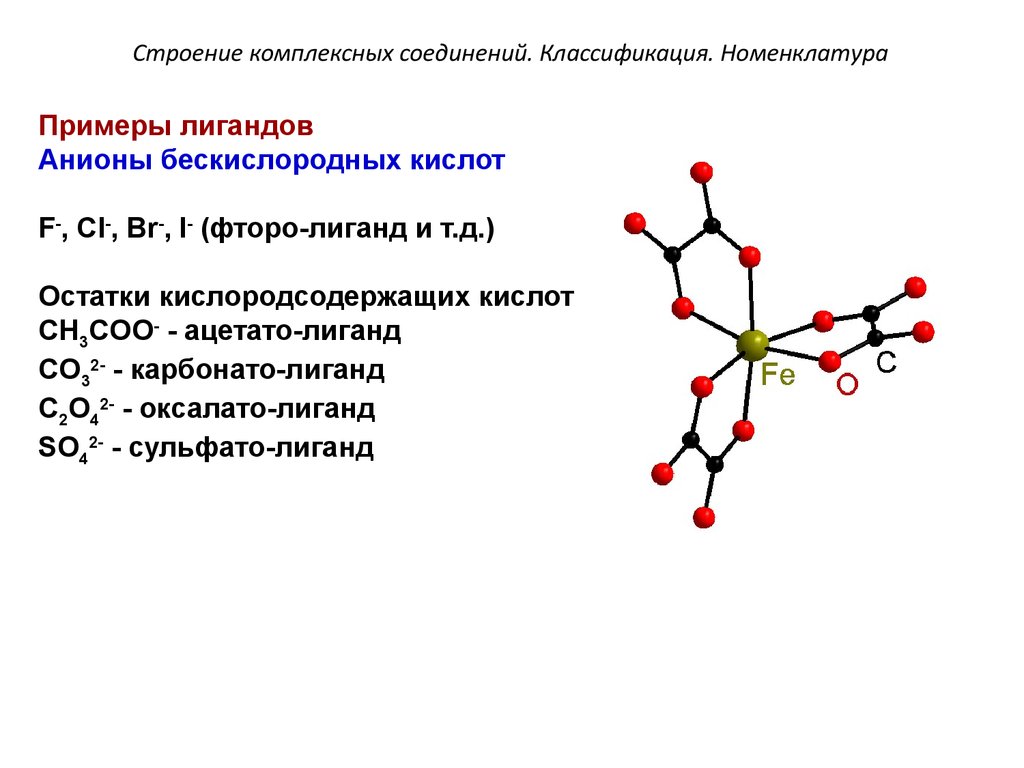
Примеры лигандовАнионы бескислородных кислот
F-, Cl-, Br-, I- (фторо-лиганд и т.д.)
Остатки кислородсодержащих кислот
CH3COO- - ацетато-лиганд
CO32- - карбонато-лиганд
C2O42- - оксалато-лиганд
SO42- - сульфато-лиганд
33.
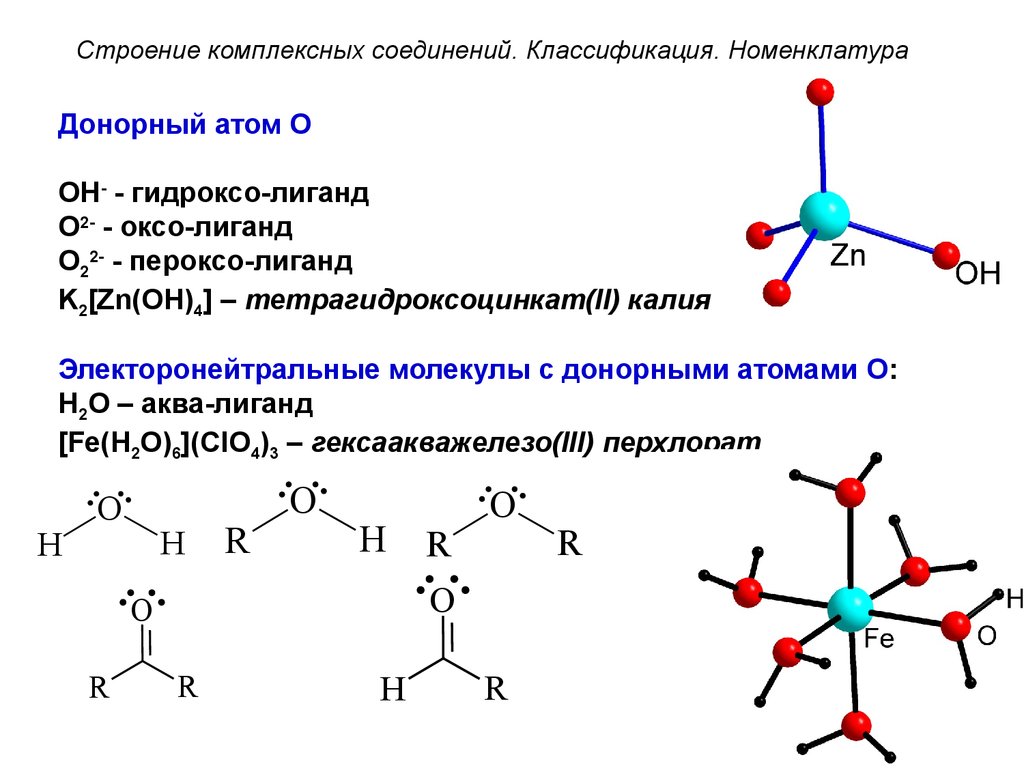
Строение комплексных соединений. Классификация. НоменклатураДонорный атом O
OH- - гидроксо-лиганд
O2- - оксо-лиганд
O22- - пероксо-лиганд
K2[Zn(OH)4] – тетрагидроксоцинкат(II) калия
Электоронейтральные молекулы с донорными атомами O:
H2O – аква-лиганд
[Fe(H2O)6](ClO4)3 – гексаакважелезо(III) перхлорат
H
O
H
R
O
H
O
R
R
H
R
O
O
R
R
34. Строение комплексных соединений. Классификация. Номенклатура
35. Строение комплексных соединений. Классификация. Номенклатура
5. Механизм комплексообразованиясвязан
с
межионным,
межмолекулярным взаимодействиями,
но основной вклад в образование
внутренней сферы вносит донорноакцепторное взаимодействие.
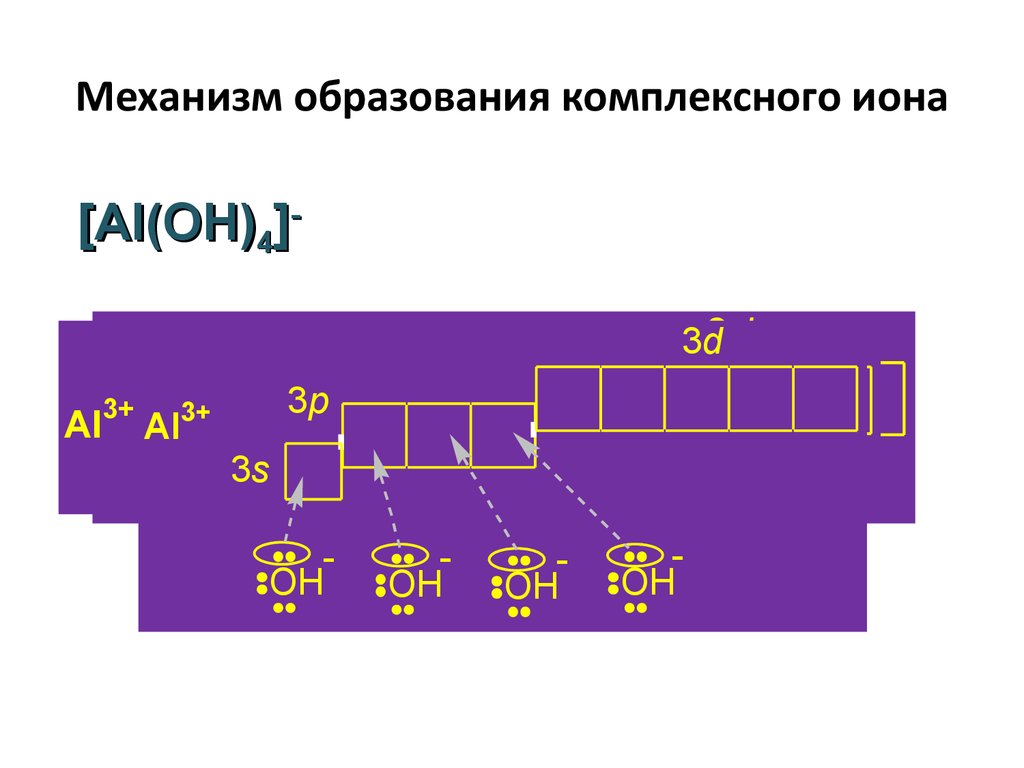
36. Механизм образования комплексного иона
[Al(OH)4]3d3d
3d
3+
AlAl Al
3+
3p
3p
3p
3s
3s3s
OH
OH
OH
OH
37. Строение комплексных соединений. Классификация. Номенклатура
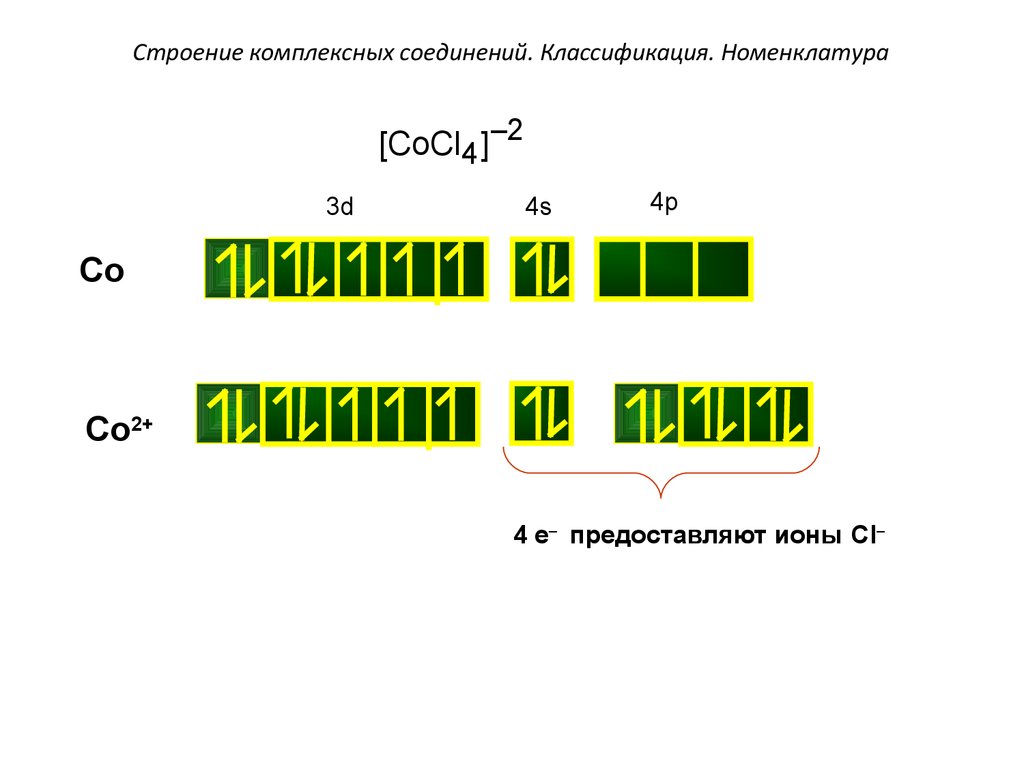
[CoCl4 ]–23d
4s
4p
Co
Co2+
4 e– предоставляют ионы Cl–
38. Строение комплексных соединений. Классификация. Номенклатура
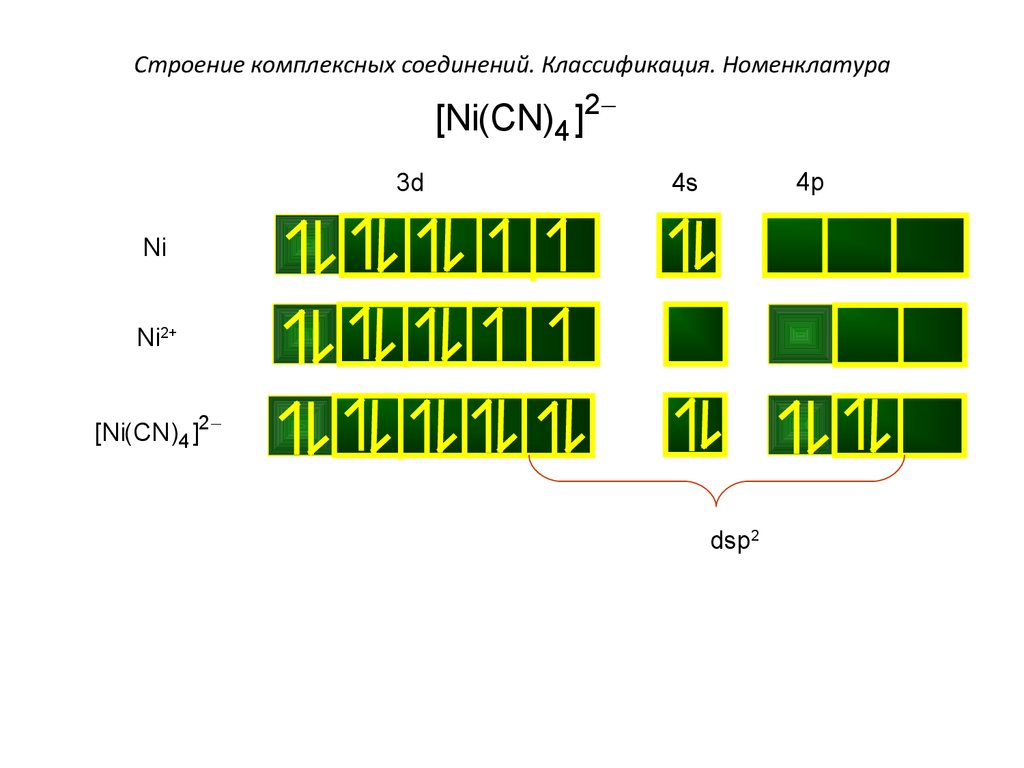
[Ni(CN)4 ]23d4p
4s
Ni
Ni2+
[Ni(CN)4 ]2-
dsp2
39. Строение комплексных соединений. Классификация. Номенклатура
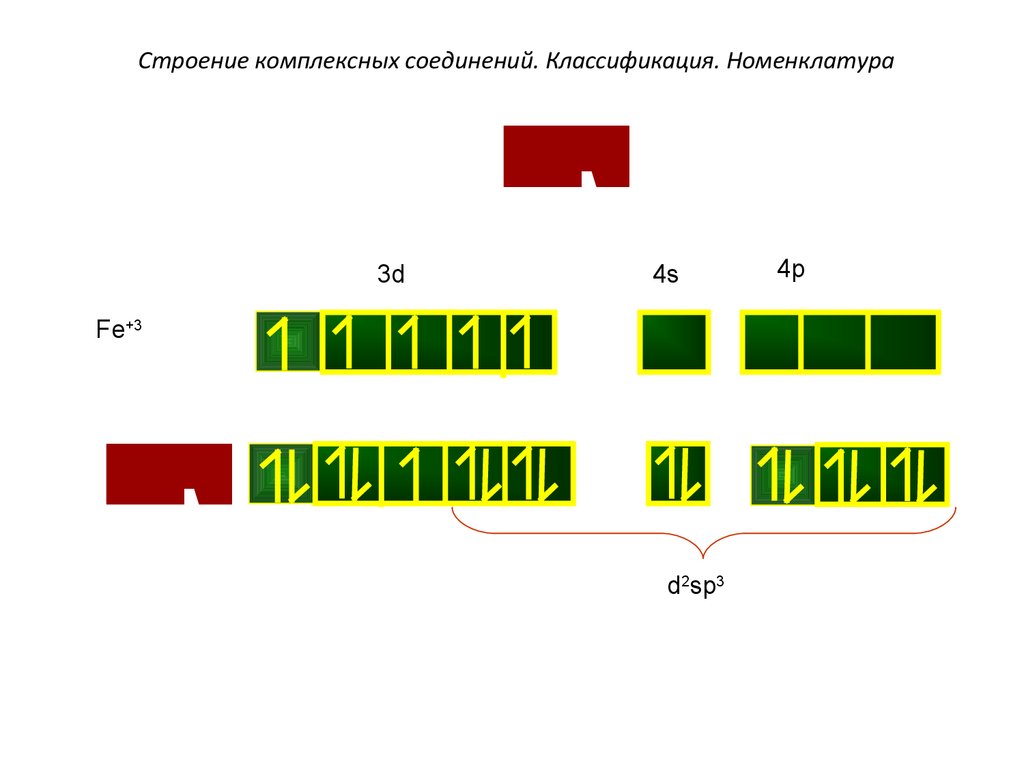
3–
[
F
e
(
C
N
)
]
6
[Fe(C
N
)6]3–
Строение комплексных соединений. Классификация. Номенклатура
3d
4s
Fe+3
d2sp3
4p
40. Строение комплексных соединений. Классификация. Номенклатура
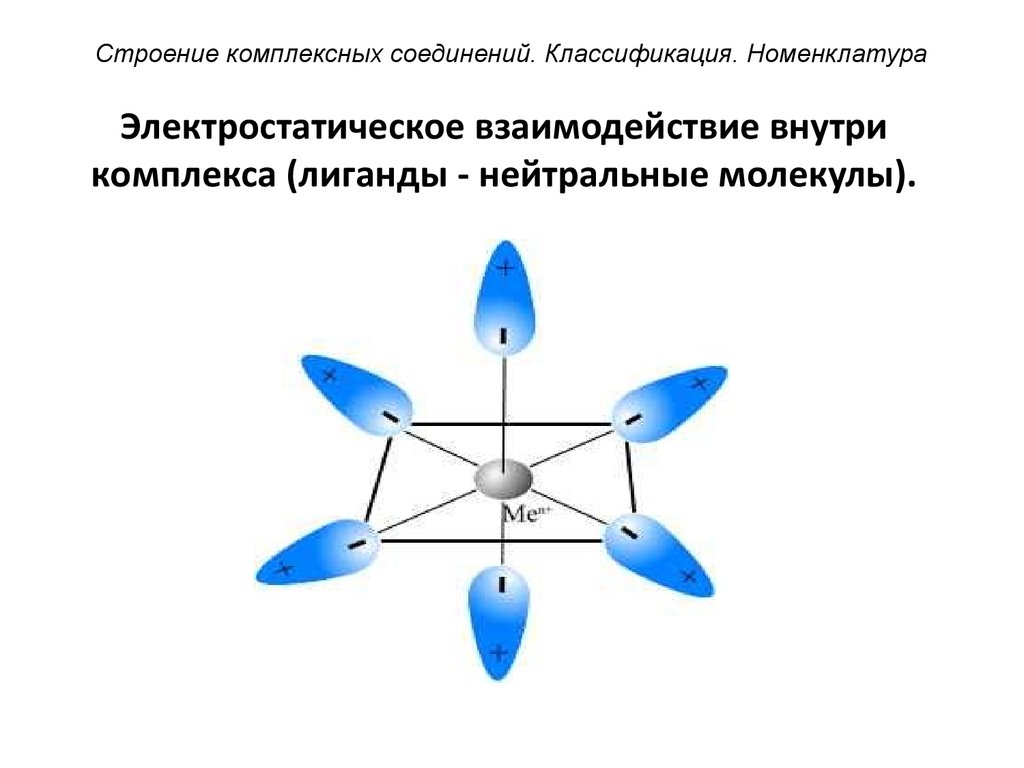
41. Электростатическое взаимодействие внутри комплекса (лиганды - нейтральные молекулы).
Строение комплексных соединений. Классификация. НоменклатураЭлектростатическое взаимодействие внутри
комплекса (лиганды - нейтральные молекулы).
42. Строение комплексных соединений. Классификация. Номенклатура
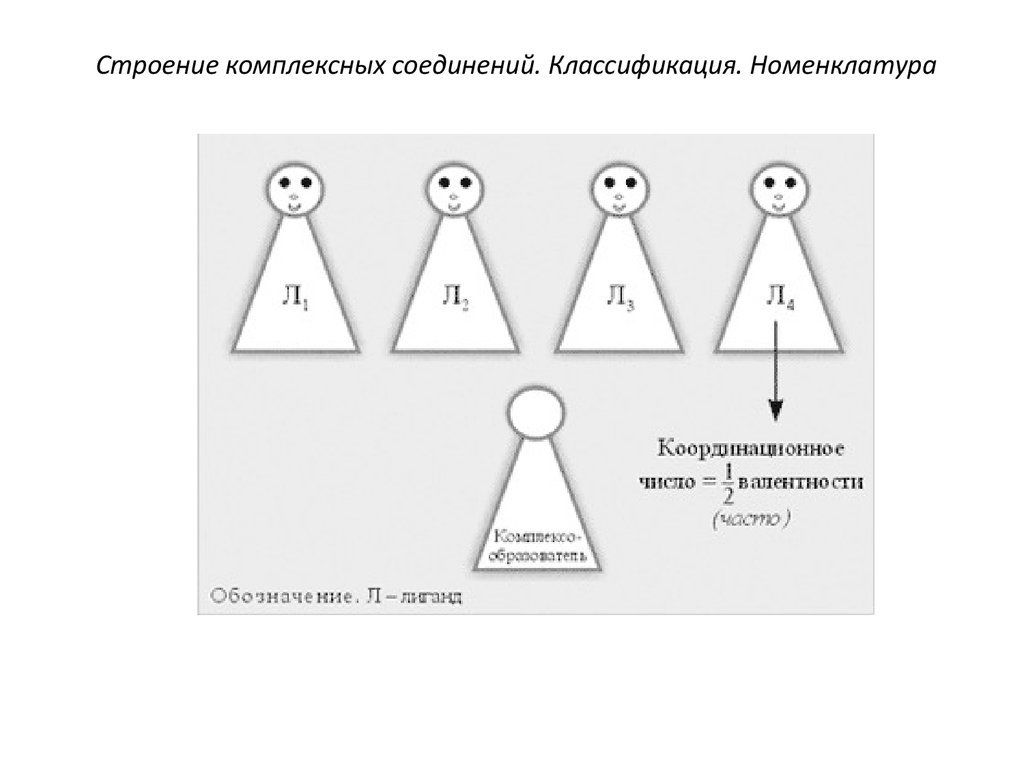
6. Координационное число (к. ч.)комплексообразователя показывает,
сколько
связей
образует
комплексообразователь с лигандами.
Величина к.ч. зависит от природы
комплексообразователя, лигандов и
условий комплексообразования
(концентрации, рН, температуры и др.).
43. Строение комплексных соединений. Классификация. Номенклатура
44. Строение комплексных соединений. Классификация. Номенклатура
Координационные числа наиболеераспространенных комплексообразователей:
Комплексообразователь
К.ч.
Ag+ , Cu+
Cu2+ , Zn2+, Pt2+, Hg2+
Fe3+, Co3+, Fe2+, Ni2+, Al3+, Pt4+
2
4
6
45. Строение комплексных соединений. Классификация. Номенклатура
Низкие КЧ = 2, 3 – встречаются редко.КЧ = 2 характерно для Cu(I), Ag(I), Au(I) и
Hg(II), линейные комплексы ( угол 180о).
КЧ = 2
NH3 - Ag - NH3
Cl - Ag - Cl
КЧ = 3 встречается
очень редко,
K[Cu(CN)2]
46. Квадратный комплекс [Pt2+(NH3)2Cl2]
Строение комплексных соединений. Классификация. НоменклатураКЧ = 4 (тетраэдр и плоский квадрат).
[Ni(CO)4] 2+
Тетраэдр
Квадратный комплекс
[Pt2+(NH3)2Cl2]
47.
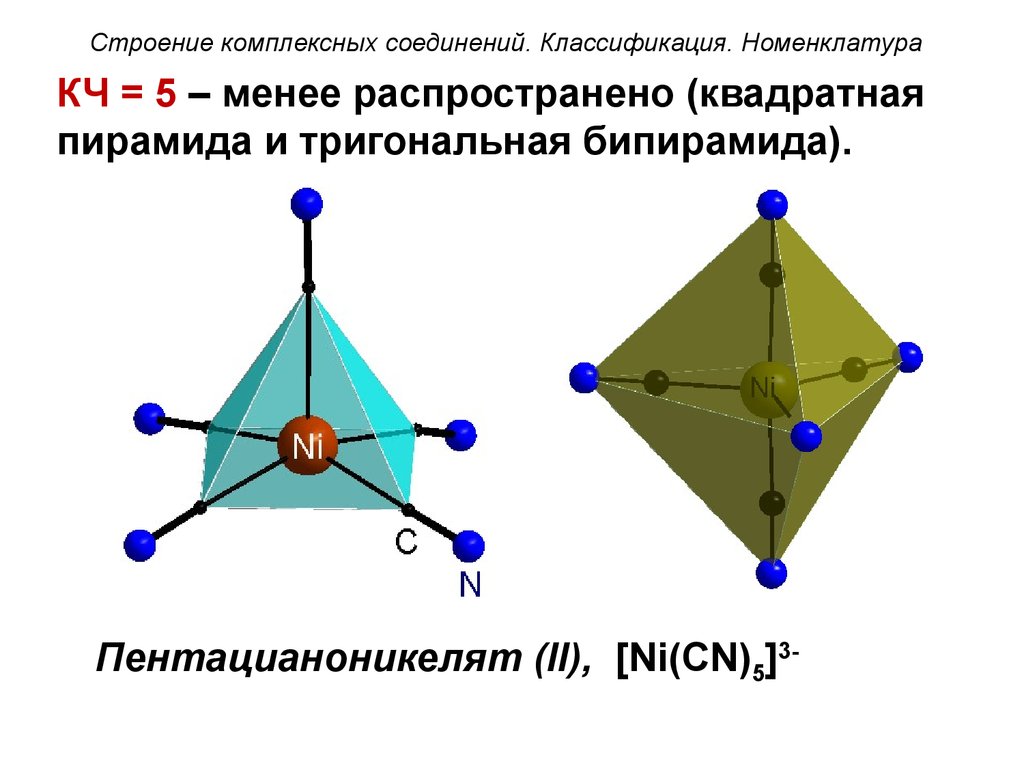
Строение комплексных соединений. Классификация. НоменклатураКЧ = 5 – менее распространено (квадратная
пирамида и тригональная бипирамида).
Пентацианоникелят (II), [Ni(CN)5]3-
48.
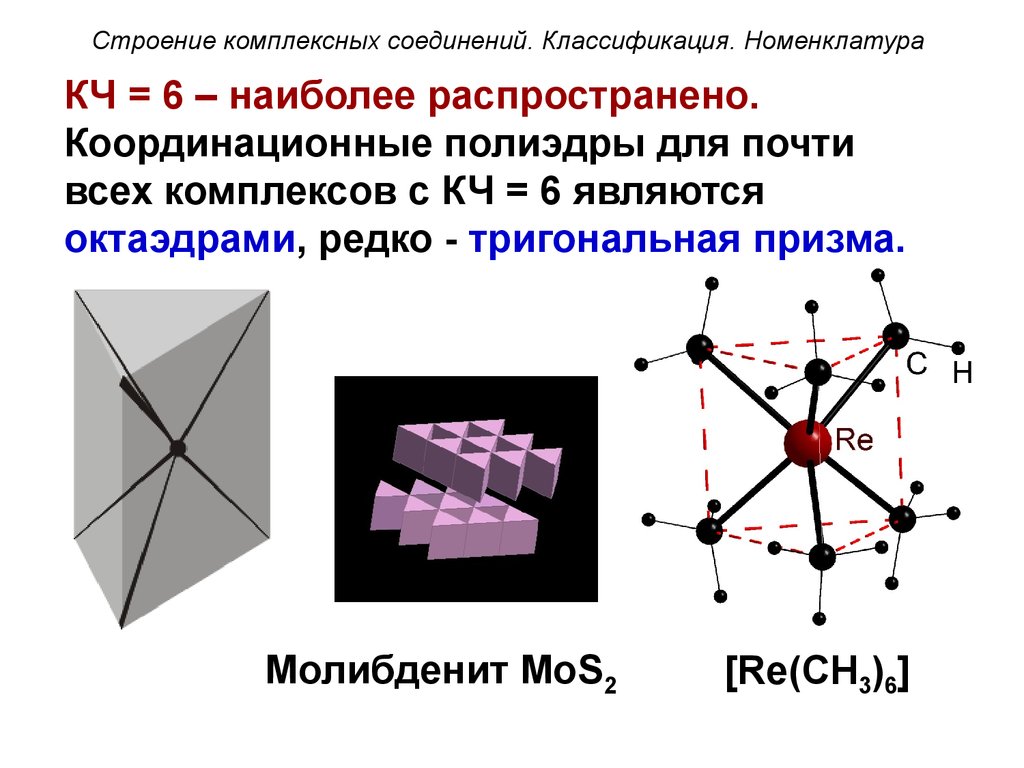
Строение комплексных соединений. Классификация. НоменклатураКЧ = 6 – наиболее распространено.
Координационные полиэдры для почти
всех комплексов с КЧ = 6 являются
октаэдрами, редко - тригональная призма.
Молибденит MoS2
[Re(CH3)6]
49.
Строение комплексных соединений. Классификация. НоменклатураКЧ = 6 – наиболее характерно для металлов
с электронной конфигурацией от d0 до d9.
Примеры: d0 – [Sc(H2O)6]3+; d3 – [Cr(H2O)6]3+;
– [Fe(CN)6]3-; d6 – [RhCl6]3-.
d5
50.
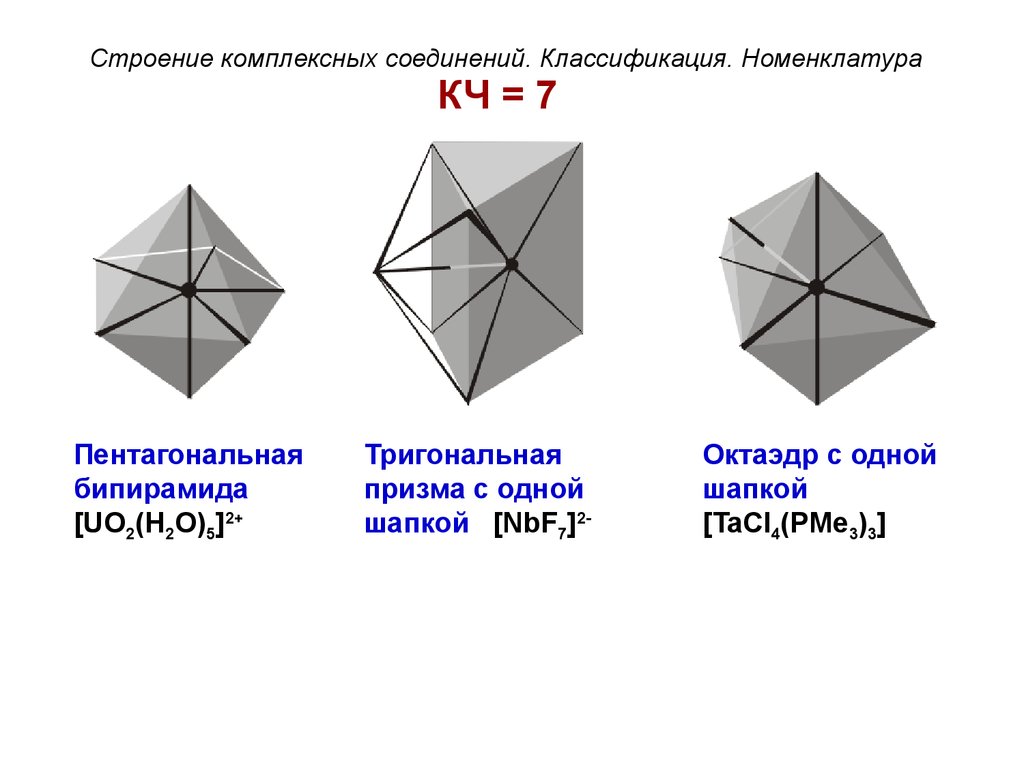
Строение комплексных соединений. Классификация. НоменклатураКЧ = 7
Пентагональная
бипирамида
[UO2(H2O)5]2+
Тригональная
призма с одной
шапкой [NbF7]2-
Октаэдр с одной
шапкой
[TaCl4(PMe3)3]
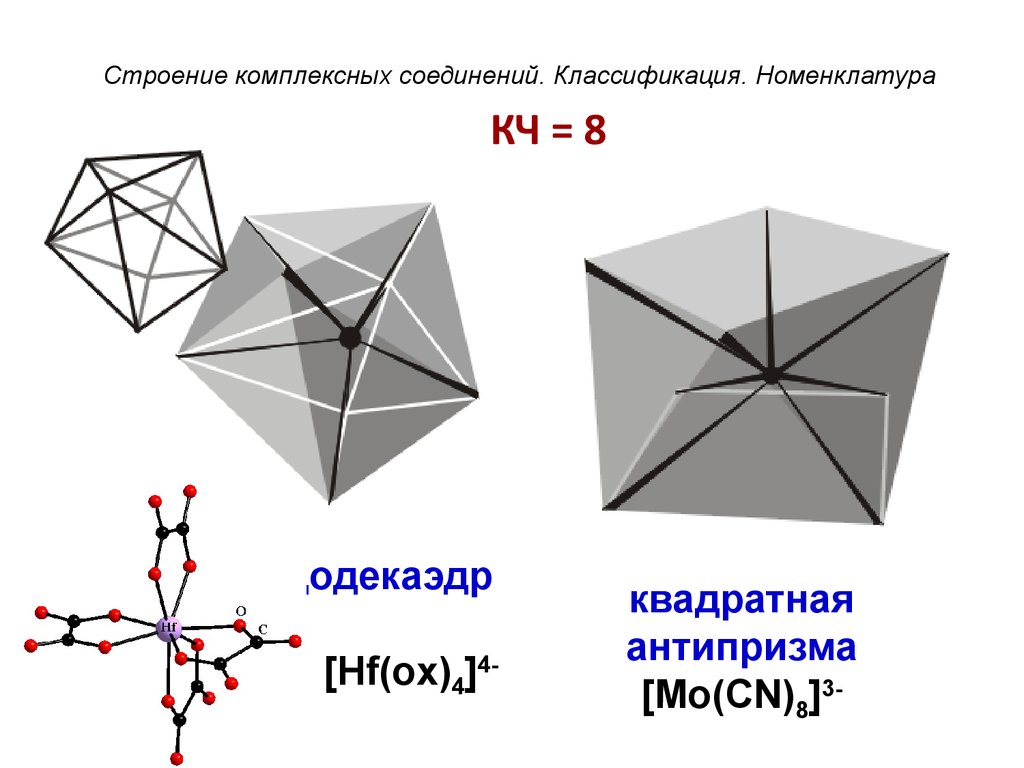
51. КЧ = 8
Строение комплексных соединений. Классификация. НоменклатураКЧ = 8
додекаэдр
[Hf(ox)4]4-
квадратная
антипризма
[Mo(CN)8]3-
52. КЧ = 8, [СoF8]5- квадратная антипризма
Строение комплексных соединений. Классификация. НоменклатураКЧ = 8, [СoF8]5- квадратная антипризма
53.
Строение комплексных соединений. Классификация. НоменклатураКЧ = 9 важно для лантаноидов, т.к.
катионы Ln3+ имеют достаточно большие
размеры: (тригональная призма с тремя
шапками)
[Nd(H2O)9]3+
[ReH9]2-
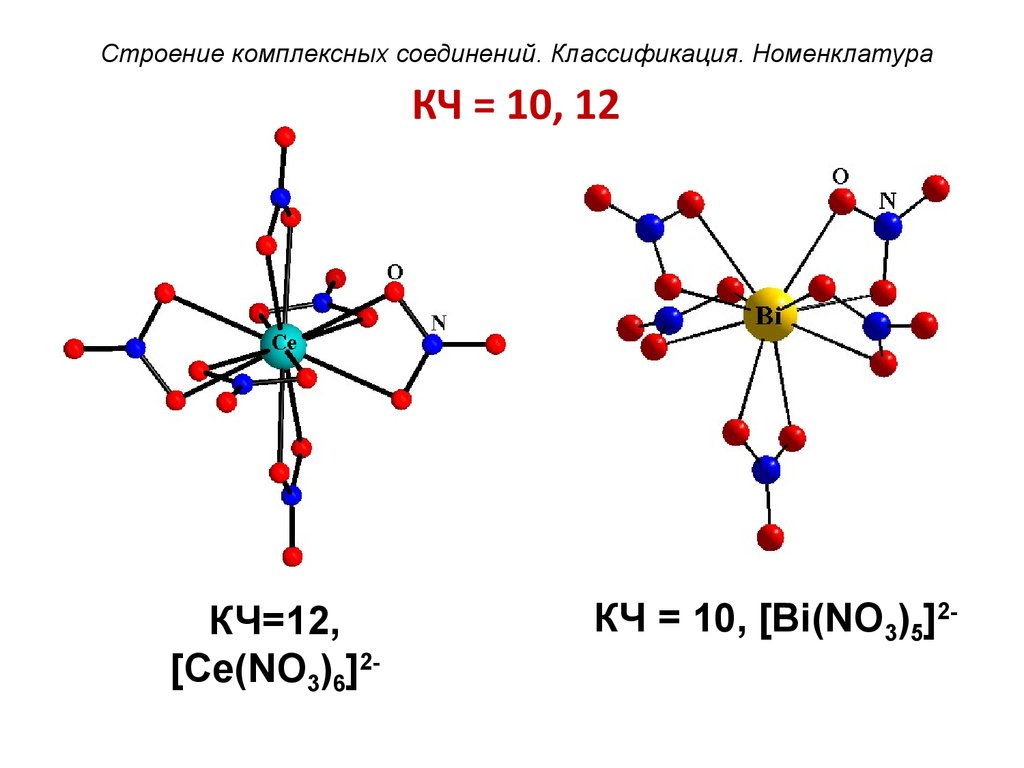
54. КЧ = 10, 12
Строение комплексных соединений. Классификация. НоменклатураКЧ = 10, 12
КЧ=12,
[Ce(NO3)6]2-
КЧ = 10, [Bi(NO3)5]2-
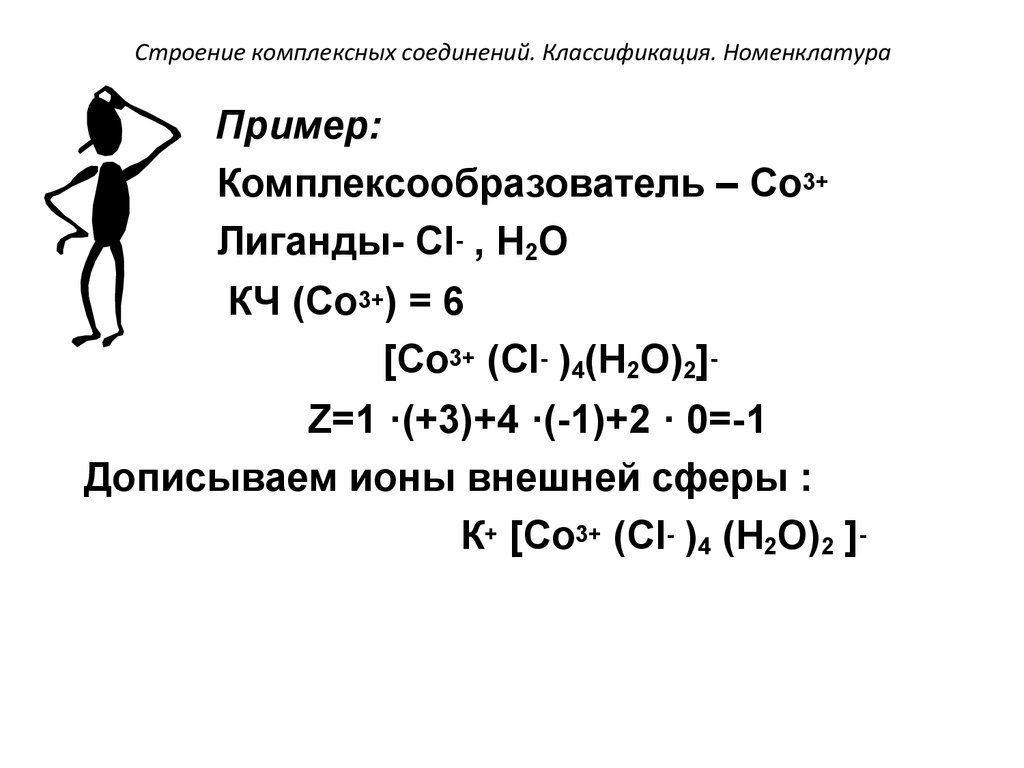
55.
Строение комплексных соединений. Классификация. НоменклатураПример: Заряд внутренней сферы
комплексного соединения Z равен
алгебраической сумме зарядов
комплексообразователя и лигандов.
56. Строение комплексных соединений. Классификация. Номенклатура
Пример:Комплексообразователь – Со3+
Лиганды- Сl- , Н2О
КЧ (Со3+) = 6
[Со3+ (Сl- )4(Н2О)2]Z=1 ·(+3)+4 ·(-1)+2 · 0=-1
Дописываем ионы внешней сферы :
К+ [Со3+ (Сl- )4 (Н2О)2 ]-
57.
Классификация и номенклатуракомплексных соединений
По характеру заряда внутренней сферы
различают катионные, анионные и
нейтральные комплексы.
Например:
1)[Cu2+(H 2 О)4]2+ - катионный комплекс
2)[Fe3+ (CN)6]3- - анионный комплекс
3) [Zn 2+(ОН)2(NН3)(Н 2 О)]0 - нейтральный
комплекс
58. Строение комплексных соединений. Классификация. Номенклатура
Название комплекса:Число лигандов – греч.
числит.
• 1 – (моно)
• 2 – ди
• 3 – три
• 4 – тетра
• 5 – пента
• 6 – гекса
• 7 – гепта …
число лигандов каждого
типа название
лигандов название
комплексообр. в нужной
форме
• Число сложных лигандов:
бис-, трис-, тетракис-,
пентакис- …
• [M(en)4] тетракис(этилендиамин)…
• [M(SO42-)2] бис(сульфато-)…
59. I. Номенклатура катионных комплексов
• Греческим числительным называют число лигандов:1-моно, 2-ди, 3-три, 4-тетра, 5-пента, 6-гекса
• Называют лиганды:
а) нейтральные молекулы (их называют в первую
очередь): Н2О –аква; NH3 – аммин; СО – карбонил;
NO – нитрозил.
б) лиганды-анионы называют с окончанием «-о»:
ОН- - гидроксо; CI- -хлоро; Br- - бромо; I- - иодо;
NO2- - нитро; NO3- - нитрато; SO42- - сульфато;
CN- - циано; SCN- - родано.
• Называют комплексообразователь русским
наименованием.
• Отмечают валентность комплексообразователя
римской цифрой в скобках.
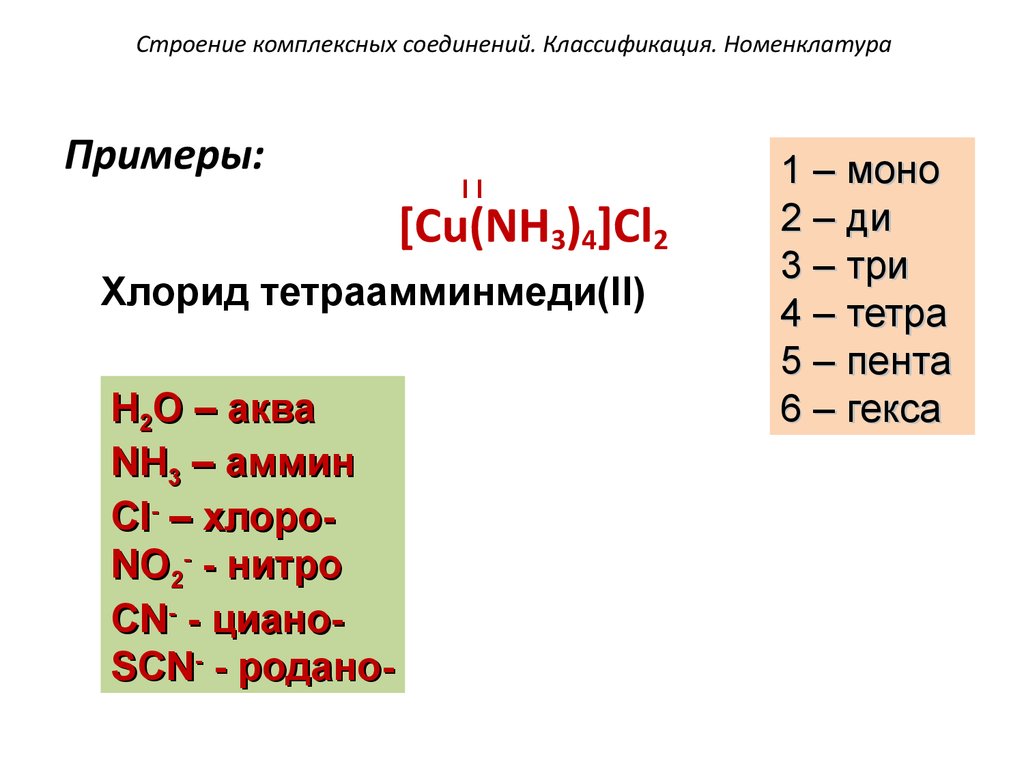
60. Строение комплексных соединений. Классификация. Номенклатура
Примеры:II
[Cu(NH3)4]Cl2
Хлорид тетраамминмеди(II)
H2O – аква
NH3 – аммин
Cl- – хлороNO2- - нитро
CN- - цианоSCN- - родано-
1 – моно
2 – ди
3 – три
4 – тетра
5 – пента
6 – гекса
61. Строение комплексных соединений. Классификация. Номенклатура
Примеры:[AgI(NH3)2]OH – гидроксид
диамминсеребра(I);
[CoIII(NH3)6]Cl3 – хлорид
гексаамминкобальта(III);
[Cr2III(OH)(NH3)2]Cl4 – хлорид
нонаамминдигидроксодихрома(III).
62.
II. Номенклатура анионных комплексов
Греческим числительным называют
число лигандов.
Называют лиганды.
Называют комплексообразователь
латинским наименованием с
окончанием «-ат».
Отмечают валентность
комплексообразователя римской
цифрой в скобках.
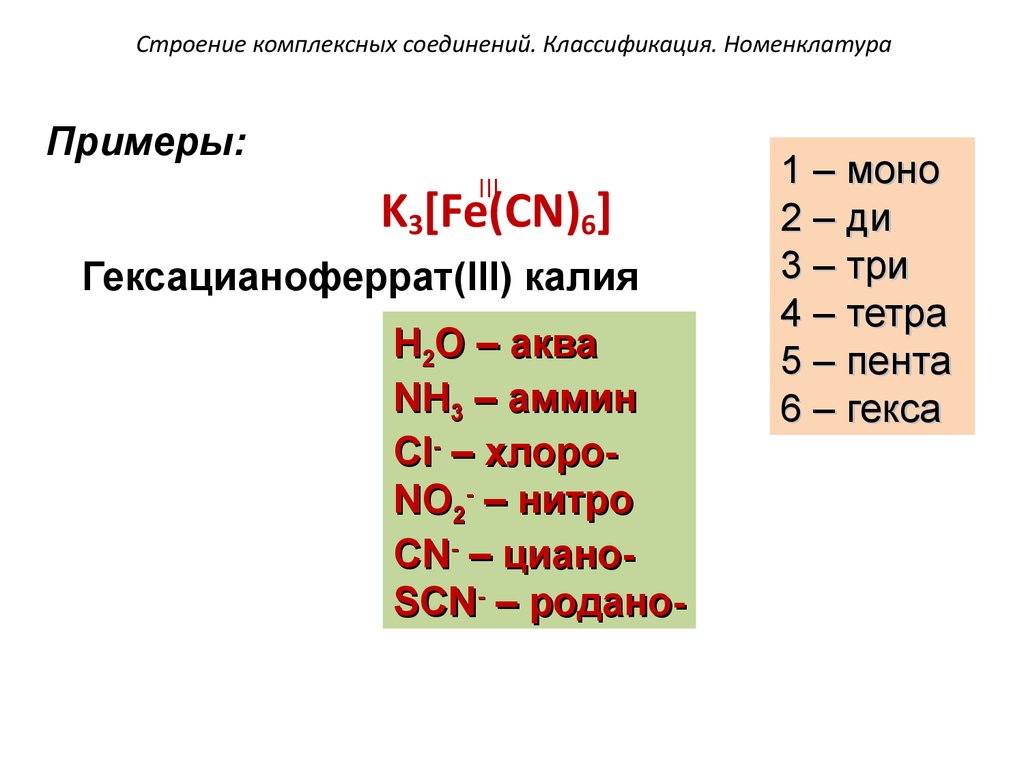
63. Строение комплексных соединений. Классификация. Номенклатура
Примеры:III
K3[Fe(CN)6]
Гексацианоферрат(III) калия
H2O – аква
NH3 – аммин
Cl- – хлороNO2- – нитро
CN- – цианоSCN- – родано-
1 – моно
2 – ди
3 – три
4 – тетра
5 – пента
6 – гекса
64. Строение комплексных соединений. Классификация. Номенклатура
Примеры:Ag – аргент-
[Fe(CN)6]3– – гексацианоферрат(III)ион
Au – аур-
[Ag(CN)2] – дицианоаргентат(I)ион
Fe – ферр-
–
K2[HgI4] – тетраиодомеркурат(II)
калия
K2[PtCl6] – гексахлороплатинат(IV)
калия
Cu – купрHg – меркурMn – манганNi – никколPb – плюмбSb – стибSn – станн-
65. III. Номенклатура нейтральных комплексов
• Греческим числительным называютчисло лигандов.
• Называют лиганды.
• Называют комплексообразователь
русским наименованием.
• Валентность комплексообразователя не
указывают.
66. Строение комплексных соединений. Классификация. Номенклатура
Примеры:[Ni(CO)4] – тетракарбонилникель;
[Co2(CO)8] – октакарбонилдикобальт;
[Al2Cl6] – гексахлородиалюминий;
[CoIIICl3(NH3)3] – триамминтрихлорокобальт;
[CoII (NO2)2(H2O)4] – тетрааквадинитрокобальт.
67. Типы комплексных соединений 1. Аквакомплексы
В водных растворах:• [Be(H2O)4]2+
• [Al(H2O)6]3+
• [Cr(H2O)6]3+ …
Кристаллогидраты:
• [Be(H2O)4]SO4
• [Al(H2O)6]Cl3
• [K(H2O)6][Cr(H2O)6](SO4)2
• [Cu(H2O)4]SO4·H2O
• [Ni(H2O)6]SO4·H2O
M
: OH2
68. Аквакомплексы
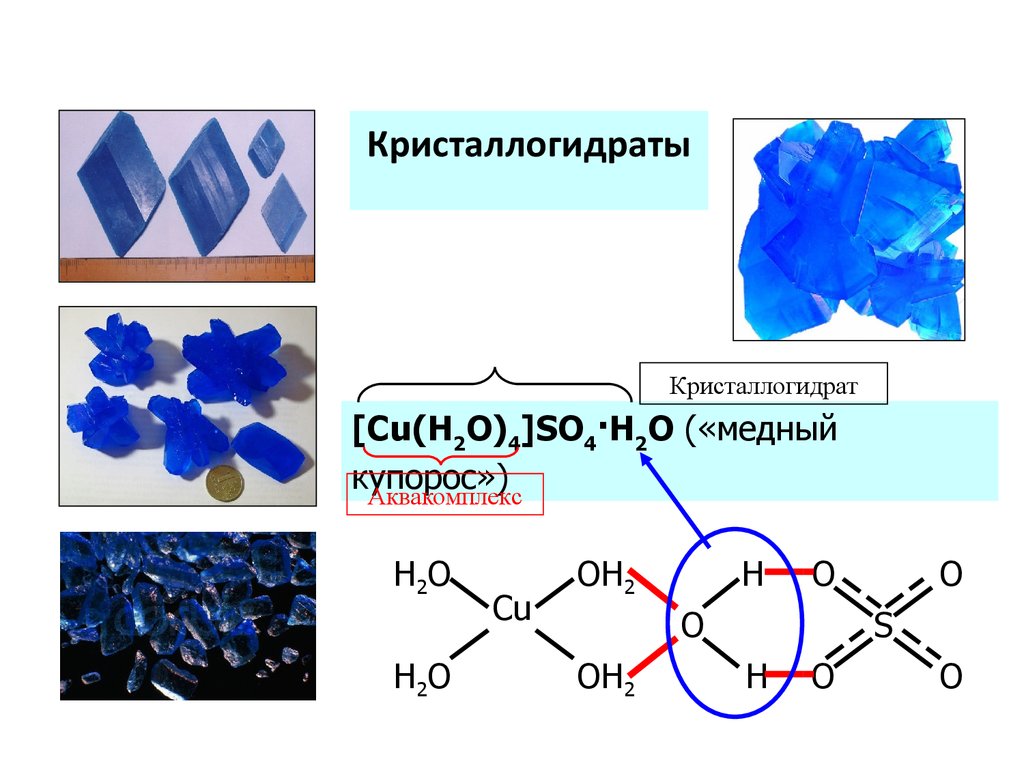
КристаллогидратыКристаллогидрат
[Cu(H2O)4]SO4·H2O («медный
купорос»)
Аквакомплекс
H2O
H2O
Cu
OH2
H
O
O
OH2
O
S
H
O
O
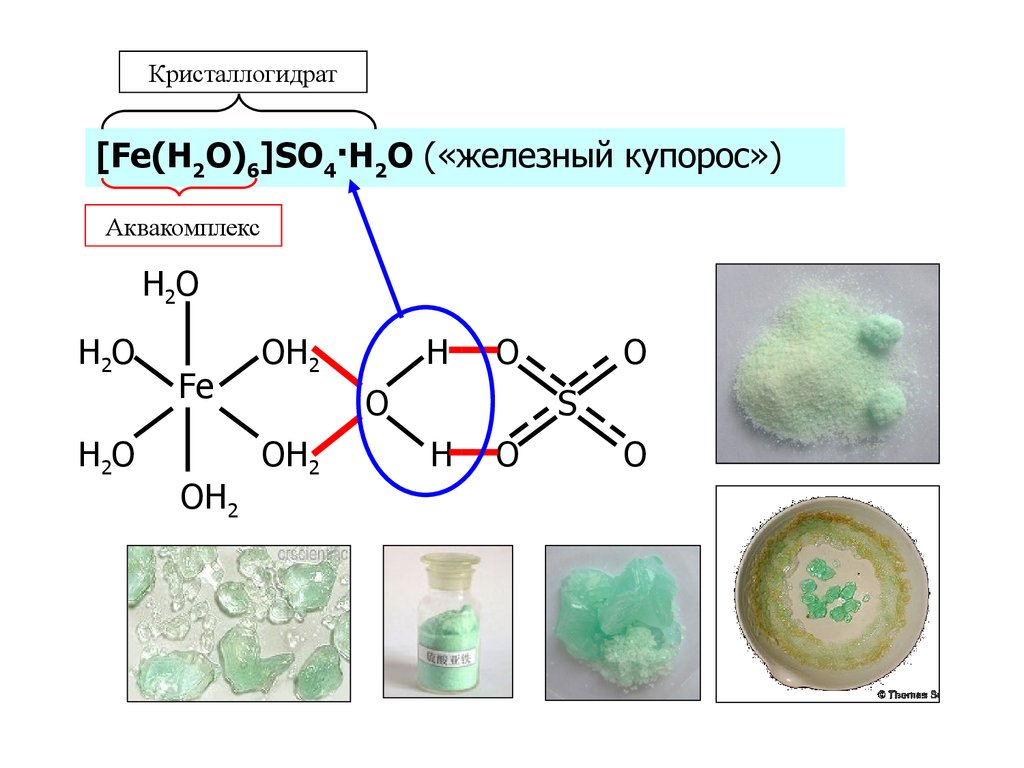
69. Аквакомплексы
Кристаллогидрат[Fe(H2O)6]SO4·H2O («железный купорос»)
Аквакомплекс
H2O
H2O
H2O
Fe
OH2
OH2
H
O
O
OH2
O
S
H
O
O
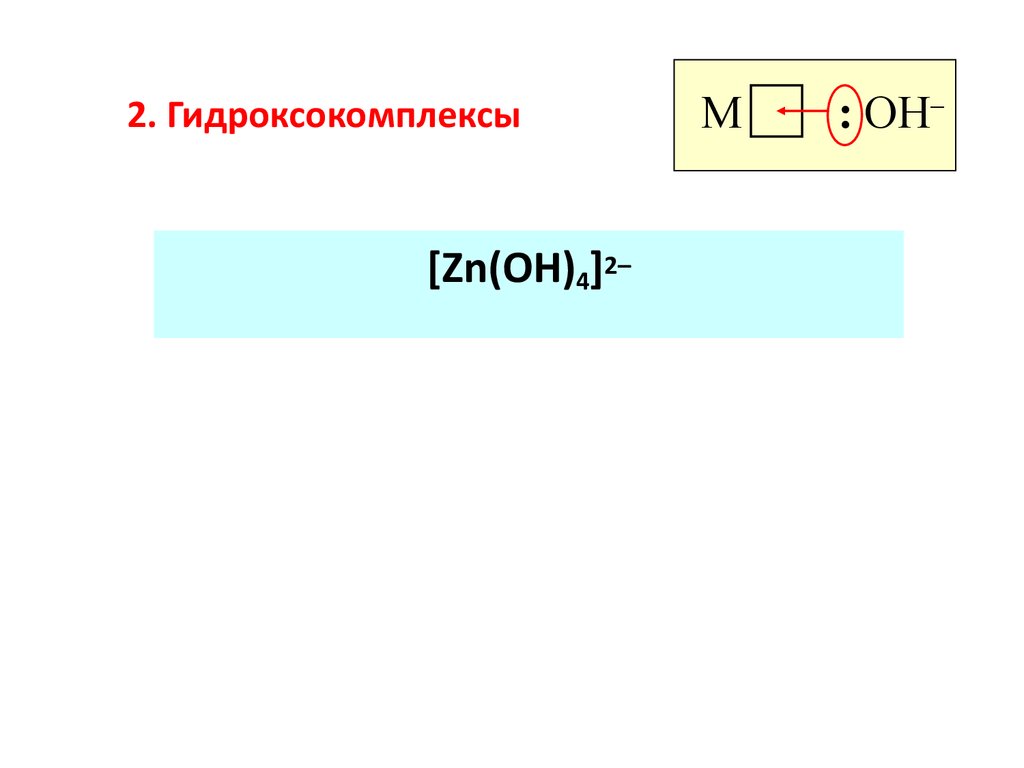
70. 2. Гидроксокомплексы
[Zn(OH)4]2–M
: OH–
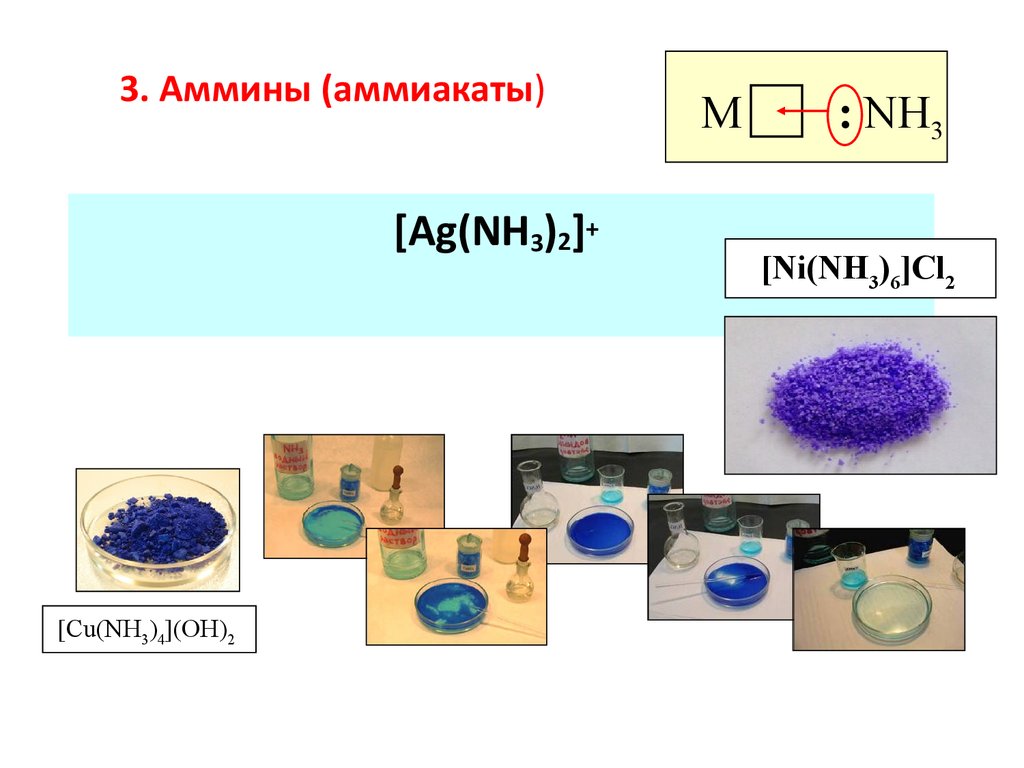
71. 3. Аммины (аммиакаты)
[Ag(NH3)2]+[Cu(NH3)4](OH)2
M
: NH3
[Ni(NH3)6]Cl2
72.
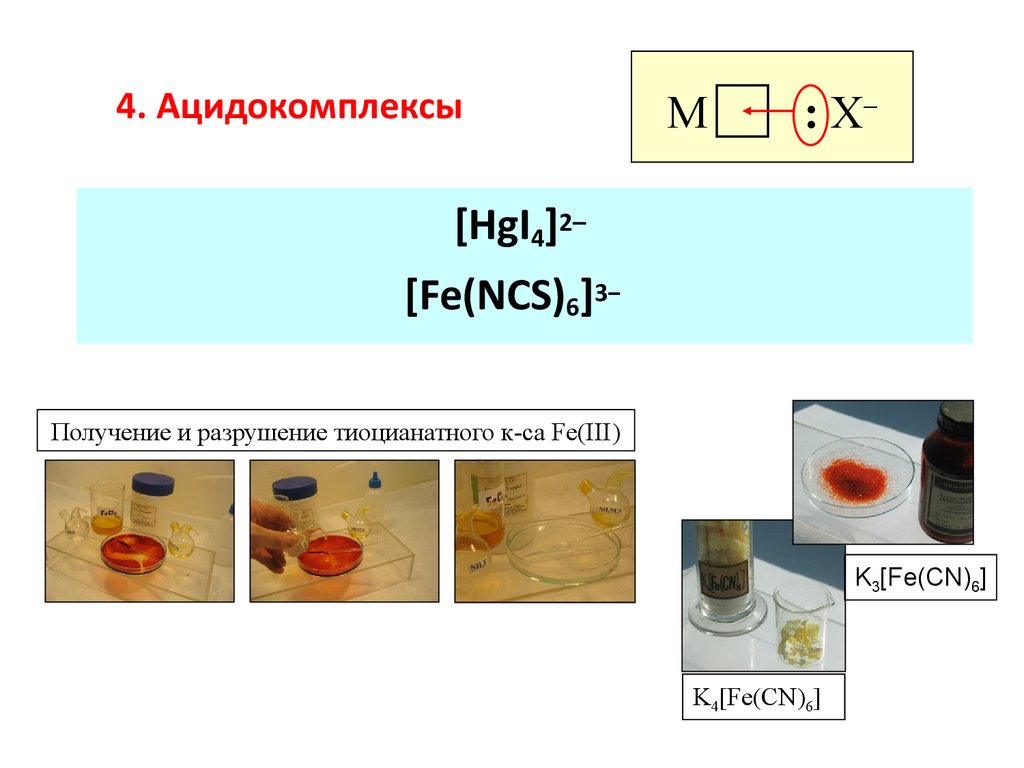
аммиакаты73. 4. Ацидокомплексы
M: Х–
[HgI4]2–
[Fe(NCS)6]3−
Получение и разрушение тиоцианатного к-са Fe(III)
K3[Fe(CN)6]
K4[Fe(CN)6]
74. 5. Гидридокомплексы
M: H–
Na[BH4]
Al[BH4]3
Li[AlH4]
Na[BH4]
75.
Устойчивость комплексных соединенийРазличают первичную и вторичную диссоциацию
комплексных соединений.
а) Первичная диссоциация – это диссоциация
комплексной соли на внутреннюю сферу и
ионы внешней сферы.
Идет легко по принципу сильных электролитов.
[Ag(NH3)2]Cl
[Ag(NH3)2]+ + Cl-
76.
Устойчивость комплексных соединенийб) Вторичная диссоциация – диссоциация
внутренней сферы:
[Ag(NH3)2]+
[Ag(NH3)]+
[Ag(NH3)2]+
[Ag(NH3)]+ + NH3
Ag+ + NH3
Ag+ + 2NH3
Она протекает незначительно.
77. Устойчивость комплексных соединений
Устойчивостькомплексных
ионов
характеризуется константой нестойкости (Кнест),
которая определяется на основании закона
действующих масс.
[Ag+] [NH3]2
KH =
= 5,89.10-8
[ [Ag(NH3)2]+ ]
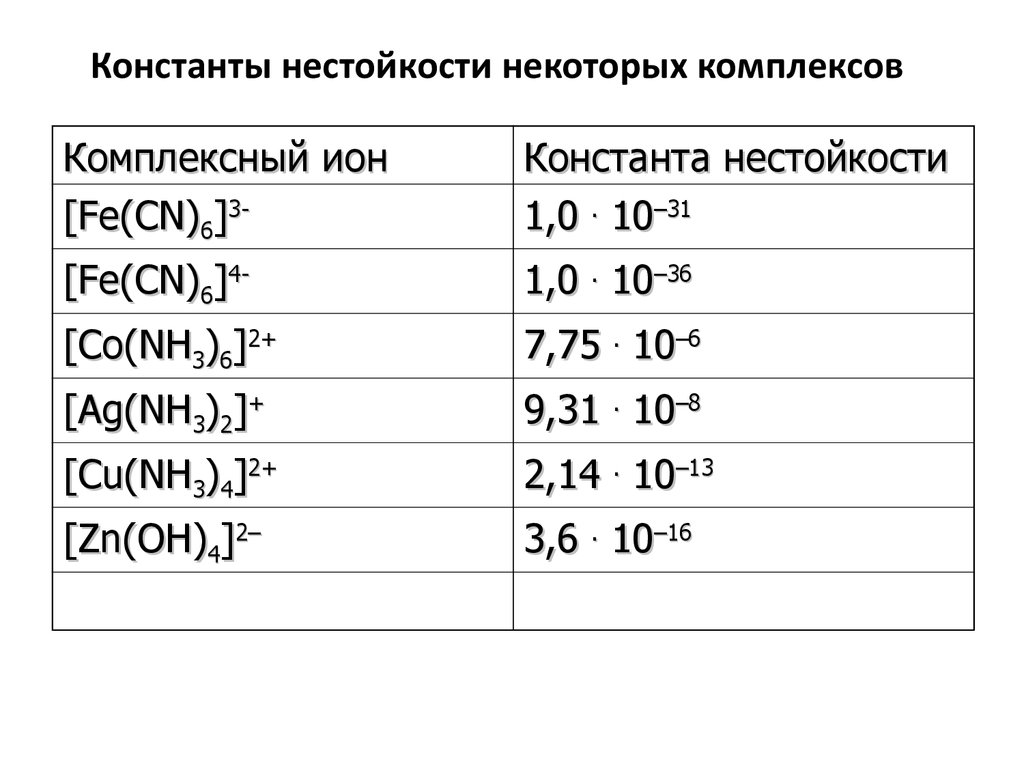
78. Константы нестойкости некоторых комплексов
Комплексный ион[Fe(CN)6]3-
Константа нестойкости
1,0 . 10–31
[Fe(CN)6]4-
1,0 . 10–36
[Co(NH3)6]2+
7,75 . 10–6
[Ag(NH3)2]+
9,31 . 10–8
[Cu(NH3)4]2+
2,14 . 10–13
[Zn(OH)4]2–
3,6 . 10–16
79. Устойчивость комплексных соединений
Константа нестойкости характеризуеттермодинамическую устойчивость комплекса,
которая зависит от прочности связей между
центральным атомом и лигандами.
Чем меньше значение Кнест, тем более
прочен комплекс, тем он устойчивее.
80. Устойчивость комплексных соединений
Мерой прочности комплекса является энергияразрыва связей, величина которой характеризуется
изменением энергии Гиббса (∆G) в результате
вторичной диссоциации. Уравнением изотермы:
DG = - RT ln Kнест.
0
DG = -2, 303RT lg Kнест. , где:
0
R = 8,314 Дж моль-1 К-1
T – температура, К
ln К = 2,303 . lgК
81.
Изомерия комплексных соединенийДля комплексных соединений характерны
следующие виды изомерии: сольватная (в
водных средах гидратная), ионизационная,
координационная, геометрическая ,
оптическая (зеркальная).
При изучении химиотерапии особое место
занимает геометрическая изомерия или
изомерия положения у комплексов,
содержащих не менее двух разных
лигандов.
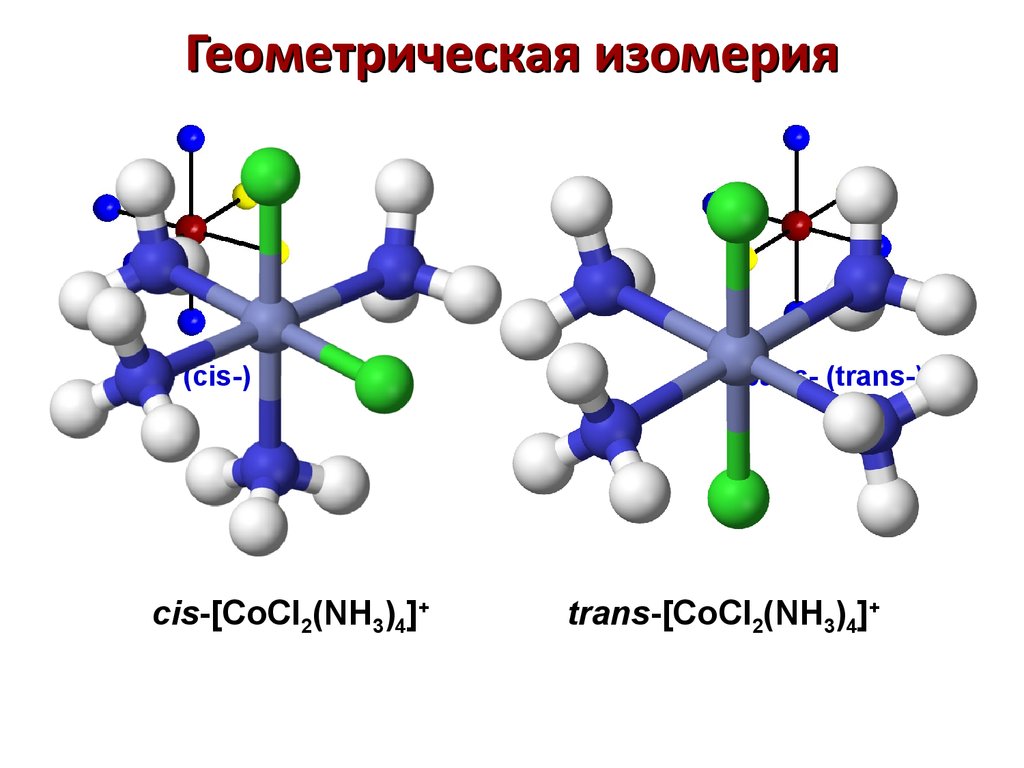
82. Геометрическая изомерия
цис- (cis-)cis-[CoCl2(NH3)4]+
транс- (trans-)
trans-[CoCl2(NH3)4]+
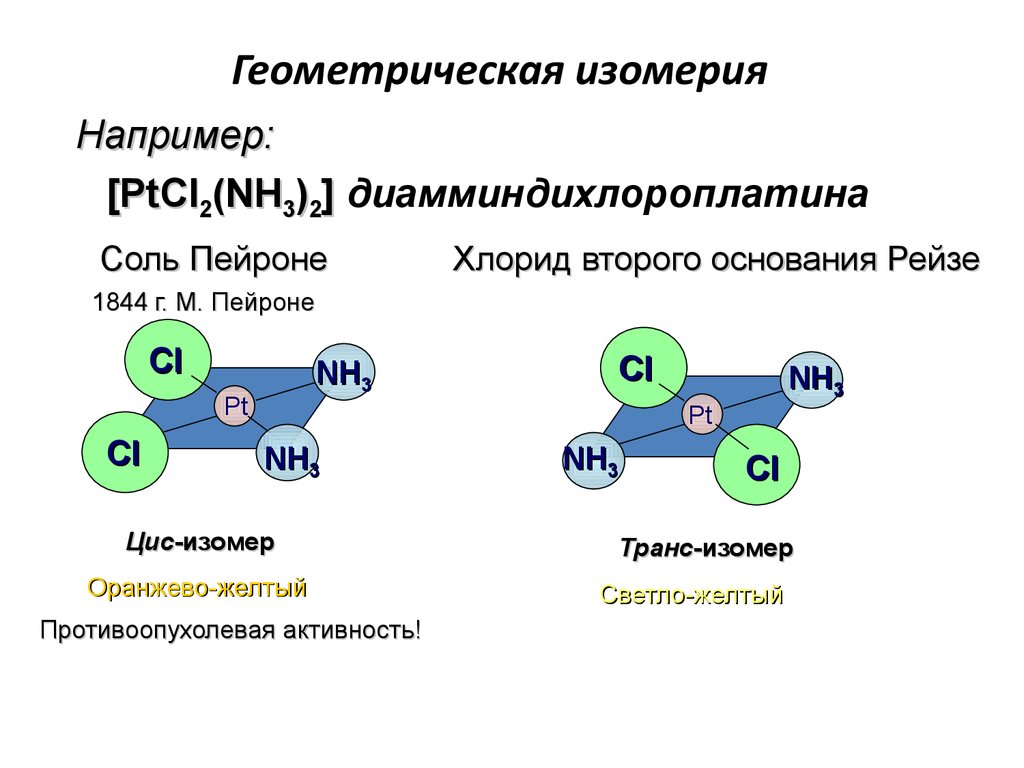
83. Геометрическая изомерия
Например:[PtCl2(NH3)2] диамминдихлороплатина
Соль Пейроне
Хлорид второго основания Рейзе
1844 г. М. Пейроне
Cl
Pt
Cl
Cl
NH3
NH3
Pt
NH3
Цис-изомер
Оранжево-желтый
Противоопухолевая активность!
NH3
Cl
Транс-изомер
Светло-желтый
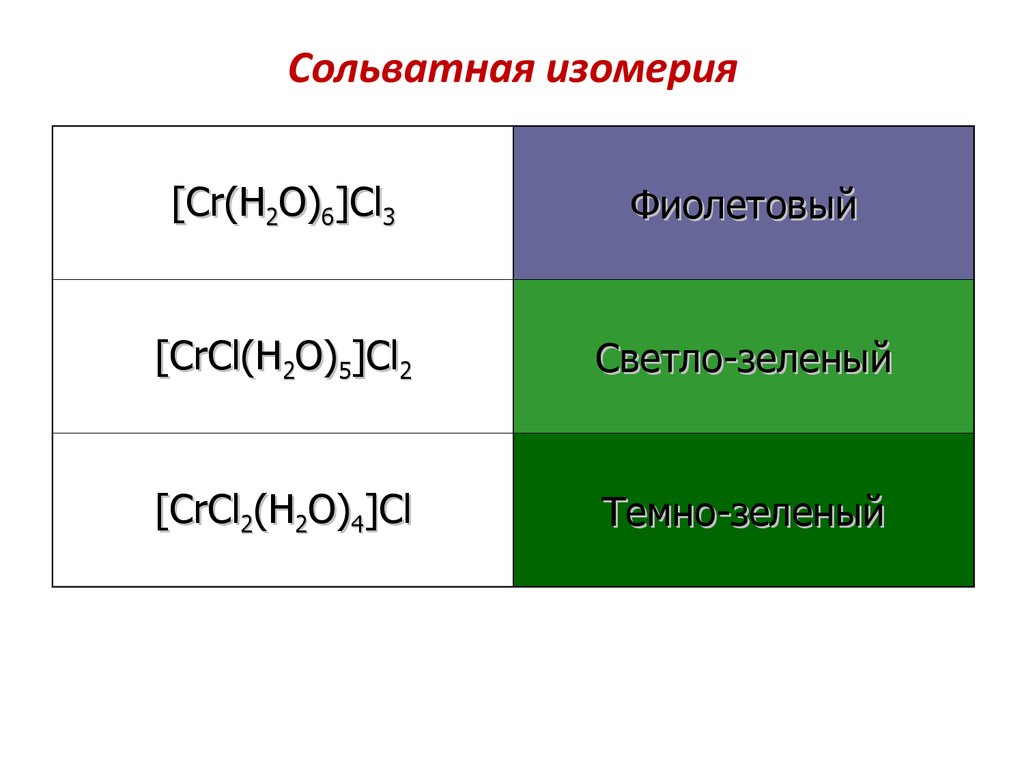
84. Сольватная изомерия
[Cr(H2O)6]Cl3Фиолетовый
[CrCl(H2O)5]Cl2
Светло-зеленый
[CrCl2(H2O)4]Cl
Темно-зеленый
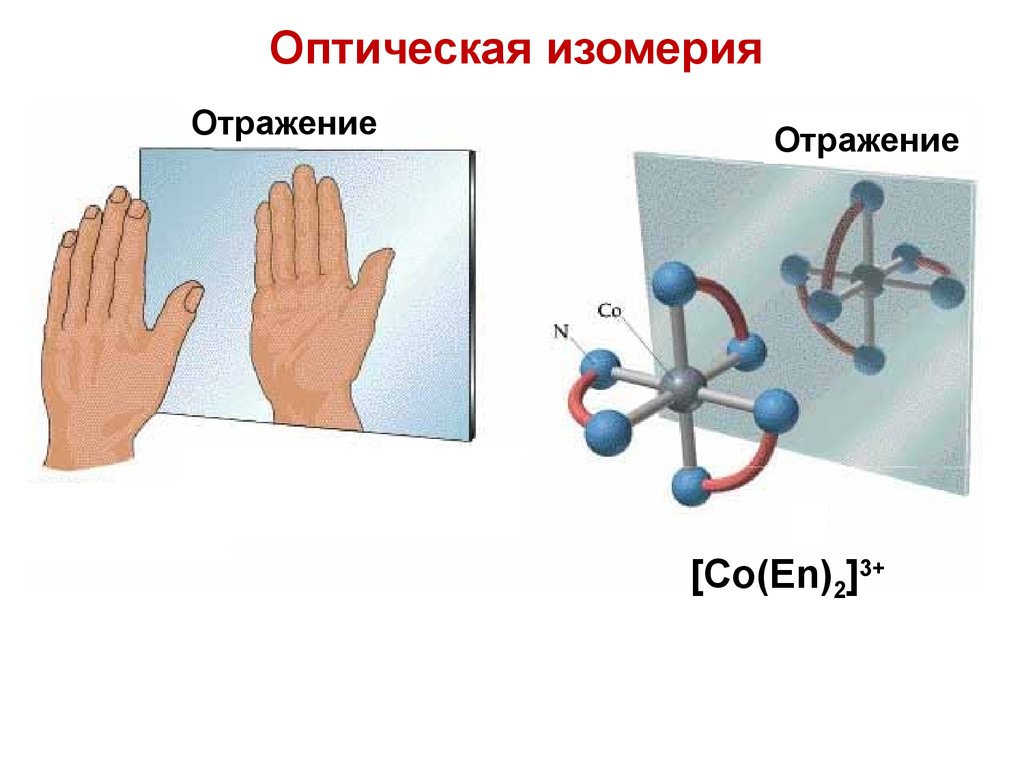
85.
Оптическая изомерияОтражение
Отражение
[Co(En)2]3+
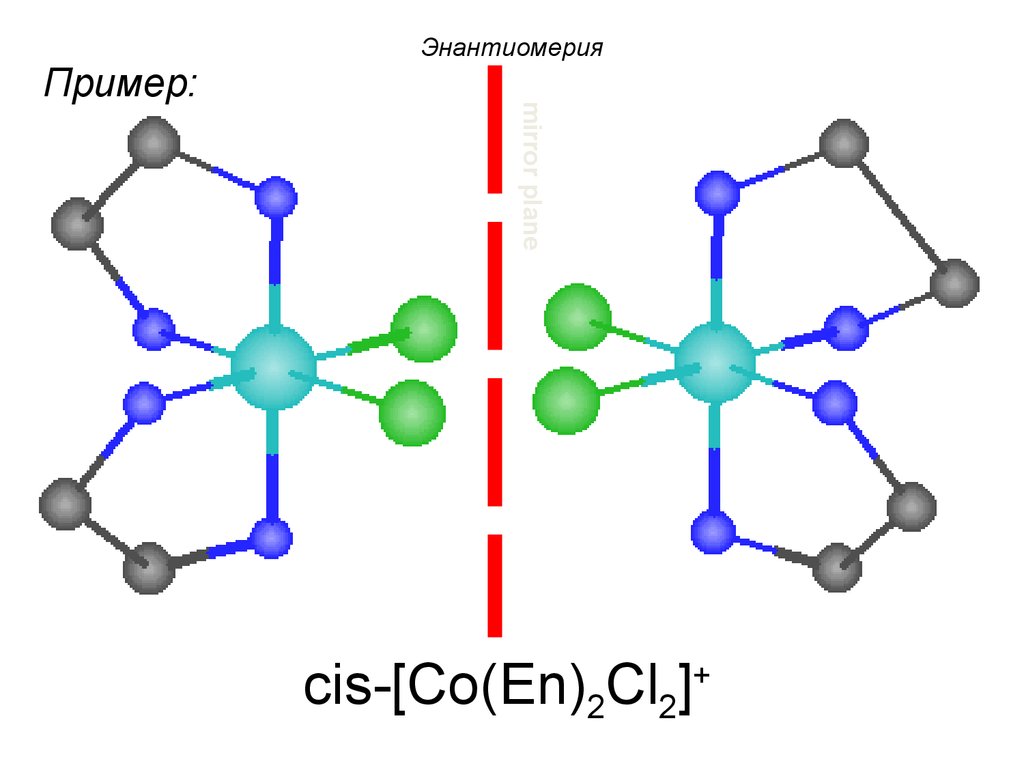
86.
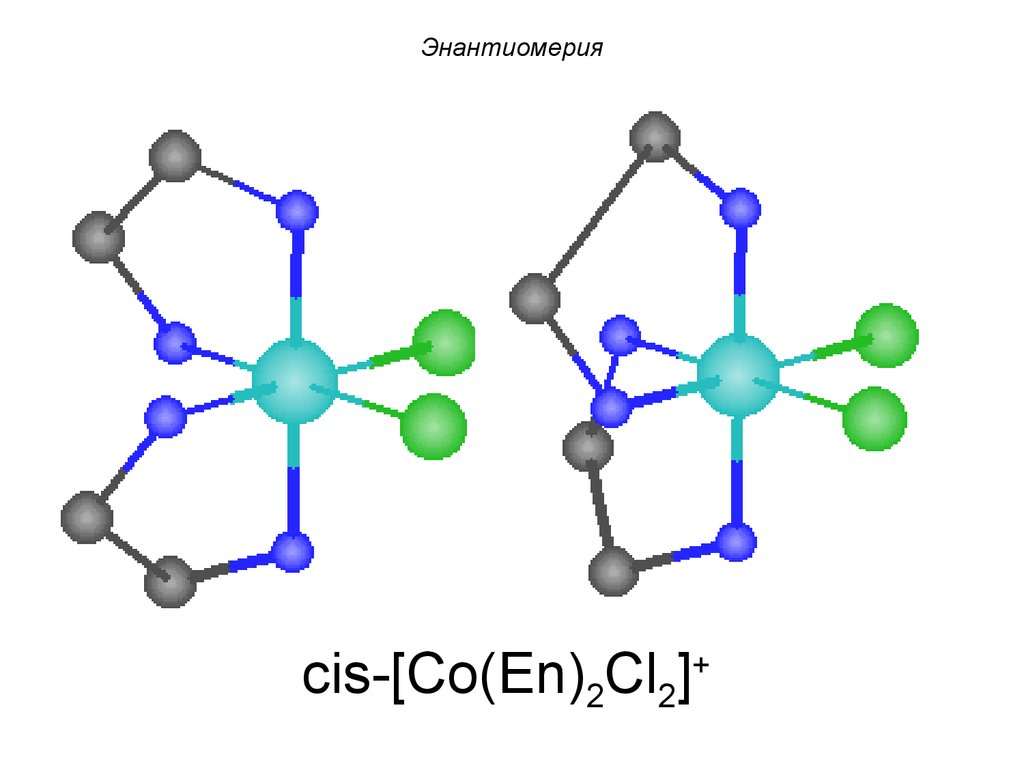
mirror planeПример:
Энантиомерия
cis-[Co(En)2Cl2]+
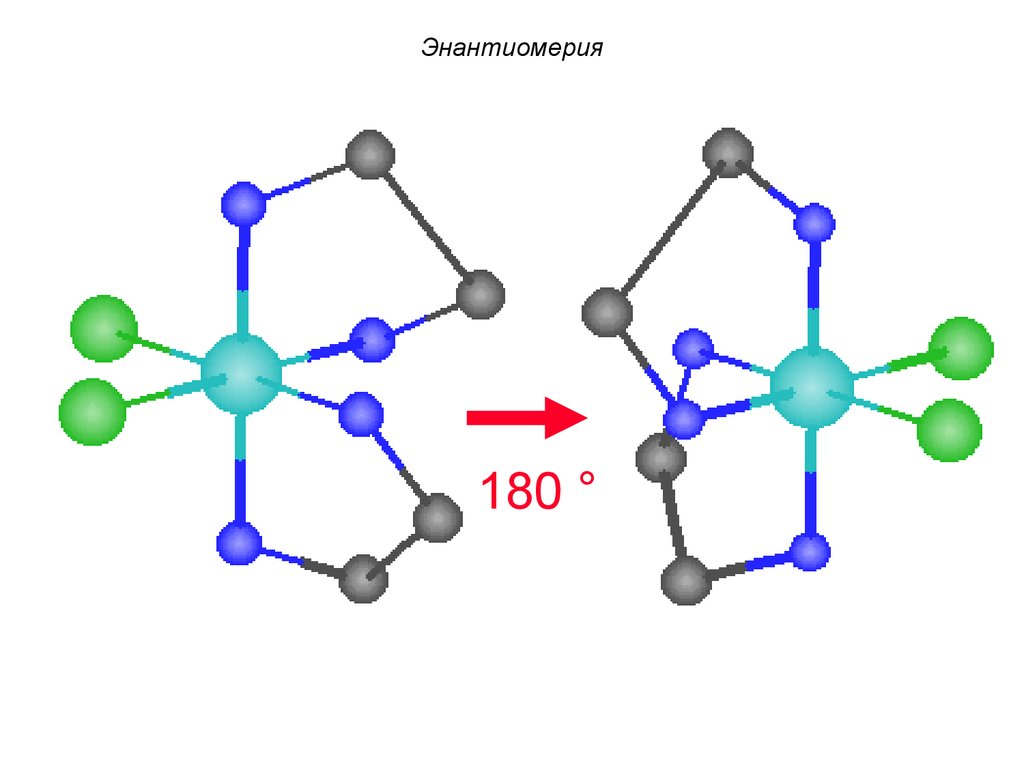
87.
Энантиомерия180 °
88.
Энантиомерияenantiome
rs
cis-[Co(En)2Cl2]+
89.
Хелаты. КомплексоныЛиганды могут присоединяться к
комплексообразователю посредством
одного или нескольких атомов, т.е. лиганды
обладают координационной емкостью дентатностью.
Монодентатные лиганды
присоединяются к комплексообразователю
одним атомом и образуют одну
координационную связь.
Например: H2O, NH3, Cl-, CN-, OH- и др.
90. Хелаты. Комплексоны. Краун-эфиры
Полидентатные лиганды присоединяютсяк
комплексообразователю
посредством
нескольких
атомов.
Например:
функциональные органические соединения.
Большое практическое значение имеют
комплексоны – полидентатные лиганды,
содержащие несколько
функциональных
групп и образующие прочные комплексы
практически со всеми двухзарядными ионами
металлов (Ca2+, Mg2+, Zn2+, Cu2+, Pt2+…).
91. Хелаты. Комплексоны. Краун-эфиры
Н-р, комплексон -I:NH2
CH2 CH2
NH2
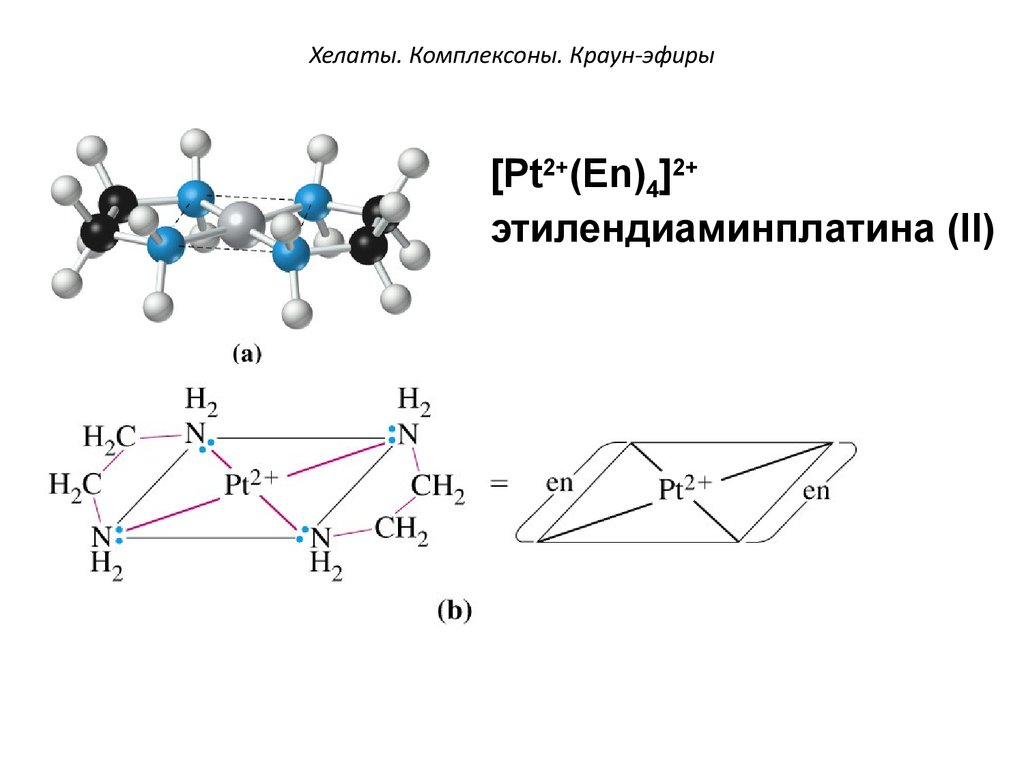
Этилендиамин
En
содержит два атома азота. За счет
электронных
пар
этих
атомов
этилендиамин
присоединяется
к
комплексообразователю
двумя
координационными связями.
92. Хелаты. Комплексоны. Краун-эфиры
[Pt2+(Еn)4]2+этилендиаминплатина (II)
93. Хелаты. Комплексоны. Краун-эфиры
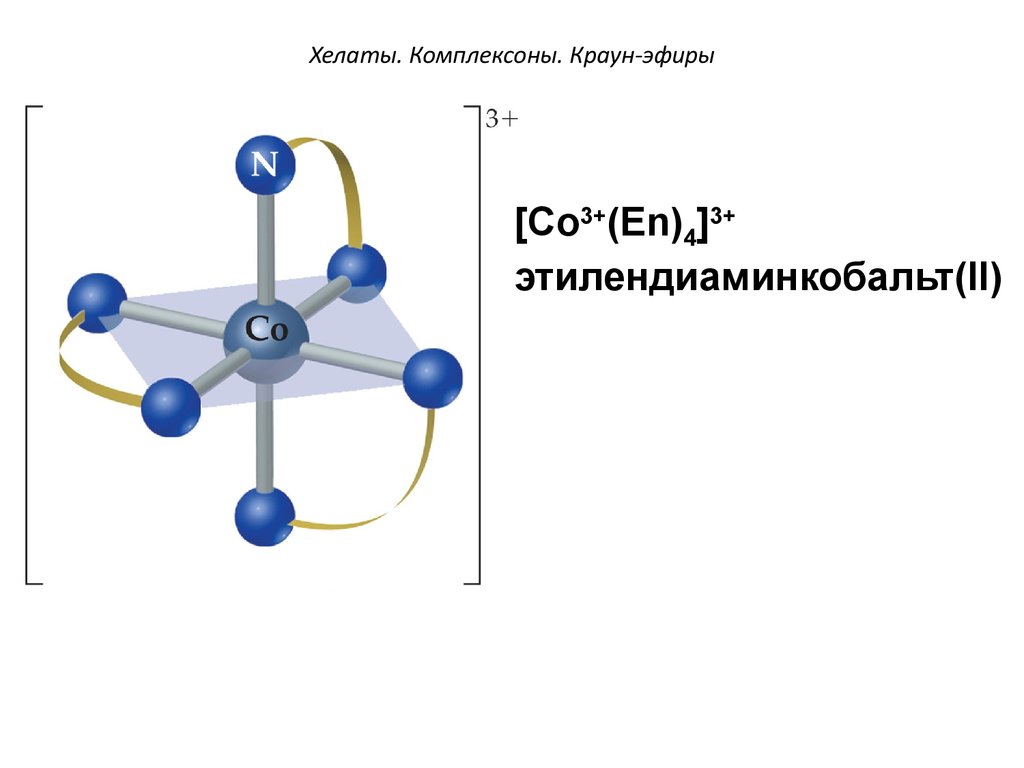
[Co3+(Еn)4]3+этилендиаминкобальт(II)
94. Хелаты. Комплексоны. Краун-эфиры
Для удобства координации молекулыполидентатных лигандов сворачиваются в циклы. В
таких комплексах комплексообразователь зажат
«клешней» лигандов.
Комплексы, содержащие полидентатные
лиганды, называются хелатами (от греч.
chelate - клешня).
Термин «хелат»,
1920 г. Морган и Дрю
Ni2+
95. Хелаты. Комплексоны. Краун-эфиры
H2CH2C
OH
OH
H2C
O
H2C
O
H
Cu
H
O
CH2
O CH2
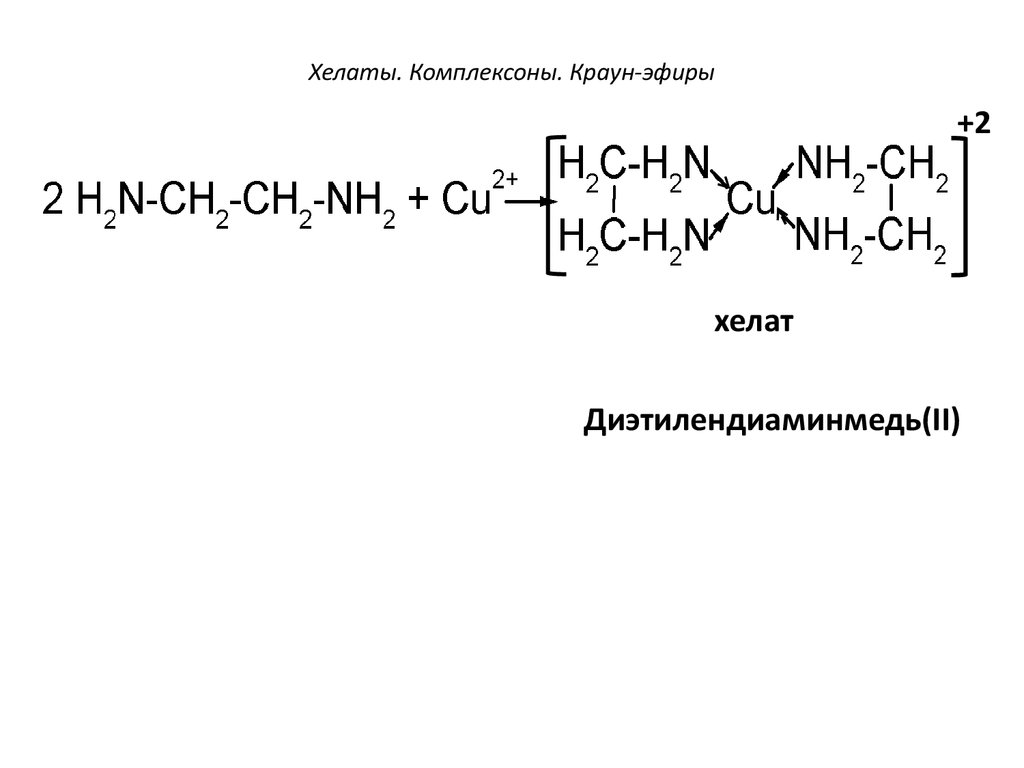
96. Хелаты. Комплексоны. Краун-эфиры
+2хелат
Диэтилендиаминмедь(II)
97. Хелаты. Комплексоны. Краун-эфиры
Обычно хелаты гораздо устойчивеекомплексных соединений, содержащих
монодентатные лиганды, т.к.
комплексообразователь связан с лигандами
несколькими донорно-акцепторными связями.
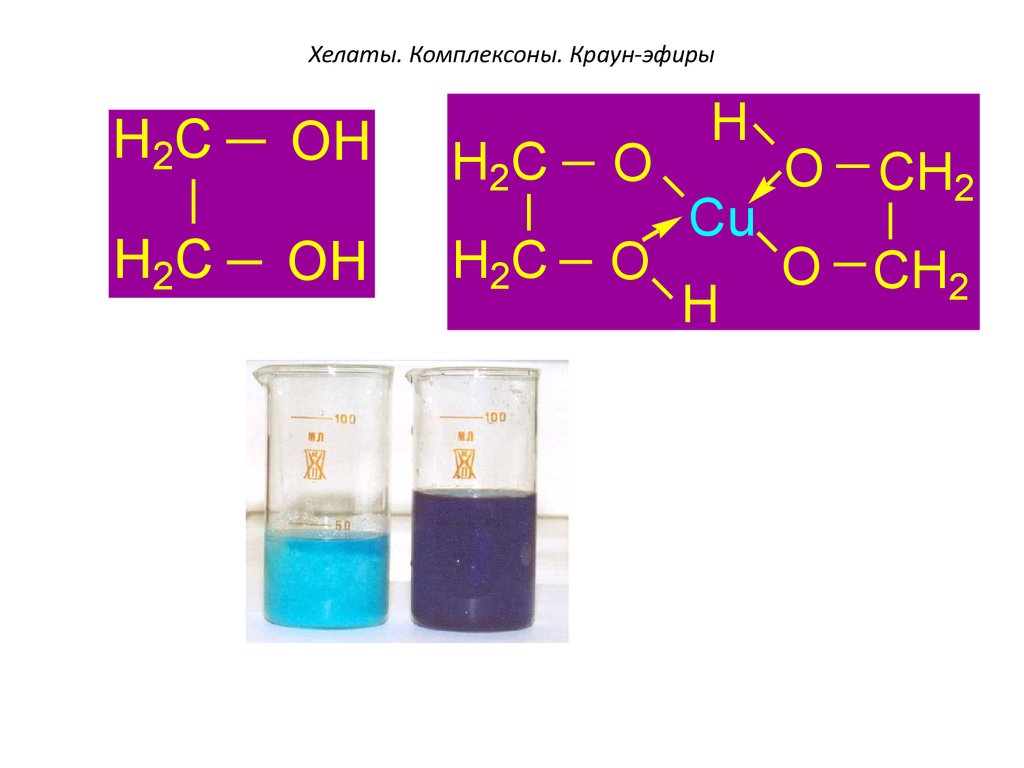
Наиболее известными
комплексонами высшего порядка являются:
• комплексон -II этилендиаминтетрауксусная
кислота (ЭДТА)
•комплексон- III двузамещенная натриевая
соль ЭДТА - Трилон Б: Na2[H2Tr]
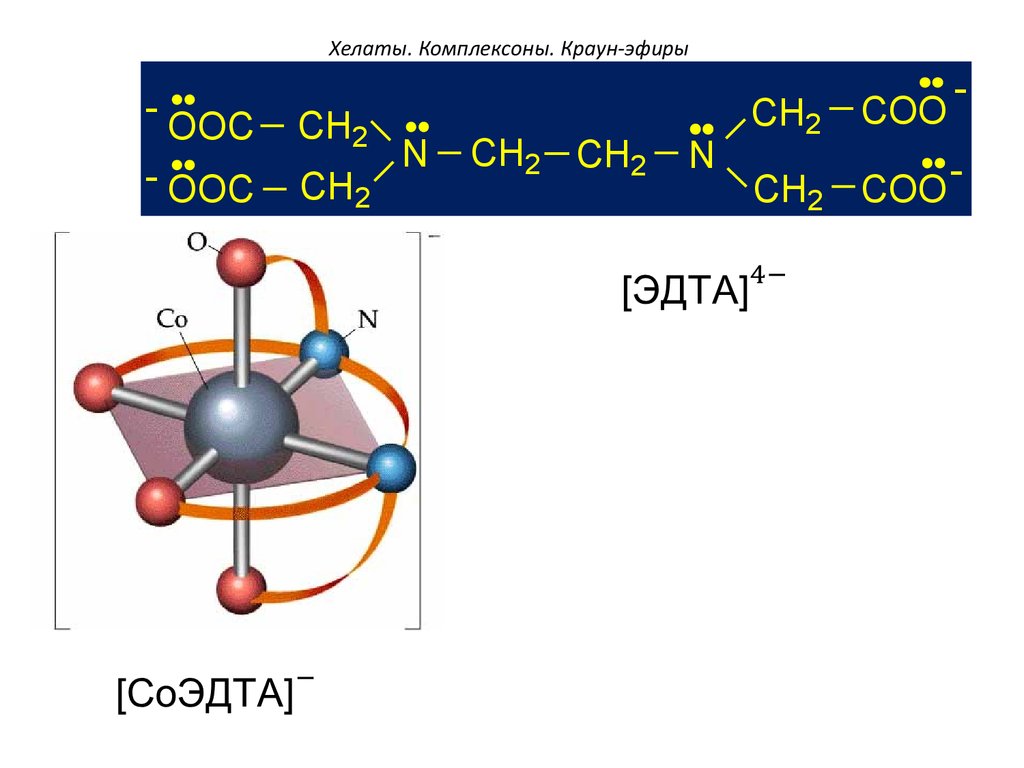
98. Хелаты. Комплексоны. Краун-эфиры
- OOCCH2
- OOC
CH2
N
CH2 CH2
N
CH2
COO
-
CH2 COO -
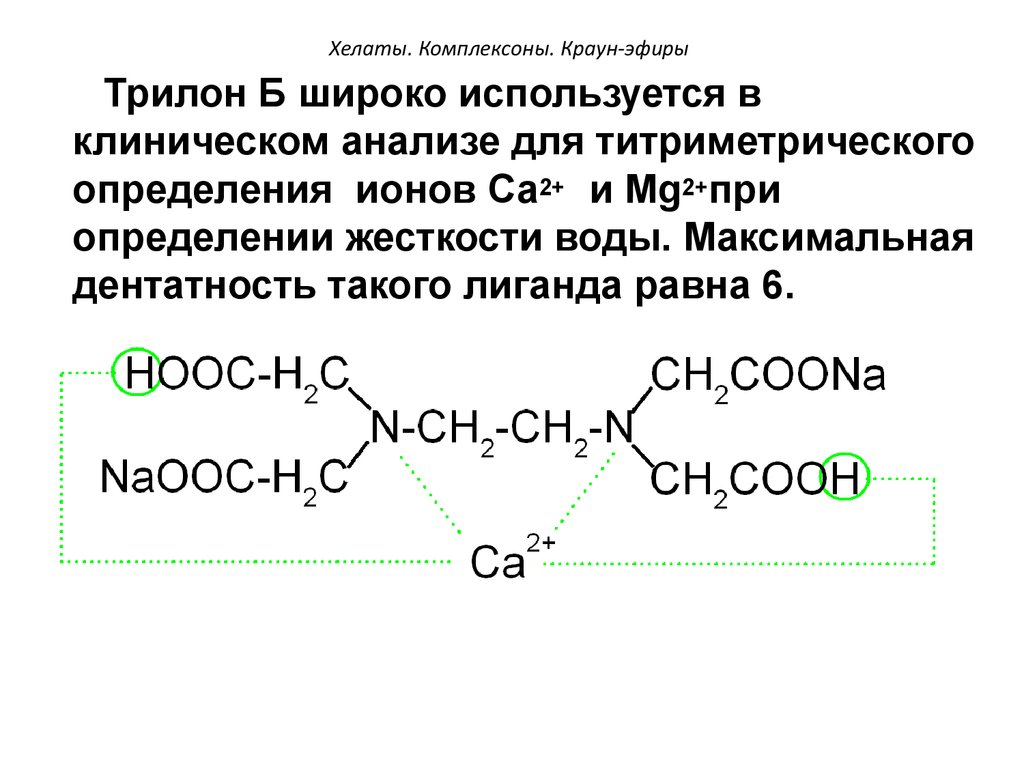
99. Хелаты. Комплексоны. Краун-эфиры
Трилон Б широко используется вклиническом анализе для титриметрического
определения ионов Са2+ и Мg2+при
определении жесткости воды. Максимальная
дентатность такого лиганда равна 6.
100. Хелаты. Комплексоны. Краун-эфиры
Особый тип полидентатных лигандовпредставляет собой циклические эфиры или
краун-эфиры (от анг. crown - корона).
В них донорные атомы кислорода заключены
в плоский цикл определенного размера.
Краун-эфиры содержат от 4 до 12 атомов
кислорода (краун-4, краун-5 и т.д).
Полости краун-эфиров имеют строго
определенные размеры. Поэтому краун-эфиры
могут избирательно связывать ионы металлов,
размеры которых близки к размерам полости.
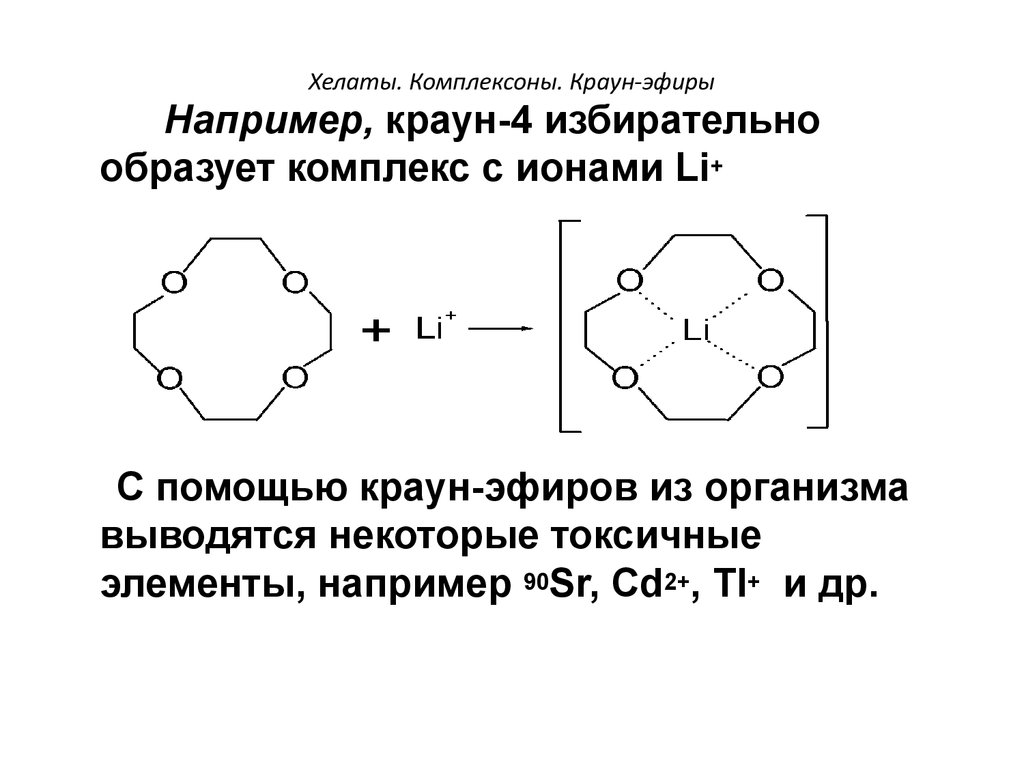
101. Хелаты. Комплексоны. Краун-эфиры
Например, краун-4 избирательнообразует комплекс с ионами Li+
+
С помощью краун-эфиров из организма
выводятся некоторые токсичные
элементы, например 90Sr, Cd2+, Tl+ и др.
102.
СПАСИБО ЗАВАШЕ
ВНИМАНИЕ!

















![Квадратный комплекс [Pt2+(NH3)2Cl2] Квадратный комплекс [Pt2+(NH3)2Cl2]](http://cf.ppt-online.org/files/slide/w/wmybEB3IUAXdv0tzocupeD769rqOMi84shPGKY/slide-45.jpg)

![КЧ = 8, [СoF8]5- квадратная антипризма КЧ = 8, [СoF8]5- квадратная антипризма](http://cf.ppt-online.org/files/slide/w/wmybEB3IUAXdv0tzocupeD769rqOMi84shPGKY/slide-51.jpg)


























 medicine
medicine biology
biology chemistry
chemistry








