Similar presentations:
Полимеры. Классификация, применение
1.
Литература1.«Высокомолекулярные соединения» под редакцией А.Б.
Зезина, М: Юрайт, 2016
2.Ю.Д. Семчиков. «Высокомолекулярные соединения» М:
Академия, 2003.
2. В.В. Киреев. «Высокомолекулярные соединения» М: Юрайт,
2013.
3. А.А. Тагер. «Физико-химия полимеров», М: Научный мир,
2007
4. В.Н. Кулезнев, В.А. Шершнев, «Химия и физика
полимеров», М: КолосС, 2007
Свободные электронные источники
Методические пособия к практикуму по высокомолекулярным
соединениям //
http://www.vmsmsu.ru/what.html
Макрогалерея // http://www. pslc.ws/russian/index.htm
welcome.vmsmsu.ru
1
2.
• Полимеры состоят из макромолекул.Немецкие ученые Вернер Кун и Герман Штаудингер
предложили
рассматривать макромолекулу как
длинную, гибкую,
цепную конструкцию,
состоящую из большого числа (поли-)
повторяющихся мономерных звеньев одинаковой или
различной химической природы
2
...
3.
КЛАССИФИКАЦИЯ ПОЛИМЕРОВпо происхождению
1. природные
2. искусственные
3. синтетические
по типу мономерных
звеньев
1. гомополимеры
2. сополимеры
а) статистические
б) чередующиеся
в) блочные
г) привитые
по геометрии основной цепи
1. линейные
по типу атомов в
2. разветвленные
молекуле
3. гребнеобразные
органические
4. лестничные
элементоорганические
5. дендритные и др.
неорганические
по функциональным
группам в макромолекуле
углеводороды
спирты
кислоты
амиды
амины
простые и сложные эфиры
ацетали и др.
2222
3
4.
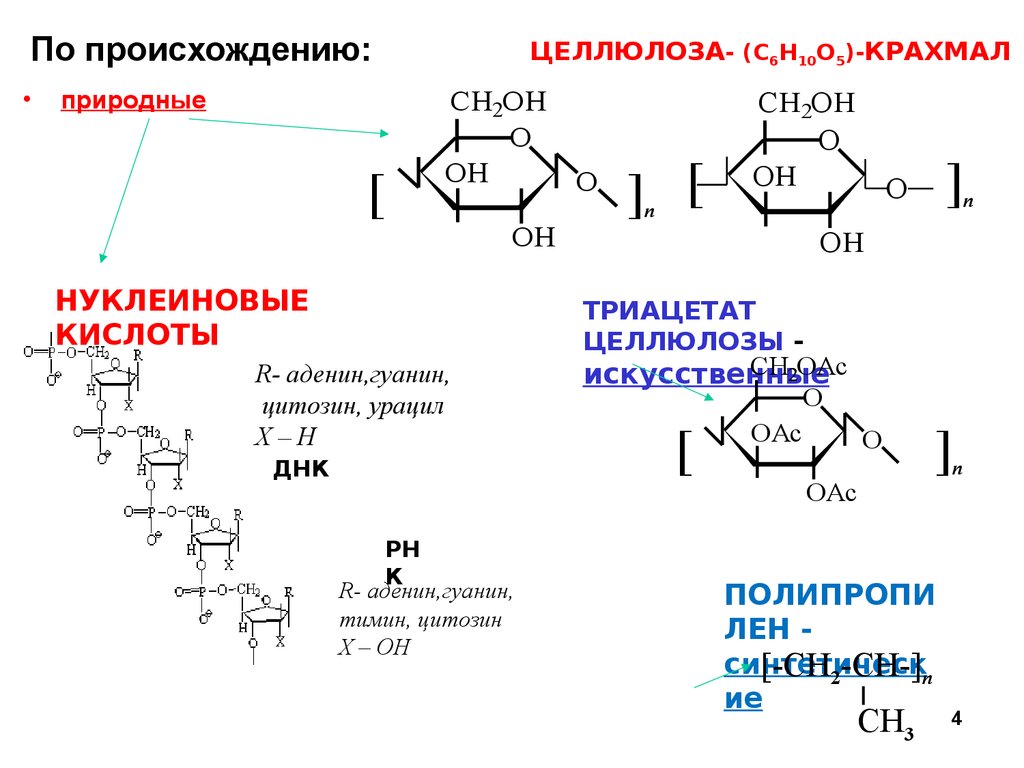
По происхождению:природные
[
ЦЕЛЛЮЛОЗА- (С6H10O5)-КРАХМАЛ
CH2OH
O
OH
O
] [
CH2OH
O
OH
n
OH
НУКЛЕИНОВЫЕ
КИСЛОТЫ
R- аденин,гуанин,
цитозин, урацил
Х–Н
ДНК
]
O
n
OH
ТРИАЦЕТАТ
ЦЕЛЛЮЛОЗЫ CH2OAc
искусственные
O
OAc
O
[
]
n
OAc
РН
К
R- аденин,гуанин,
тимин, цитозин
Х – ОН
ПОЛИПРОПИ
ЛЕН синтетическ
[-CH2-CH-]n
ие
CH3
4
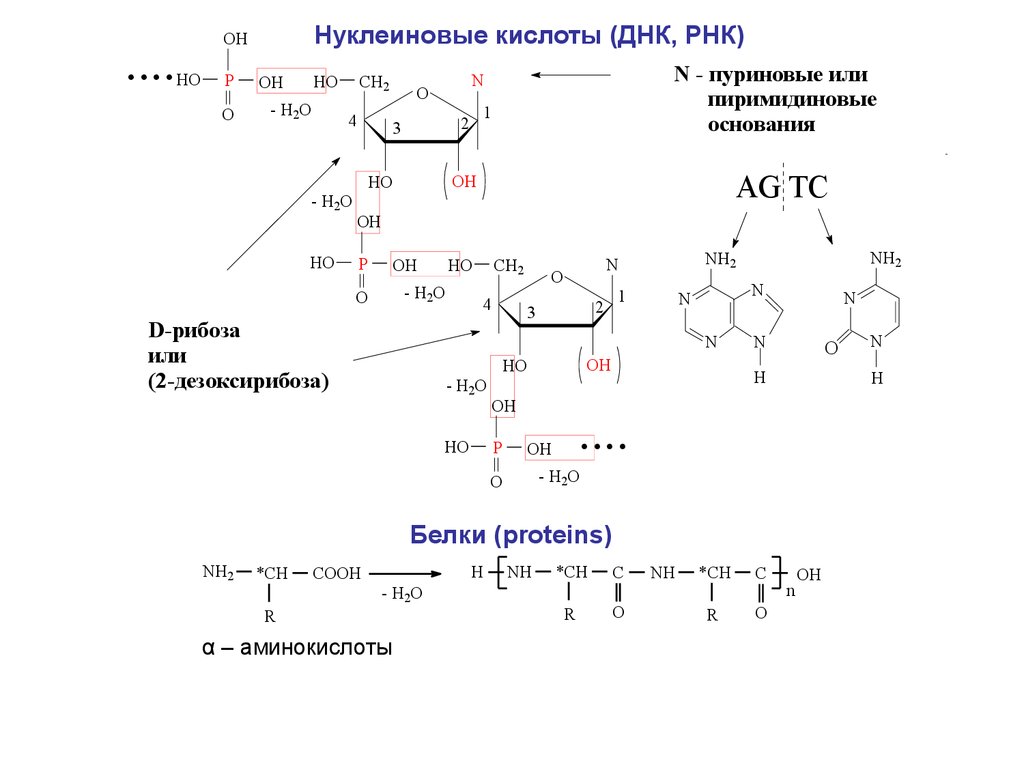
5.
....Нуклеиновые кислоты (ДНК, РНК)
OH
HO
P
O
HO
OH
- H2O
CH2
4
N - пуриновые или
пиримидиновые
основания
N
O
1
2
3
ю
- H2O
HO
AG TC
OH
HO
OH
P
OH
HO
- H2O
O
D-рибоза
или
(2-дезоксирибоза)
CH2
4
2
3
1
N
N
N
OH
HO
- H2O
HO
OH
P
NH2
NH2
N
O
N
N
O
H
H
....
OH
- H2O
O
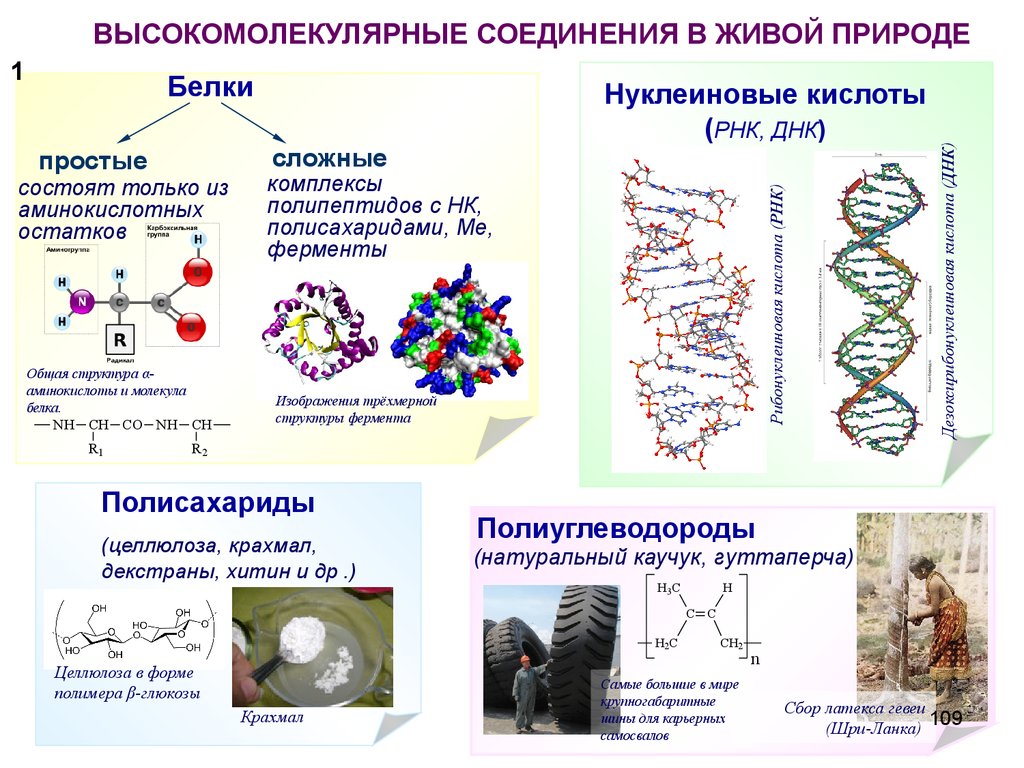
Белки (proteins)
NH2
*CH
H
COOH
- H2O
R
α – аминокислоты
NH
*CH
R
C
O
NH
*CH
C
R
O
N
n
OH
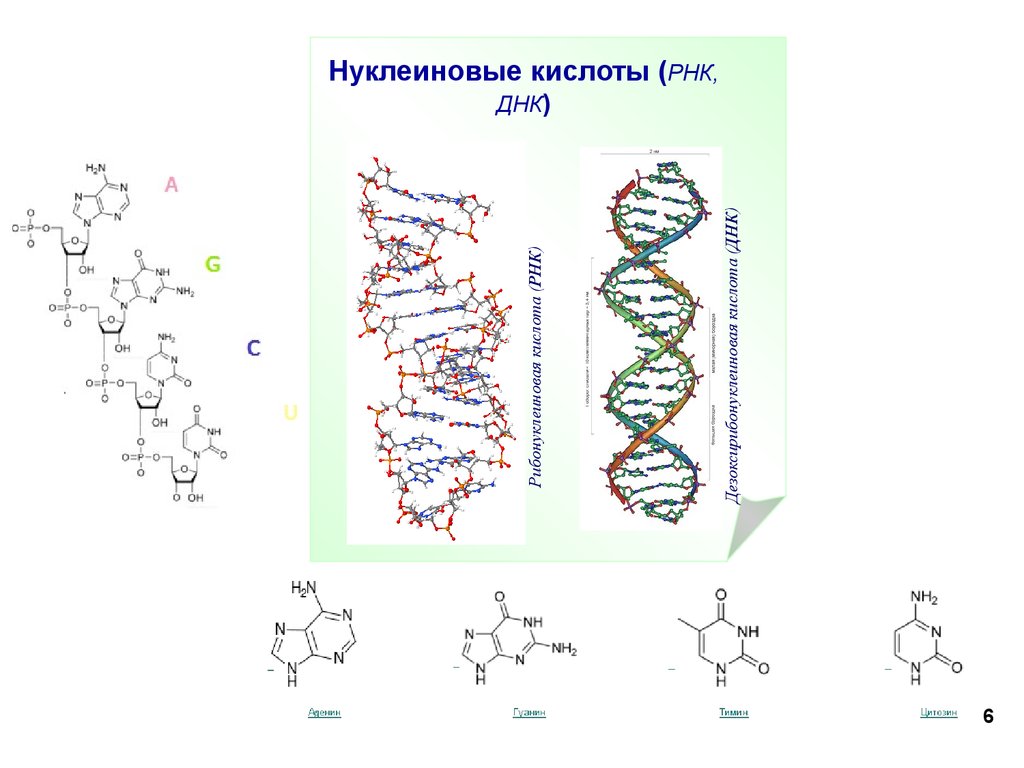
6.
Дезоксирибонуклеиновая кислота (ДНК)Рибонуклеиновая кислота (РНК)
Нуклеиновые кислоты (РНК,
ДНК)
6
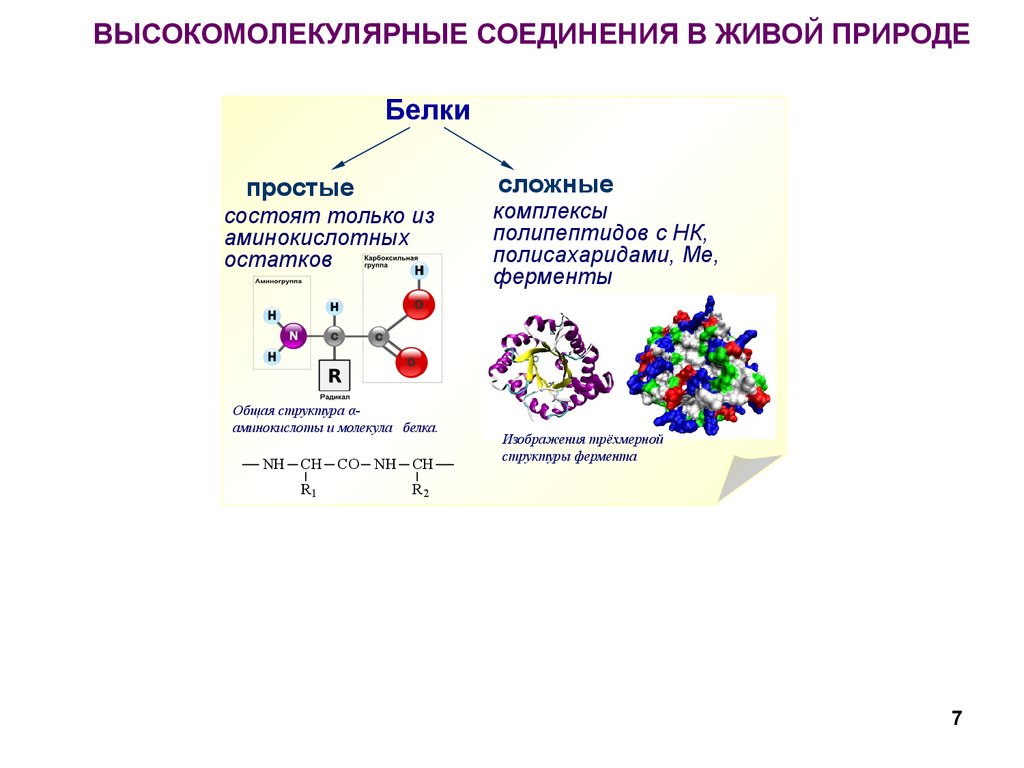
7. ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ В ЖИВОЙ ПРИРОДЕ
Белкисложные
простые
состоят только из
аминокислотных
остатков
Общая структура αаминокислоты и молекула белка.
NH
CH CO NH
CH
R1
R2
комплексы
полипептидов с НК,
полисахаридами, Ме,
ферменты
Изображения трёхмерной
структуры фермента
7
8. Сбор латекса гевеи-
Сбор латексагевеизагустевшего млечного
сока, вытекшего из
порезов на коре дерева
гевеи.
8
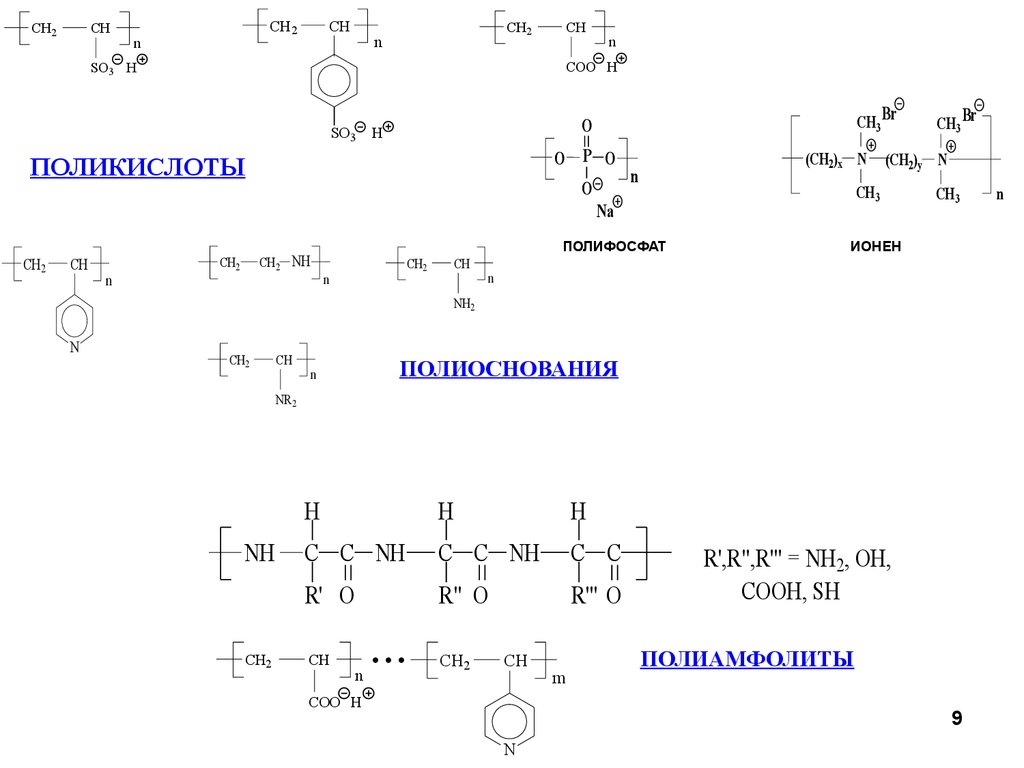
9.
CH2CH
CH2
n
CH
CH2
n
CH
n
COO H
SO3 H
SO3
CH3 Br
O
H
O P O
ПОЛИКИСЛОТЫ
O
(CH2)x N
n
CH2
CH
n
ПОЛИФОСФАТ
CH2 NH
CH2
CH2
n
CH
(CH2)y N
CH3
Na
CH3 Br
CH3
ИОНЕН
n
NH2
N
CH2
CH
ПОЛИОСНОВАНИЯ
n
NR2
NH
CH2
H
H
H
C C NH
C C NH
C C
R' O
R" O
R''' O
CH
n
...
CH2
CH
COO H
m
R',R",R'" = NH2, OH,
COOH, SH
ПОЛИАМФОЛИТЫ
9
N
n
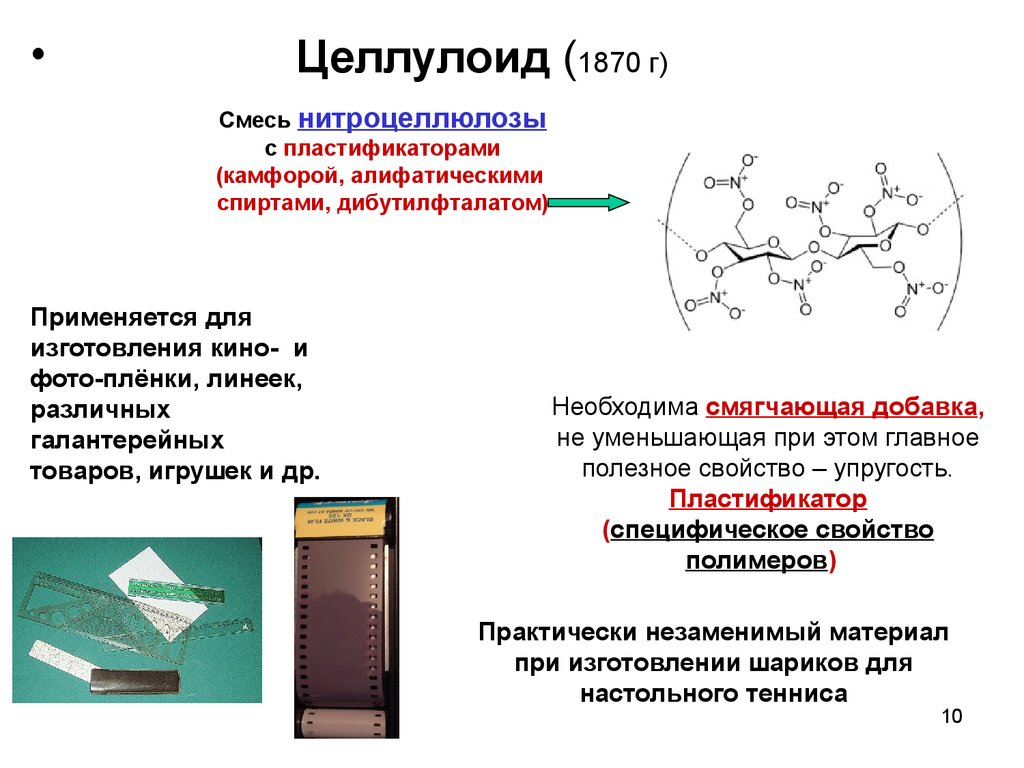
10.
Целлулоид (1870 г)
Смесь нитроцеллюлозы
с пластификаторами
(камфорой, алифатическими
спиртами, дибутилфталатом)
Применяется для
изготовления кино- и
фото-плёнки, линеек,
различных
галантерейных
товаров, игрушек и др.
Необходима смягчающая добавка,
не уменьшающая при этом главное
полезное свойство – упругость.
Пластификатор
(специфическое свойство
полимеров)
Практически незаменимый материал
при изготовлении шариков для
настольного тенниса
10
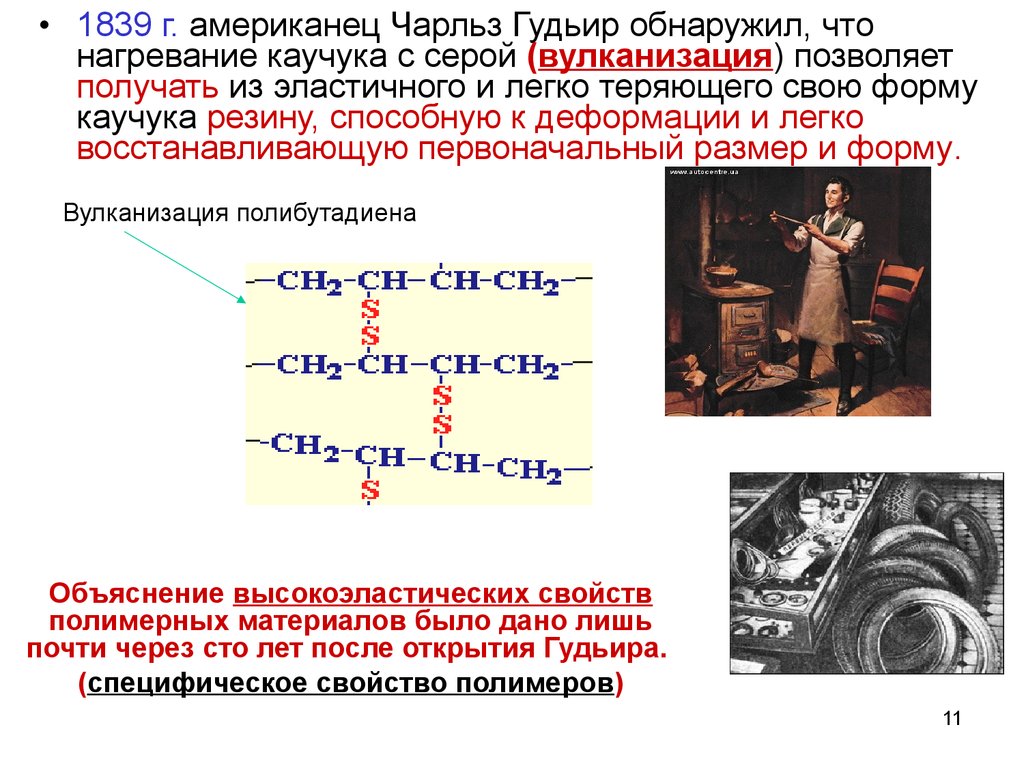
11.
• 1839 г. американец Чарльз Гудьир обнаружил, чтонагревание каучука с серой (вулканизация) позволяет
получать из эластичного и легко теряющего свою форму
каучука резину, способную к деформации и легко
восстанавливающую первоначальный размер и форму.
Вулканизация полибутадиена
Объяснение высокоэластических свойств
полимерных материалов было дано лишь
почти через сто лет после открытия Гудьира.
(специфическое свойство полимеров)
11
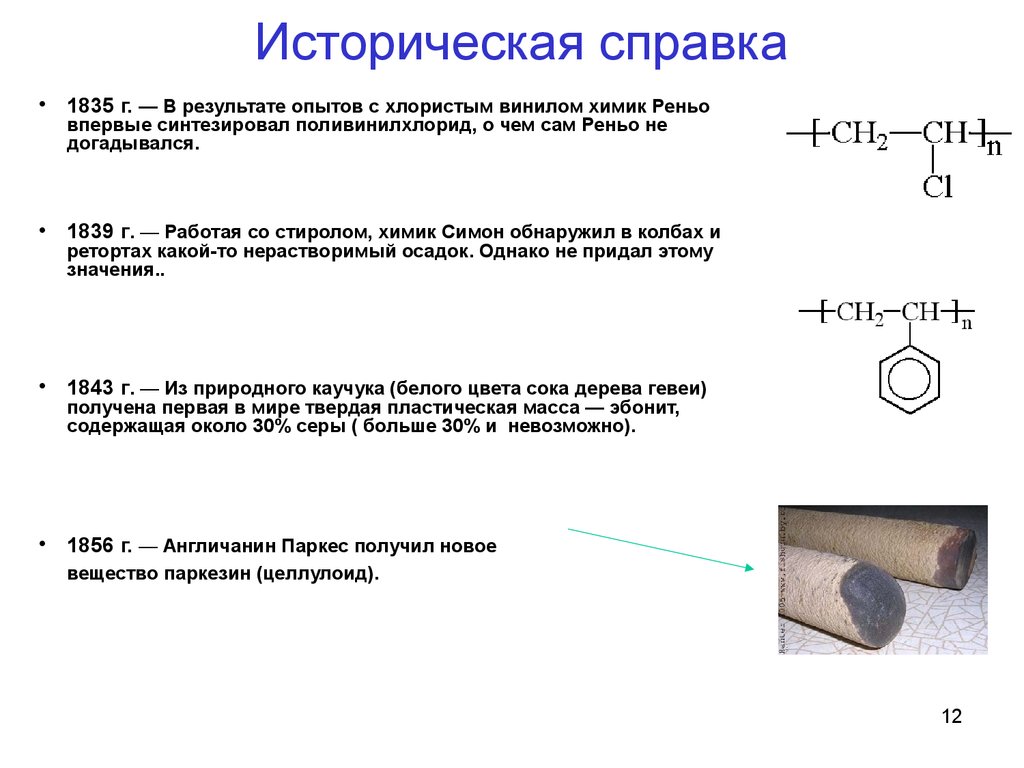
12. Историческая справка
• 1835 г. — В результате опытов с хлористым винилом химик Реньовпервые синтезировал поливинилхлорид, о чем сам Реньо не
догадывался.
• 1839 г. — Работая со стиролом, химик Симон обнаружил в колбах и
ретортах какой-то нерастворимый осадок. Однако не придал этому
значения..
• 1843 г. — Из природного каучука (белого цвета сока дерева гевеи)
получена первая в мире твердая пластическая масса — эбонит,
содержащая около 30% серы ( больше 30% и невозможно).
• 1856 г. — Англичанин Паркес получил новое
вещество паркезин (целлулоид).
12
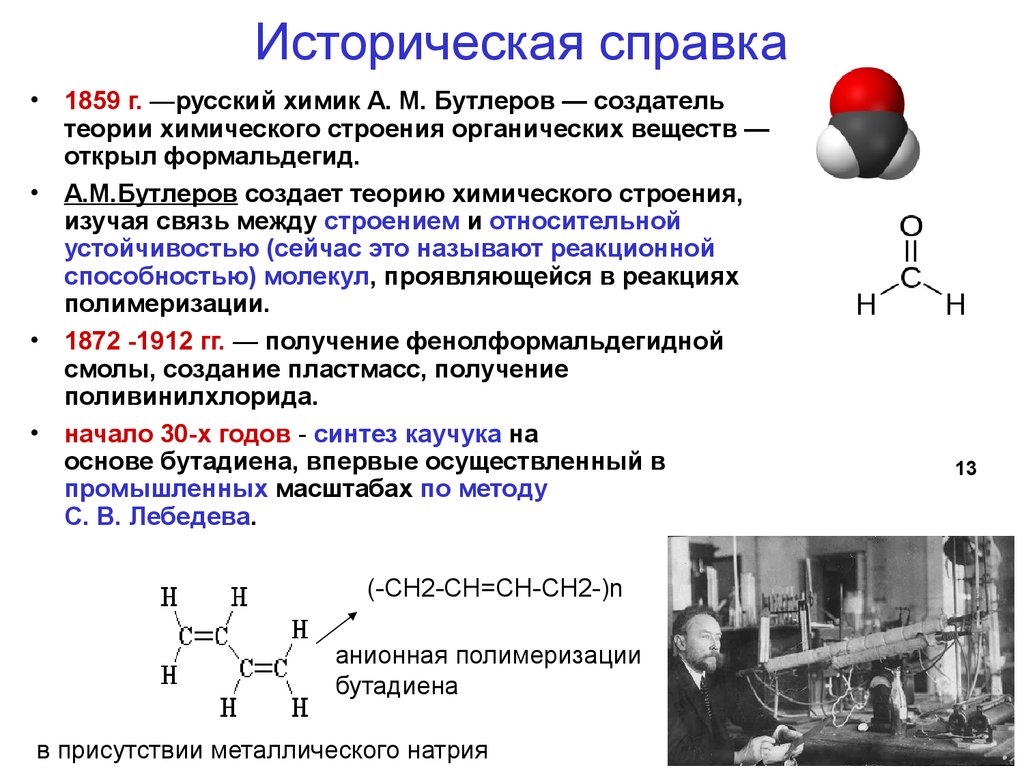
13. Историческая справка
• 1859 г. —русский химик А. М. Бутлеров — создательтеории химического строения органических веществ —
открыл формальдегид.
• А.М.Бутлеров создает теорию химического строения,
изучая связь между строением и относительной
устойчивостью (сейчас это называют реакционной
способностью) молекул, проявляющейся в реакциях
полимеризации.
• 1872 -1912 гг. — получение фенолформальдегидной
смолы, создание пластмасс, получение
поливинилхлорида.
• начало 30-х годов - синтез каучука на
основе бутадиена, впервые осуществленный в
промышленных масштабах по методу
С. В. Лебедева.
(-СH2-CH=CH-СH2-)n
анионная полимеризации
бутадиена
в присутствии металлического натрия
13
14.
1936 г.-получение полиэтилена полимеризацией этилена (компания
“Империал кемикал индастриз”)
nCH2=CH2 → [-CH2-CH2-]n
Условия: очень высокие температура
(200°С) и давление (сотни атмосфер),
свойства пластика не оправдали ожиданий, т.к. в жестких условиях реакции
образовывались макромолекулы разветвлённого строения
ноябрь 1953 г. - новая реакции получения полиэтилена
1953 г. (Циглер) –новый комплексный катализатор на
основе триэтилалюминия и галогенидов титана для
полимеризации этилена
14
способствует полимеризации
при значительно более низких
температуре и давлении
материал с гораздо лучшими
свойствами-более плотный,
твердый и устойчивый к
высоким температурам
•1957 г. ( Натта)- на промышленной установке получен изотактический
полипропилен( макромолекулы линейные и регулярного строения
[-CH2-CH-]n
революция в производстве пластических материалов!
CH3
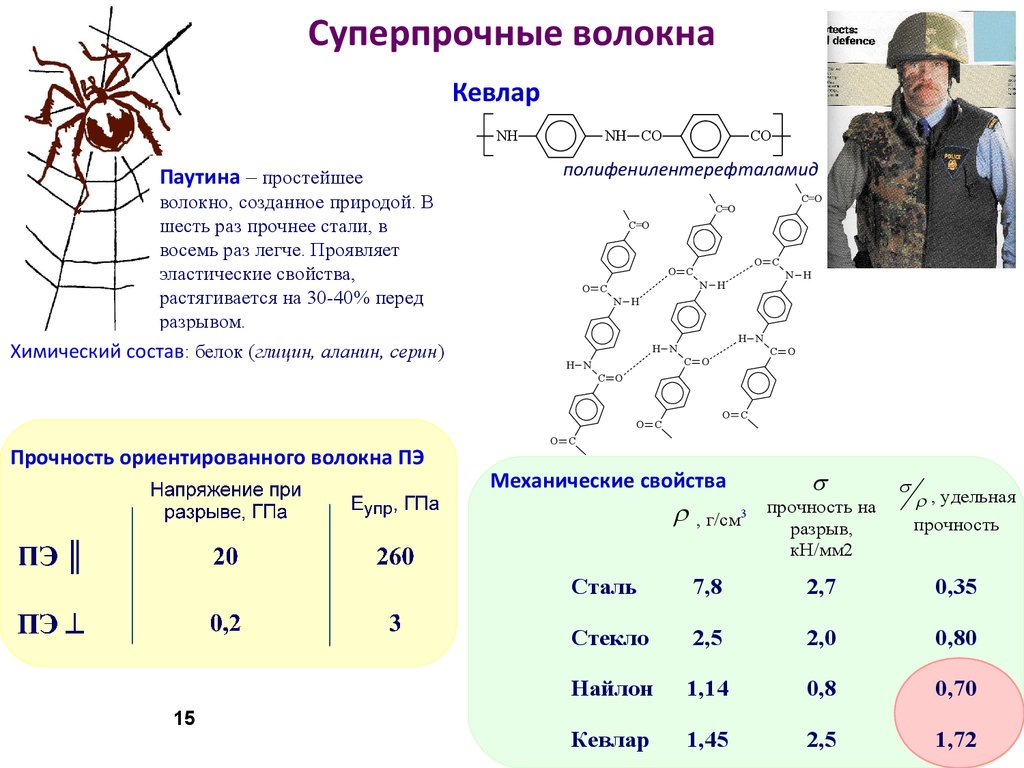
15. Суперпрочные волокна
КевларNH
Паутина – простейшее
NH CO
полифенилентерефталамид
волокно, созданное природой. В
шесть раз прочнее стали, в
восемь раз легче. Проявляет
эластические свойства,
растягивается на 30-40% перед
разрывом.
Химический состав: белок (глицин, аланин, серин)
CO
C=O
C=O
C=O
O C
O C
N H
N H
O C
N H
H N
H N
C O
C O
H N
C O
O C
Прочность ориентированного волокна ПЭ
15
O C
O C
Механические свойства
, удельная
прочность
, г/см3
прочность на
разрыв,
кН/мм2
Сталь
7,8
2,7
0,35
Стекло
2,5
2,0
0,80
Найлон
1,14
0,8
0,70
Кевлар
1,45
2,5
1,72
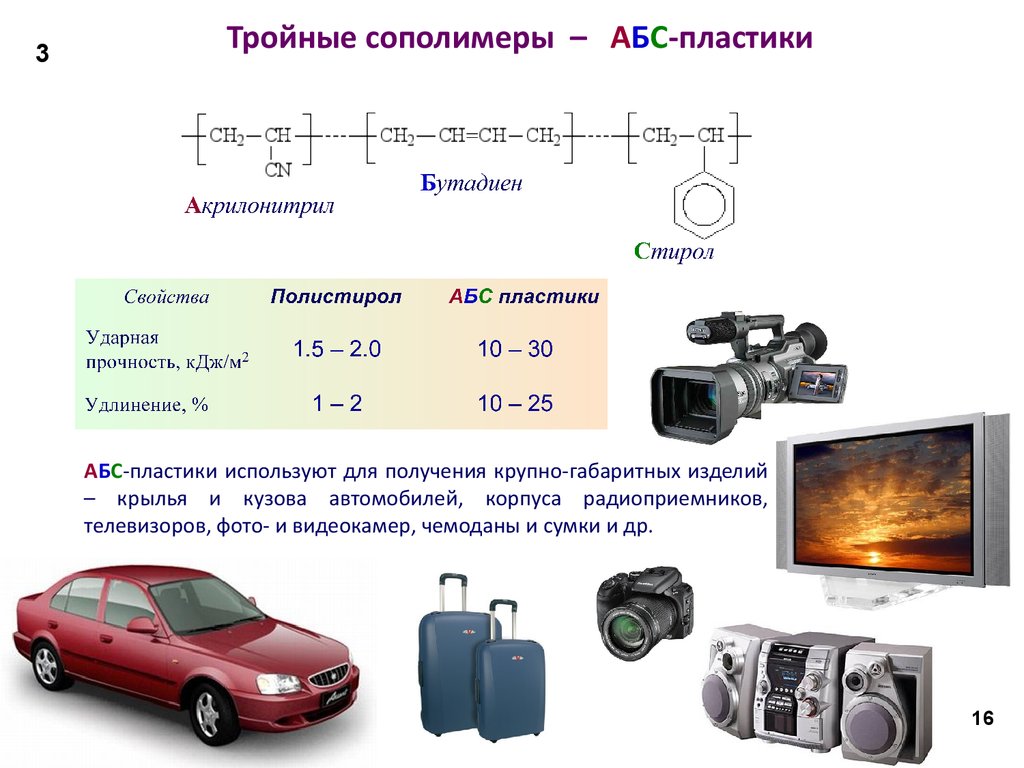
16. Тройные сополимеры – АБС-пластики
3Тройные сополимеры – АБС-пластики
АБС-пластики используют для получения крупно-габаритных изделий
– крылья и кузова автомобилей, корпуса радиоприемников,
телевизоров, фото- и видеокамер, чемоданы и сумки и др.
16
17.
ОСНОВНЫЕ ВИДЫ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ4
Машиностроение;
Авиационная промышленность; автомобилестроение;
Космическая промышленность;
Электротехника; электроника (DVD и CD диски)
Бытовая техника (телевизоры, видеосистемы, компьютеры);
Строительство; телекоммуникация
ПЛАСТИКИ
ВОЛОКНА
Текстильная и легкая промышленность;
Природные (шерсть, хлопок) и искусственные (нейлон,
полиэфиры) волокна
ЭЛАСТОМЕРЫ
(КАУЧУКИ)
Упаковочные материалы;
Аудио-, видео- пленки;
Сельское хозяйство (парники)
ПЛЕНКИ
ПОКРЫТИЯ
КЛЕИ
БУМАГА
Авто- и авиационные, эластичные материалы
Лакокрасочная промышленность;
Мебельная промышленность
Разнообразные виды промышленности
Целлюлозно-бумажная промышленность
17
18.
Развитие химии высокомолекулярныхсоединений
18
19.
• академик Валентин Алексеевич Каргин –основатель российской полимерной школы,
в 1955 г. организовал и возглавил кафедру
высокомолекулярных соединений в МГУ имени
М.В.Ломоносова
От макромолекулы до композиционных материалов – так 1907-1969
логически построен курс подготовки химика-полимерщика
• Растворы полимеров, - термодинамически обратимые системы,
подчиняющиеся правилу фаз (Ф + С = К +1) (конец 1930-х г.)
• Исследования механических свойств полимеров - выводы
о природе физических и фазовых состояний полимеров.
• Идея о связи надмолекулярной (супрамолекулярной)
структуры с физико-механическими свойствами полимера.
• Синтез и химическая модификации макромолекул как
средство целенаправленного создания полимерных
материалов с требуемыми эксплуатационными
свойствами.
19
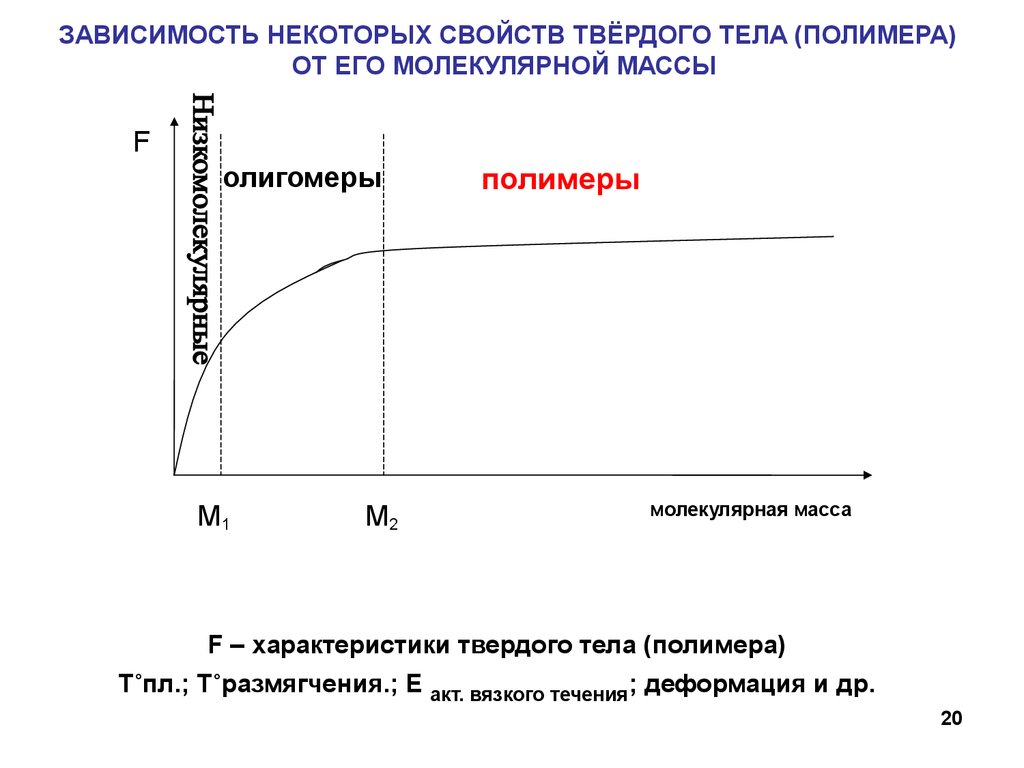
20.
ЗАВИСИМОСТЬ НЕКОТОРЫХ СВОЙСТВ ТВЁРДОГО ТЕЛА (ПОЛИМЕРА)ОТ ЕГО МОЛЕКУЛЯРНОЙ МАССЫ
F
олигомеры
M1
M2
полимеры
молекулярная масса
F – характеристики твердого тела (полимера)
T˚пл.; T˚размягчения.; Е акт. вязкого течения; деформация и др.
20
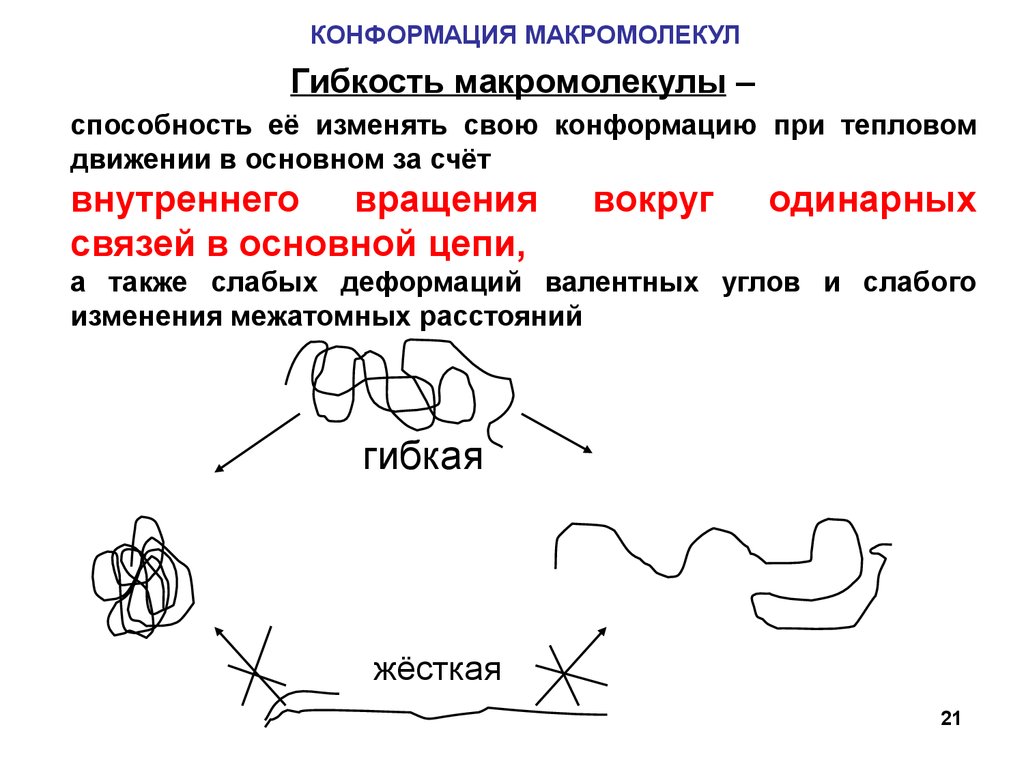
21.
КОНФОРМАЦИЯ МАКРОМОЛЕКУЛГибкость макромолекулы –
способность её изменять свою конформацию при тепловом
движении в основном за счёт
внутреннего вращения
связей в основной цепи,
вокруг
одинарных
а также слабых деформаций валентных углов и слабого
изменения межатомных расстояний
гибкая
жёсткая
21
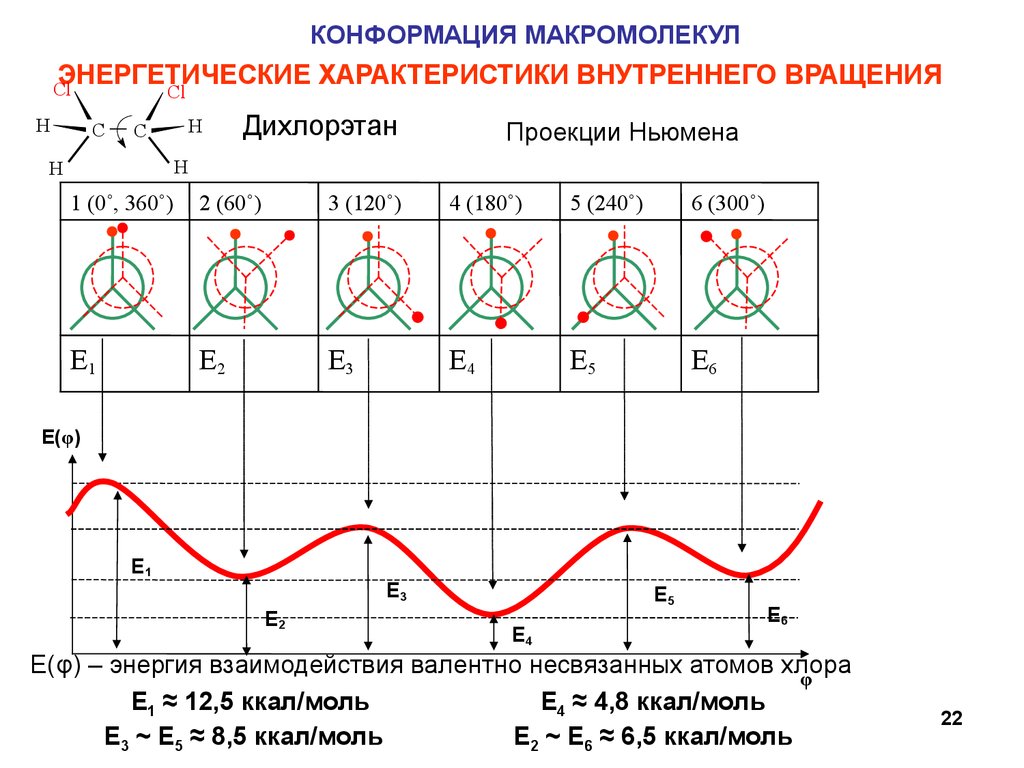
22.
КОНФОРМАЦИЯ МАКРОМОЛЕКУЛЭНЕРГЕТИЧЕСКИЕ ХАРАКТЕРИСТИКИ ВНУТРЕННЕГО ВРАЩЕНИЯ
Cl
H
Cl
C
H
C
Дихлорэтан
Проекции Ньюмена
H
H
1 (0˚, 360˚)
2 (60˚)
3 (120˚)
4 (180˚)
5 (240˚)
6 (300˚)
E1
E2
E3
E4
E5
E6
E(φ)
E1
E3
E2
E5
E4
E6
E(φ) – энергия взаимодействия валентно несвязанных атомов хлора
φ
E1 ≈ 12,5 ккал/моль
E4 ≈ 4,8 ккал/моль
E3 ~ E5 ≈ 8,5 ккал/моль
E2 ~ E6 ≈ 6,5 ккал/моль
22
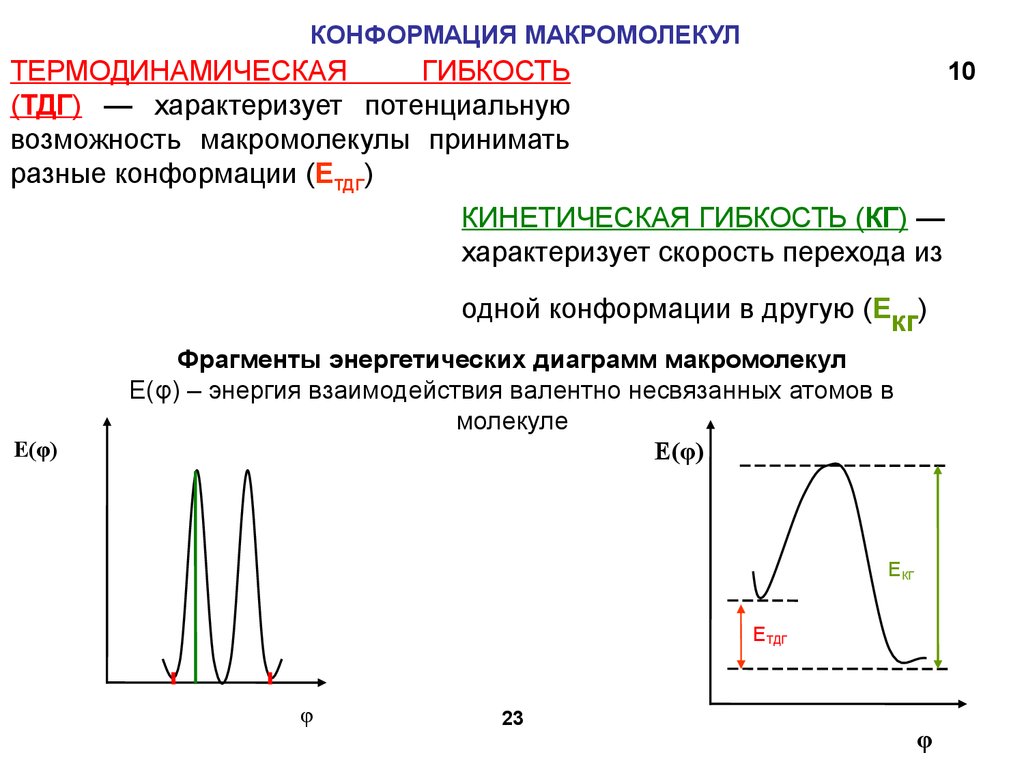
23.
КОНФОРМАЦИЯ МАКРОМОЛЕКУЛТЕРМОДИНАМИЧЕСКАЯ
ГИБКОСТЬ
(ТДГ) — характеризует потенциальную
возможность макромолекулы принимать
разные конформации (ЕТДГ)
10
КИНЕТИЧЕСКАЯ ГИБКОСТЬ (КГ) —
характеризует скорость перехода из
одной конформации в другую (Eкг)
E(φ)
Фрагменты энергетических диаграмм макромолекул
E(φ) – энергия взаимодействия валентно несвязанных атомов в
молекуле
E(φ)
EКГ
EТДГ
φ
23
φ
24.
КОНФОРМАЦИЯ МАКРОМОЛЕКУЛФакторы, уменьшающие гибкость (КГ и ТДГ) макромолекулы
A. Наличие в основной цепи:
1. кратных связей (-С=С-, -С=N-)
2. жёстких фрагментов (ароматические
кольца, ангидридные циклы)
3. объёмистых заместителей
4. внутримолекулярных взаимодействий
(водородные связи, кулоновские
взаимодействия)
Б. Несимметричность строения основной цепи
В. Нерегулярность строения цепи
24
25.
КОНФОРМАЦИЯ МАКРОМОЛЕКУЛ12
Модель свободно-сочленённой цепи
1. Цепь состоит из n повторяющихся сегментов, имеющих скалярную величину
(длину) l и направление (вектор)
2. Свободное (!) [от 0 до 360º] сочленение между сегментами
Для одной конформации:
l1
r2 n n æ
ö æ
ö
h =h li ´ li ç l1 + l2 + l3 + ... + l n ÷ ´ ç l1 + l 2 + l3 + ... + l n ÷
è
ø è
ø
i 1
i 1
2
n
h li
li
i 1
h
l1 l1 + l1 l2 + ... + l1 ln +
r¶ r
2
2
h li cosli li +
n
i=1
+l2 l1 + l2 l2 + ... + l2 ln +
ln
l
...
j
+ln l1 + ln l2 + ... + ln ln
Проведём усреднение h2 по всем
конформациям, конформация задаётся
набором углов li lj.
h nl
2
2
L=nl
h
2
n
i,j=1, i ¹ j
r¶ ur
li l jcosli l j
r¶ ur
nl + li l j cosli l j
i,j=1, i ¹ j
14 2 43
n
2
Свободное сочленение=> =0
A
L
(h )
2 1/ 2
nl
nl
n
25
26.
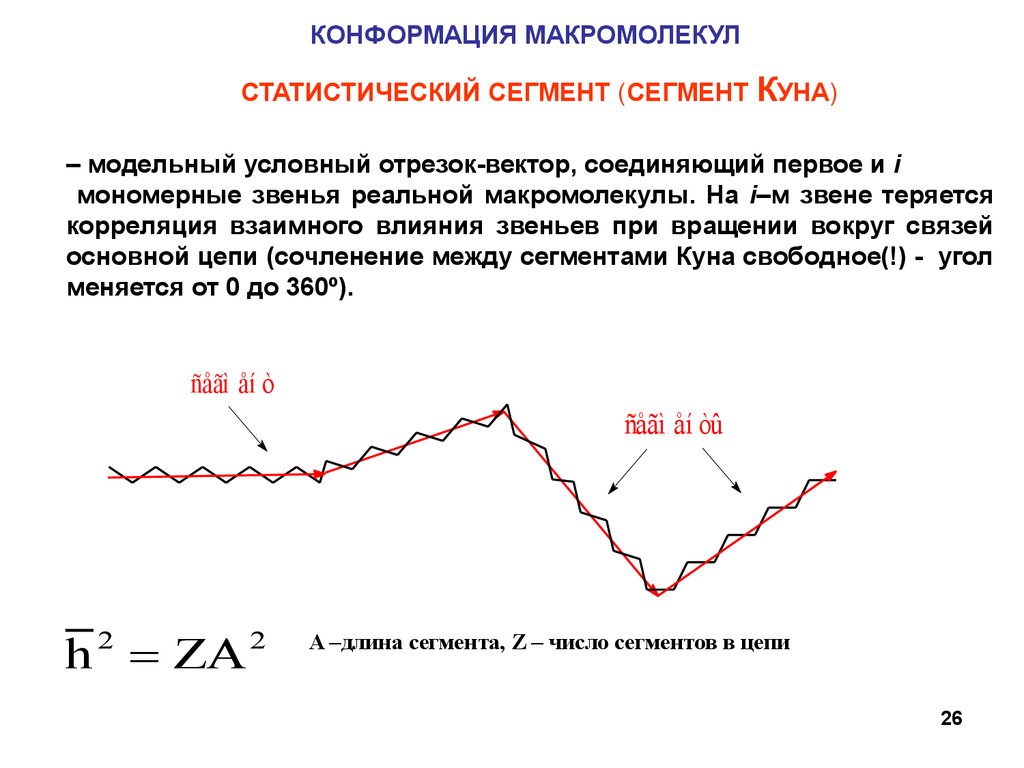
КОНФОРМАЦИЯ МАКРОМОЛЕКУЛСТАТИСТИЧЕСКИЙ СЕГМЕНТ (СЕГМЕНТ КУНА)
– модельный условный отрезок-вектор, соединяющий первое и i
мономерные звенья реальной макромолекулы. На i–м звене теряется
корреляция взаимного влияния звеньев при вращении вокруг связей
основной цепи (сочленение между сегментами Куна свободное(!) - угол
меняется от 0 до 360º).
ñåãì åí ò
ñåãì åí òû
h 2 ZA 2
A –длина сегмента, Z – число сегментов в цепи
26
27.
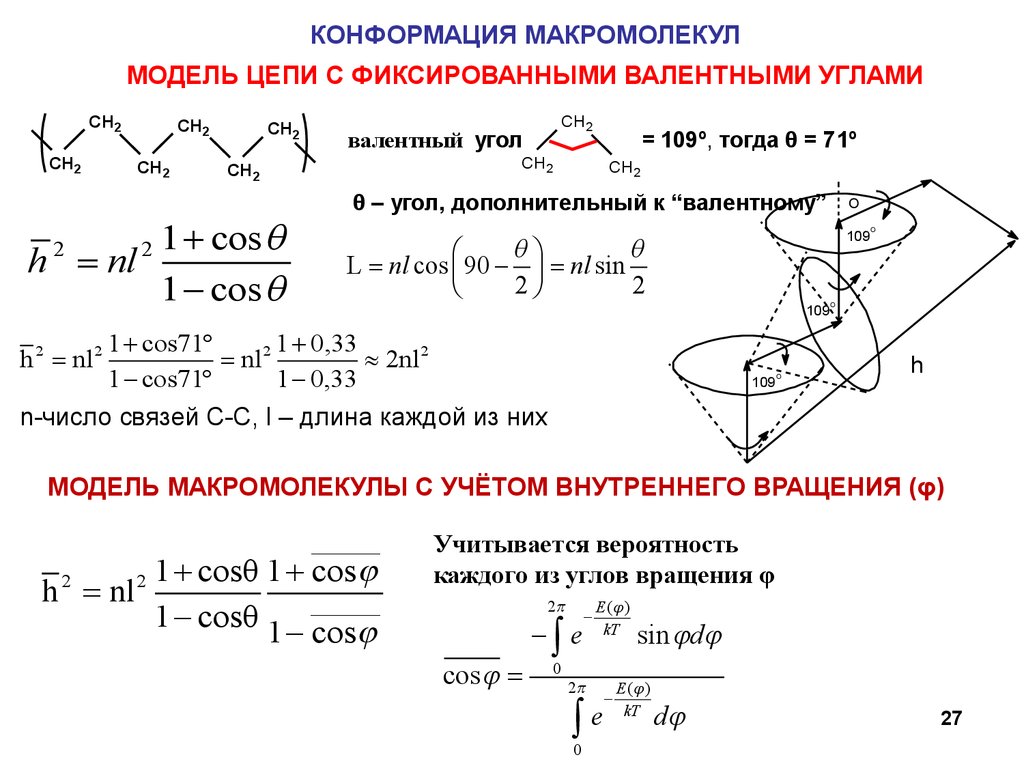
КОНФОРМАЦИЯ МАКРОМОЛЕКУЛМОДЕЛЬ ЦЕПИ С ФИКСИРОВАННЫМИ ВАЛЕНТНЫМИ УГЛАМИ
CH2
CH2
CH2
CH2
CH2
h 2 nl 2
= 109º, тогда θ = 71º
CH2
CH2
2
2 1 + cos q
h nl
1 - cos q
CH2
валентный угол
CH2
θ – угол, дополнительный к “валентному”
O
109
qö
q
æ
L nl cos ç 90 - ÷ nl sin
2ø
2
è
109
1 + cos71°
1 + 0,33
nl 2
» 2nl 2
1 - cos71°
1 - 0,33
109
O
O
O
h
n-число связей С-С, l – длина каждой из них
МОДЕЛЬ МАКРОМОЛЕКУЛЫ С УЧЁТОМ ВНУТРЕННЕГО ВРАЩЕНИЯ (φ)
_______
h 2 nl 2
1 + cosθ 1 + cosj
1 - cosθ 1 - _______
cosj
Учитывается вероятность
каждого из углов вращения φ
2p
cos j
-ò e
0
-
2p
E (j )
kT
òe
0
-
sin jdj
E (j )
kT
dj
27
28.
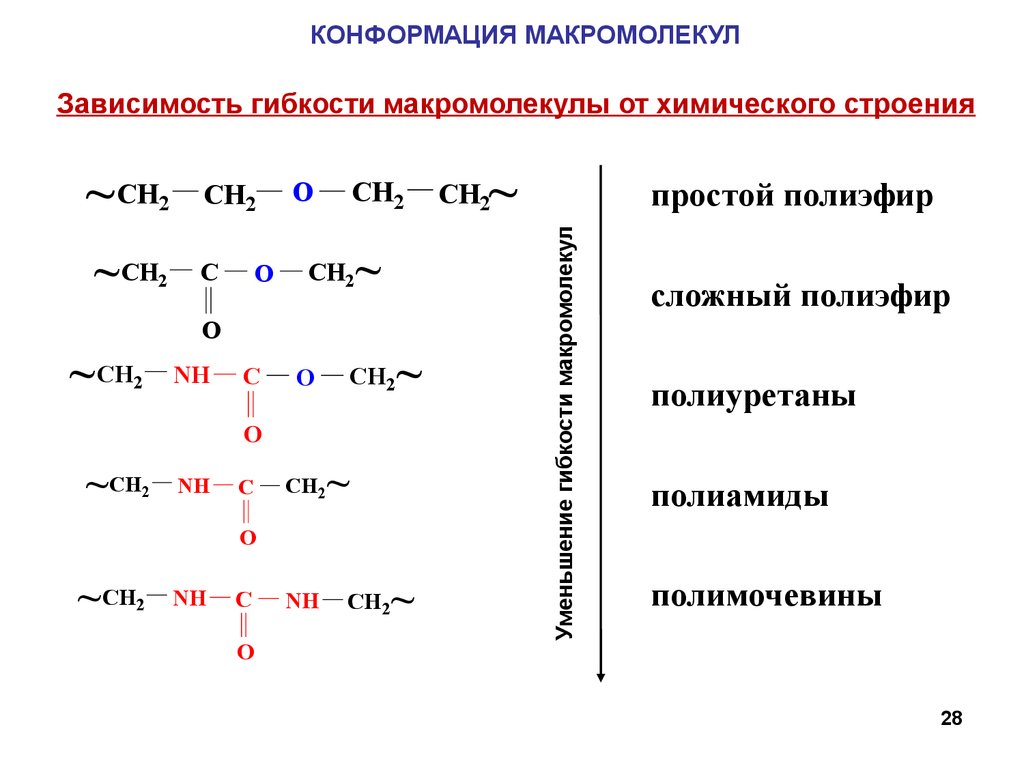
КОНФОРМАЦИЯ МАКРОМОЛЕКУЛЗависимость гибкости макромолекулы от химического строения
2
CH2
2
C
~ CH
O
O
CH2
CH2
~
O
~ CH
2
NH
C
CH2
O
~
O
~ CH
2
NH
C
CH2
~
O
~ CH
2
NH
C
O
NH
CH2
~
~
простой полиэфир
CH2
Уменьшение гибкости макромолекул
~ CH
сложный полиэфир
полиуретаны
полиамиды
полимочевины
28
29.
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯМАКРОМОЛЕКУЛА:
совокупность атомов или
атомных групп, разных или
одинаковых по химической
природе,
соединённых
ковалентными связями в
длинную,
гибкую,
цепную конструкцию
ПОЛИМЕРЫ: особый
класс
химических
соединений, состоящих
из макромолекул, специфика
свойств которых обусловлена
большой
длиной,
цепным
строением и гибкостью их
макромолекул.
29
30.
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯКОНФОРМАЦИЯ
макромолекулы
–
взаимное
расположение атомов или атомных
групп в макромолекуле, которое
может изменяться без разрыва
ковалентных связей основной цепи
за счет внутреннего вращения
вокруг химических связей основной
цепи, а также упругости химических
связей и валентных углов.
КОНФИГУРАЦИЯ
макромолекулы
–
взаимное
расположение
атомов
или
атомных групп в макромолекуле,
которое формируется при синтезе
полимера
и
не
может
изменяться
без
разрыва
ковалентных связей основной
полимерной
цепи
(алгоритм,
согласно которому мономерные
звенья соединены друг с другом в
макромолекуле).
30
31.
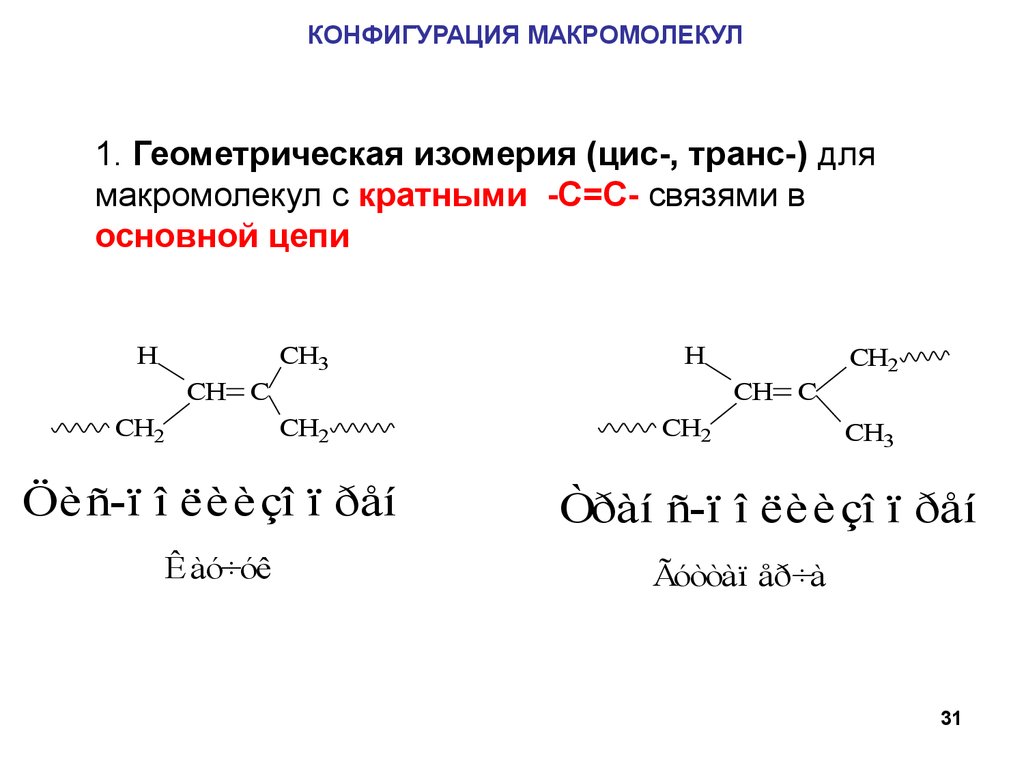
КОНФИГУРАЦИЯ МАКРОМОЛЕКУЛ1. Геометрическая изомерия (цис-, транс-) для
макромолекул с кратными -С=С- связями в
основной цепи
H
CH3
H
CH C
CH2
CH C
CH2
Öè ñ-ï î ëè è çî ï ðåí
Êàó÷óê
CH2
CH2
CH3
Òðàí ñ-ï î ëè è çî ï ðåí
Ãóòòàï åð÷à
31
32.
КОНФИГУРАЦИЯ МАКРОМОЛЕКУЛ2. ”Локальная” изомерия (на примере
макромолекул винилового ряда для двух соседних
мономерных звеньев)
голова
CH2
хвост
à)
á)
CH2
CH2
CH
CH
X
X
CH
CH2
X
â)
CH
X
CH2
CH
X
CH2
ãî ëî âà-ãî ë î âà (Ã-Ã)
CH
ãî ëî âà-õâî ñò (Ã-Õ)
þ
X
CH2
CH
X
õâî ñò-õâî ñò (Õ-Õ)
32
33.
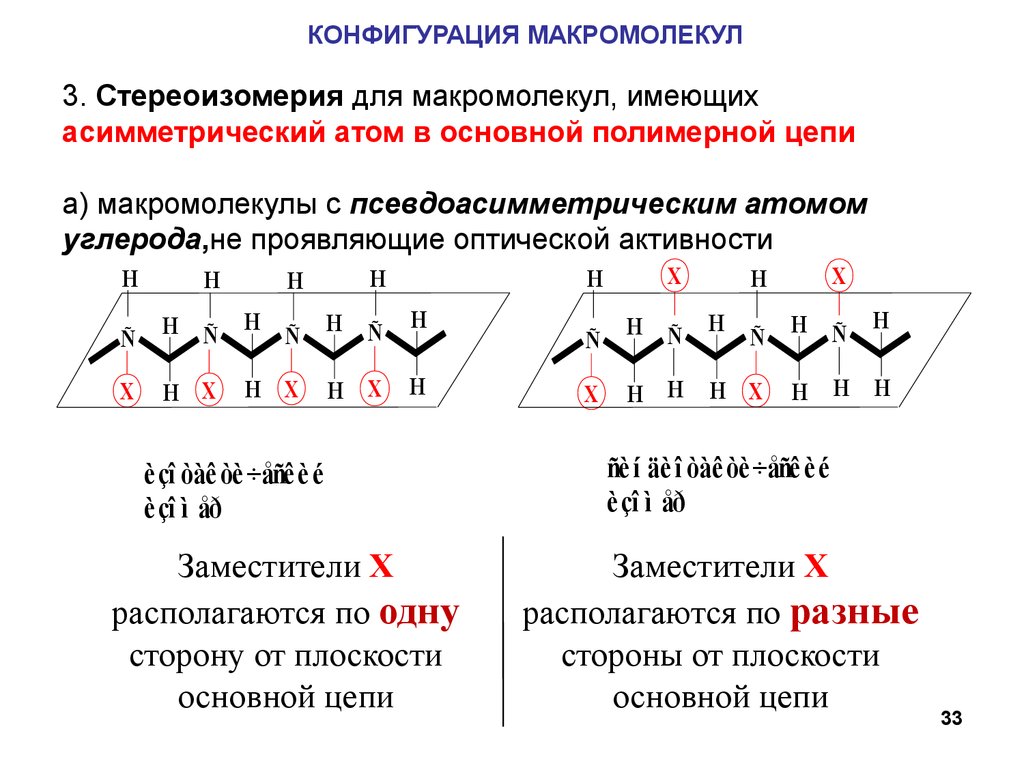
КОНФИГУРАЦИЯ МАКРОМОЛЕКУЛ3. Стереоизомерия для макромолекул, имеющих
асимметрический атом в основной полимерной цепи
а) макромолекулы с псевдоасимметрическим атомом
углерода,не проявляющие оптической активности
H
Ñ
X
H
H
Ñ
H X
H
H
H
Ñ
H X
H
Ñ
H
X
X
H
H
H
è çî òàê òè ÷åñê è é
è çî ì åð
Заместители Х
располагаются по одну
сторону от плоскости
основной цепи
Ñ
X
H
Ñ
H
H
X
H
H
Ñ
H X
H
Ñ
H
H
H
H
ñè í äè î òàê òè ÷åñê è é
è çî ì åð
Заместители Х
располагаются по разные
стороны от плоскости
основной цепи
33
34.
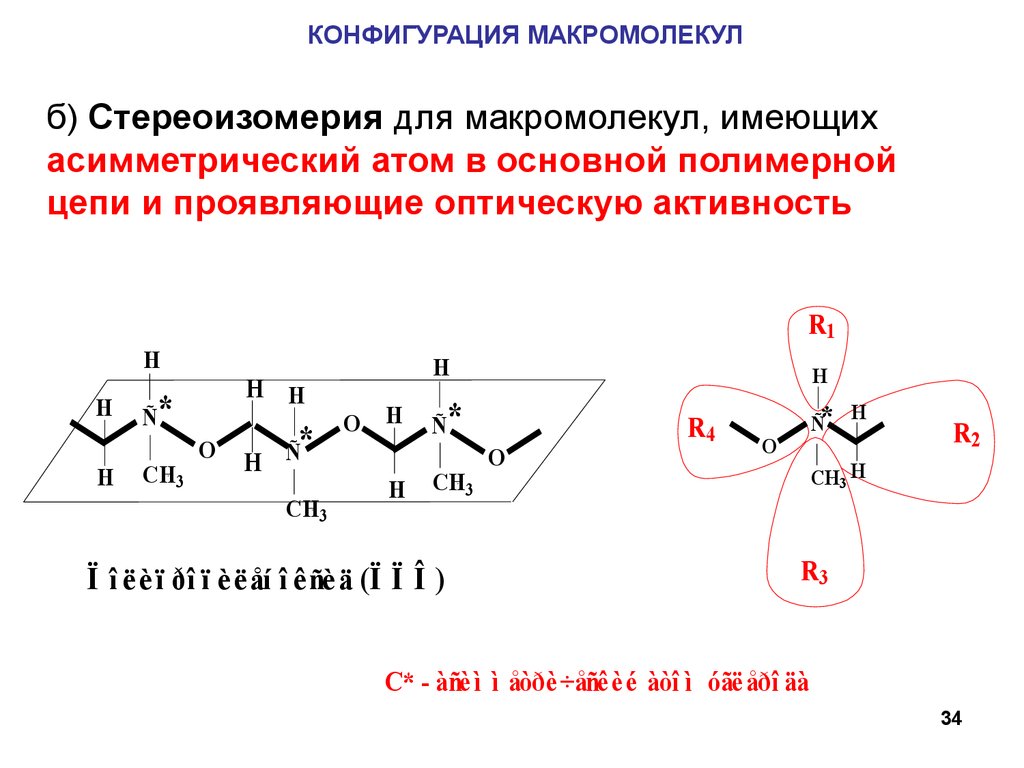
КОНФИГУРАЦИЯ МАКРОМОЛЕКУЛб) Стереоизомерия для макромолекул, имеющих
асимметрический атом в основной полимерной
цепи и проявляющие оптическую активность
R1
H
H
H
Ñ*
CH3
H
H H
O
*
H Ñ
CH3
O
H
H
H
Ñ*
CH3
Ï î ë è ï ðî ï è ë åí î ê ñè ä (Ï Ï Î )
O
R4
Ñ*
O
H
R2
CH3 H
R3
C* - àñè ì ì åòðè ÷åñê è é àòî ì óãë åðî äà
34
35.
Задача 1: посчитать, сколько возможно конфигурационныхизомеров для
двух соединённых ковалентной связью мономерных звеньев
1. акрилонитрила
2. бутадиена
35
36.
ПОЛИМЕРИЗАЦИЯ (цепнойРадикальная
Анионная
(актив. центр R●)
(актив. центр R▬)
36
процесс)
Катионная
(актив. центр R+)
1. Инициирование (присоединение радикалов инициатора к кратной связи
мономеров против правила Марковникова)
Инициирующий радикал становится сначала одной концевой группой в
макрорадикале
I
+ СН2=СН ICН2-СН
I
I
Х
X
Появление радикалов при окислительно-восстановительных реакциях
I
I
2I
а) H2O2 + Fe2+ HO- +HO +Fe3+
реактив Фентона
Появление радикалов при гомолитическом разрыве связей, например, O-O
C6H5-C-O-O-C-C6H5
O
O
.
2C6H5-C-O
O
.
2C6H5 + 2CO2
37.
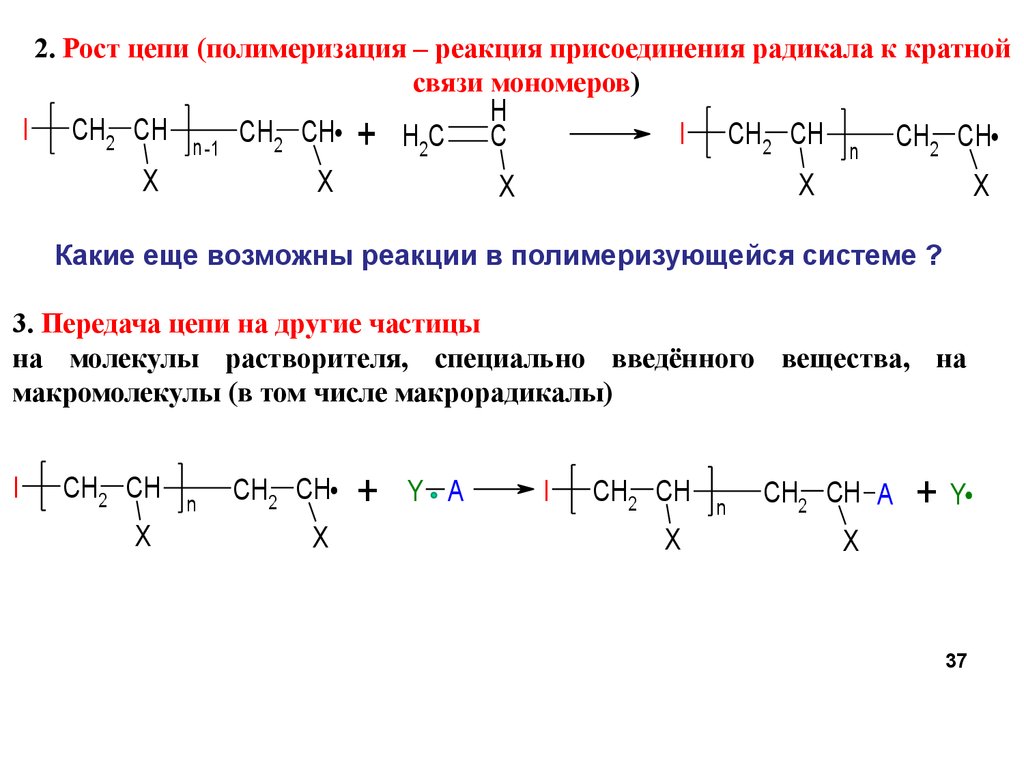
2. Рост цепи (полимеризация – реакция присоединения радикала к кратнойсвязи мономеров)
I
CH2 CH
n -1
X
CH2 CH
+
H2C
X
H
C
I
CH2 CH
n
CH2 CH
X
X
X
Какие еще возможны реакции в полимеризующейся системе ?
3. Передача цепи на другие частицы
на молекулы растворителя, специально введённого вещества, на
макромолекулы (в том числе макрорадикалы)
I
CH2 CH
X
n
CH2 CH
X
+
Y A
I
CH2 CH
X
n
CH2 CH A
+Y
X
37
38.
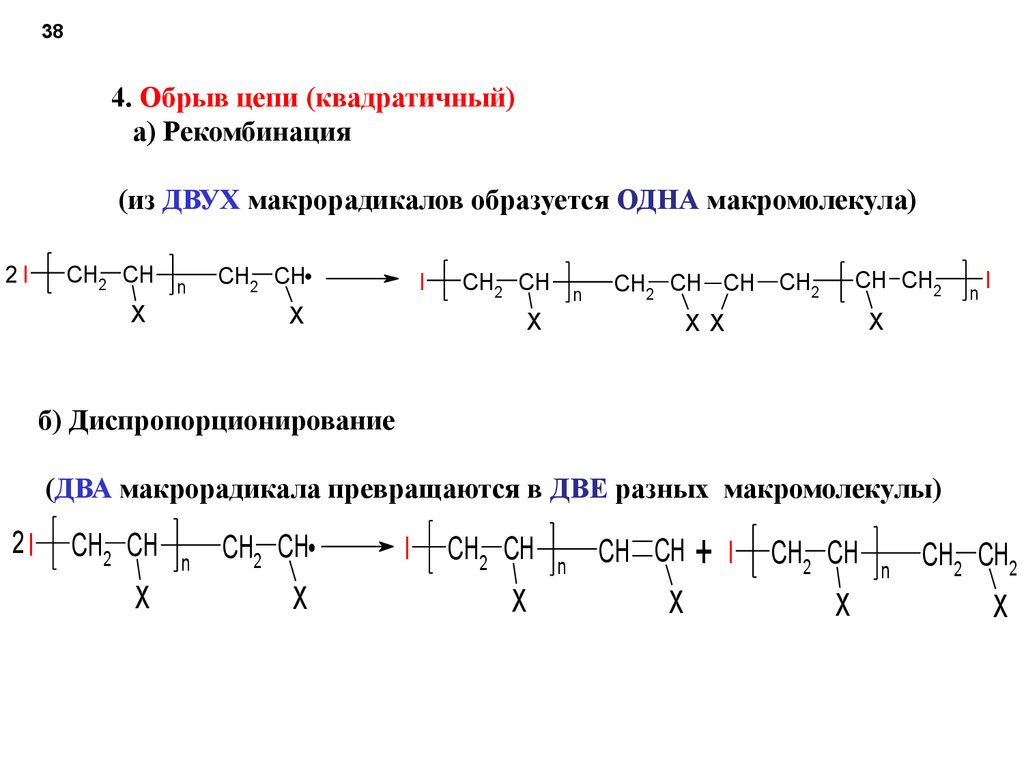
384. Обрыв цепи (квадратичный)
а) Рекомбинация
(из ДВУХ макрорадикалов образуется ОДНА макромолекула)
2I
CH2 CH
n
X
CH2 CH
I
CH2 CH
X
n
CH2 CH CH
X
CH CH2
CH2
n
I
X
X X
б) Диспропорционирование
(ДВА макрорадикала превращаются в ДВЕ разных макромолекулы)
2I
CH2 CH
X
n
CH2 CH
X
I
CH2 CH
X
n
CH CH + I
X
CH2 CH
X
n
CH2 CH2
X
39.
АНИОННАЯ ПОЛИМЕРИЗАЦИЯМономеры
ВИНИЛОВЫЕ мономеры с электроноакцепторными заместителями
+
CH2
-
CH
X
Роль X – стабилизация аниона
X – нитрил, сложноэфирная группа, арил, винил.
CH3
CH2
CH
CN
CH2
C
CH2
CH
COOCH3
акрилонитрил метилметакрилат стирол
CH2
CH
CH
CH2
1,3-бутадиен
Образование обобщенной единой ароматической системы ПИсвязей (бензольного ядра) приводит к значительному энергетическому
повышению устойчивости системы примерно на 40 ккал\моль по
сравнению с системой с тремя изолированными кратными связями. Это
является одной из причин того, что в зависимости от конкретных условий
реакции, ароматическое кольцо проявляет либо электроно-акцепторные,
либо электроно-донорные свойства
39
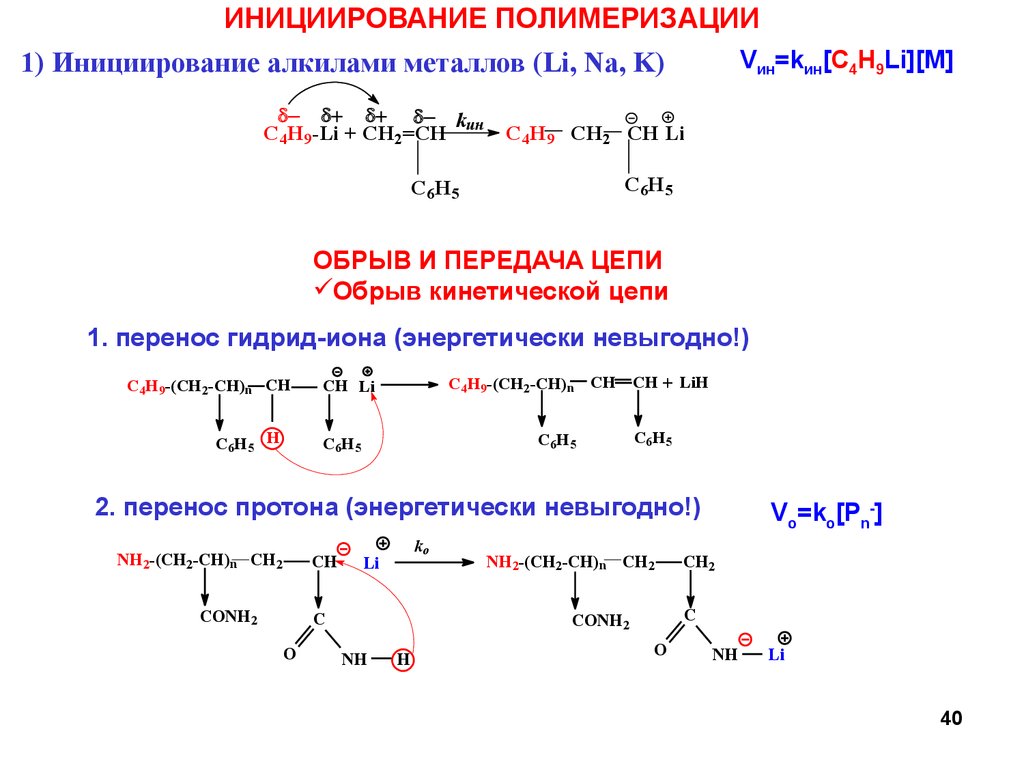
40.
ИНИЦИИРОВАНИЕ ПОЛИМЕРИЗАЦИИVин=kин[C4H9Li][M]
1) Инициирование алкилами металлов (Li, Na, K)
- + + - kин
C4H9-Li + CH2=CH
C4H9 CH2 CH Li
C6H5
C6H5
ОБРЫВ И ПЕРЕДАЧА ЦЕПИ
Обрыв кинетической цепи
1. перенос гидрид-иона (энергетически невыгодно!)
C4H9-(CH2-CH)n CH
C6H5 H
C4H9-(CH2-CH)n CH
CH Li
C6H5
C6H5
CH + LiH
C6H5
2. перенос протона (энергетически невыгодно!)
NH2-(CH2-CH)n CH2
CH
CONH2
ko
Li
C
O
NH2-(CH2-CH)n CH2
H
CH2
C
CONH2
NH
Vo=ko[Pn-]
O
NH
Li
40
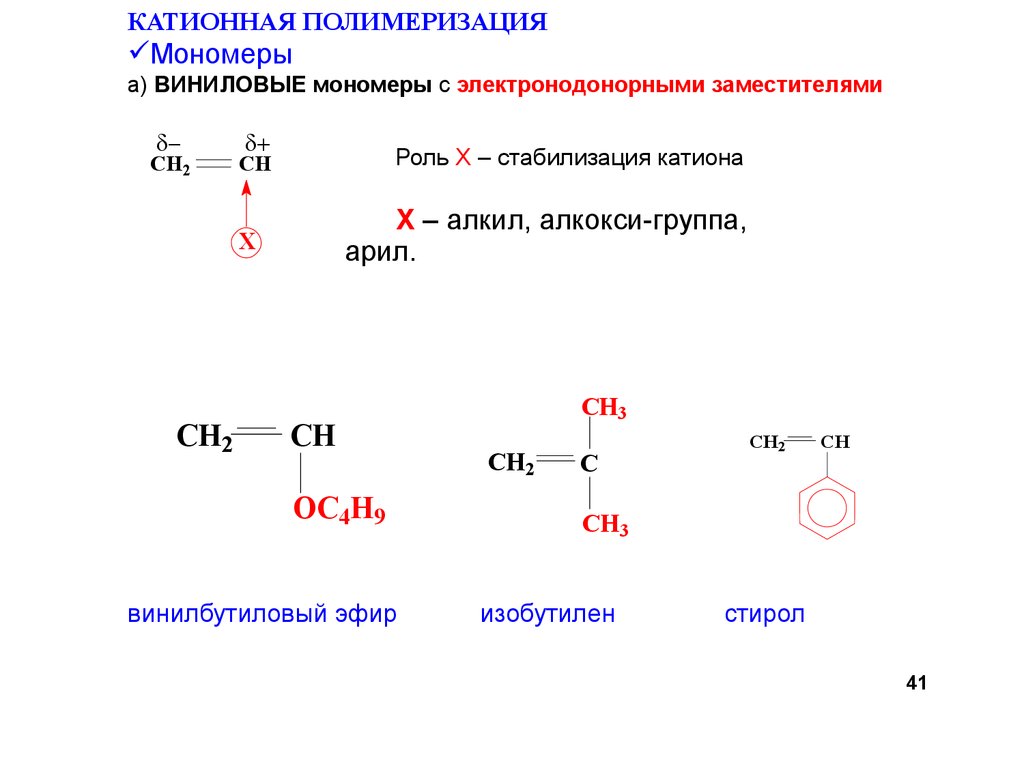
41.
КАТИОННАЯ ПОЛИМЕРИЗАЦИЯМономеры
а) ВИНИЛОВЫЕ мономеры с электронодонорными заместителями
-
CH2
+
Роль X – стабилизация катиона
CH
X – алкил, алкокси-группа,
арил.
X
CH2
CH
OC4H9
винилбутиловый эфир
CH3
CH2
C
CH2
CH
CH3
изобутилен
стирол
41
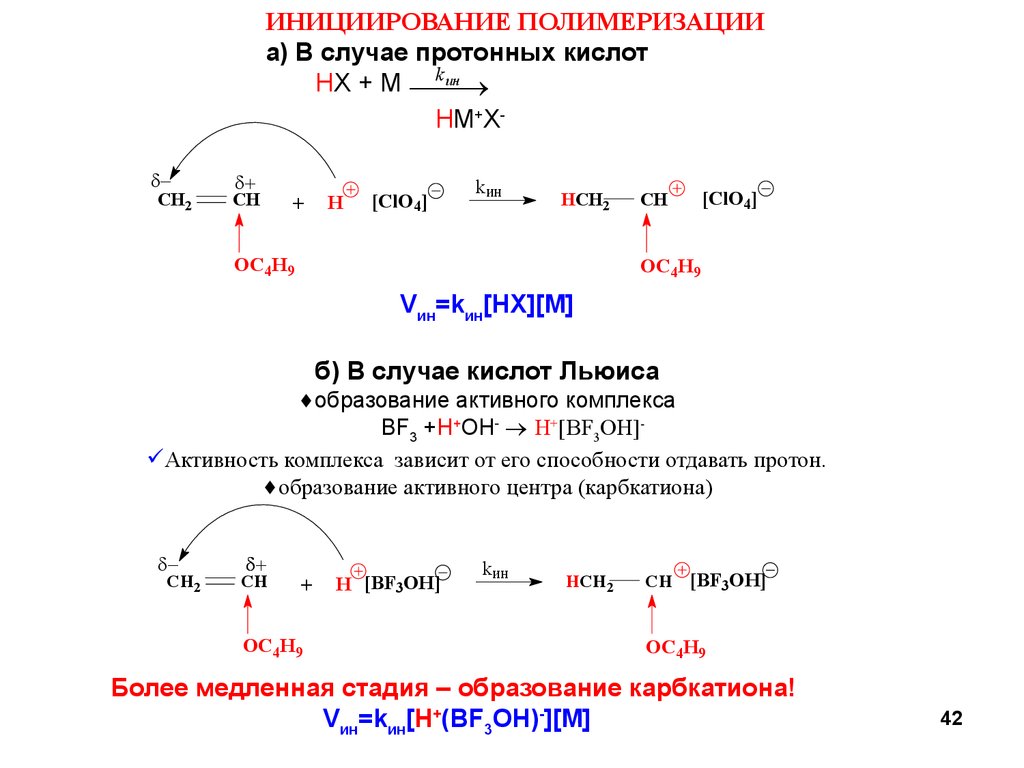
42.
ИНИЦИИРОВАНИЕ ПОЛИМЕРИЗАЦИИа) В случае протонных кислот
ин
HX + M k
HM+X -
CH2
+
CH
+
H
[ClO4]
kин
HCH2
OC4H9
CH
[ClO4]
OC4H9
Vин=kин[HX][M]
б) В случае кислот Льюиса
образование активного комплекса
BF3 +H+OH- H+[BF3OH] Активность комплекса зависит от его способности отдавать протон.
образование активного центра (карбкатиона)
-
CH2
+
CH
+
OC4H9
H [BF3OH]
kин
HCH2
CH [BF3OH]
OC4H9
Более медленная стадия – образование карбкатиона!
Vин=kин[H+(BF3OH)-][M]
42
43.
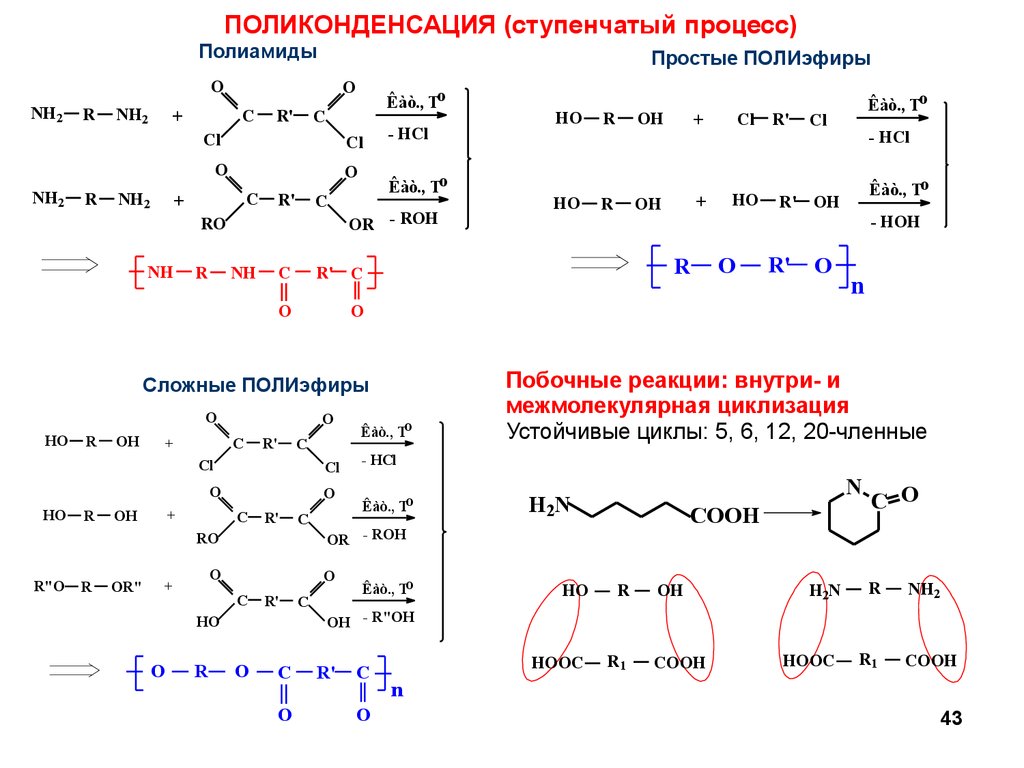
ПОЛИКОНДЕНСАЦИЯ (ступенчатый процесс)Полиамиды
Простые ПОЛИэфиры
O
NH2
R
NH2
O
C
+
R'
C
Cl
Cl
O
NH2
R
NH2
O
C
+
R'
C
RO
NH
R
Êàò., To
NH
C
R'
O
- HCl
Êàò., To
OR - ROH
OH
+
O
C
R'
C
Cl
Cl
O
HO
R
+
OH
O
C
R'
C
RO
R"O
R
OR"
O
+
R'
HO
O
R
O
C
O
+
Cl
R
OH
+
HO
R'
R'
Êàò., To
Cl
- HCl
Êàò., To
OH
- HOH
O
R
R'
O
n
C
Êàò., To
Побочные реакции: внутри- и
межмолекулярная циклизация
Устойчивые циклы: 5, 6, 12, 20-членные
- HCl
Êàò., To
N
H2N
COOH
OR - ROH
O
C
OH
O
O
R
HO
R
C
Сложные ПОЛИэфиры
HO
HO
Êàò., To
HO
R
OH
H2N
C O
R
NH2
OH - R"OH
R'
C
O
HOOC
R1
COOH
HOOC
R1
COOH
n
43
44.
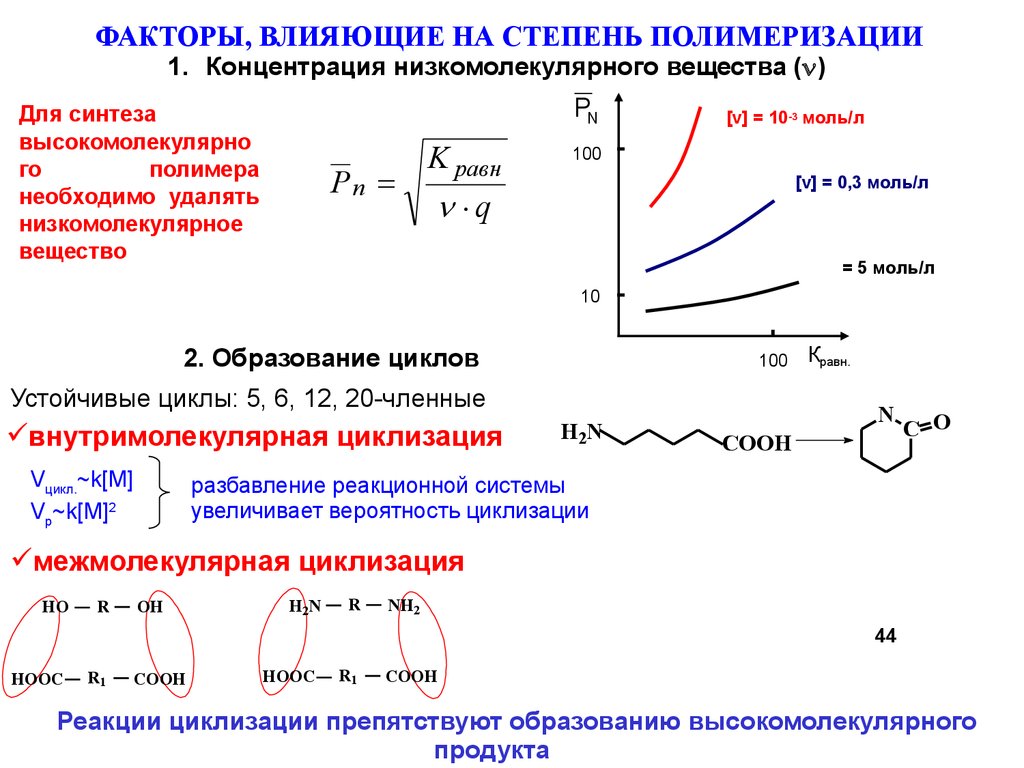
ФАКТОРЫ, ВЛИЯЮЩИЕ НА СТЕПЕНЬ ПОЛИМЕРИЗАЦИИ1. Концентрация низкомолекулярного вещества ( )
PN
Для синтеза
высокомолекулярно
го
полимера
необходимо удалять
низкомолекулярное
вещество
Pn
K равн
[v] = 10-3 моль/л
100
[v] = 0,3 моль/л
q
[v] = 5 моль/л
10
2. Образование циклов
100
Устойчивые циклы: 5, 6, 12, 20-членные
внутримолекулярная циклизация
Vцикл.~k[M]
Vp~k[M]2
H2N
Кравн.
N
COOH
C O
разбавление реакционной системы
увеличивает вероятность циклизации
межмолекулярная циклизация
HO
R
OH
H2N
R
NH2
44
HOOC
R1
COOH
HOOC
R1
COOH
Реакции циклизации препятствуют образованию высокомолекулярного
продукта
45.
100Pn
r=1
75
50
r=0.95
25
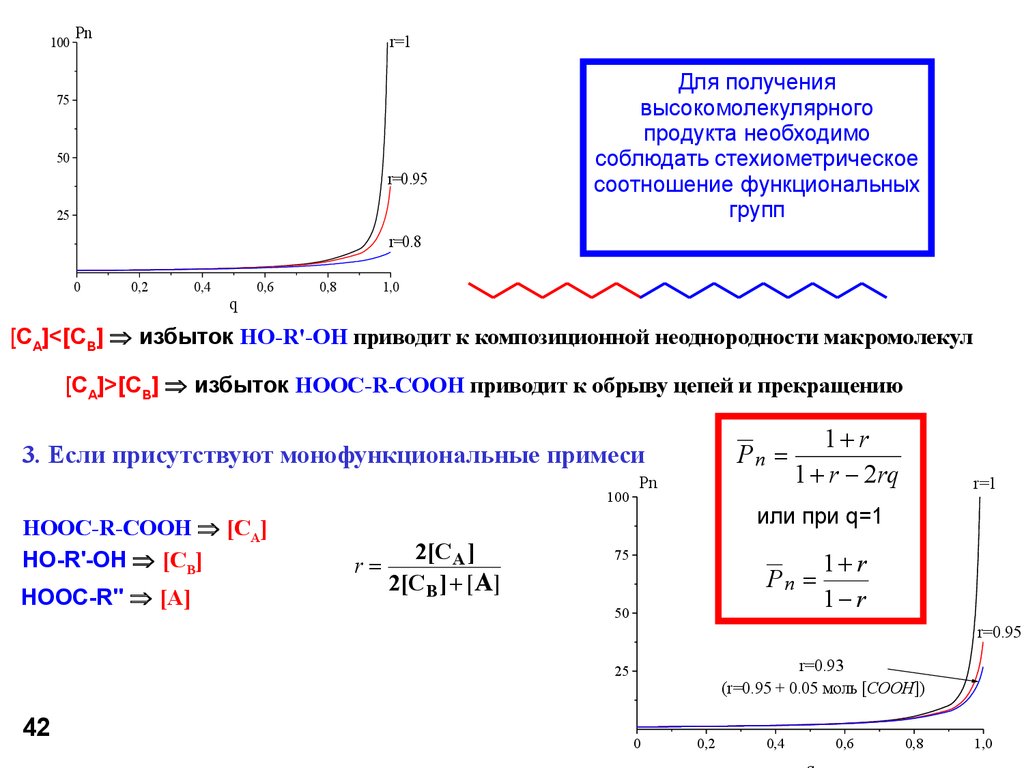
Для получения
высокомолекулярного
продукта необходимо
соблюдать стехиометрическое
соотношение функциональных
групп
r=0.8
0
0,2
0,4
q
0,6
0,8
1,0
[CA]<[CB] избыток HO-R'-OH приводит к композиционной неоднородности макромолекул
[CA]>[CB] избыток HOOC-R-COOH приводит к обрыву цепей и прекращению
Pn
3. Если присутствуют монофункциональные примеси
100
HOOC-R-COOH [CA]
HO-R'-OH [CB]
HOOC-R'' [A]
r
2[C A ]
2[C B ] + [A ]
Pn
1+ r
1 + r - 2 rq
r=1
или при q=1
75
Pn
50
1+ r
1- r
r=0.95
r=0.93
(r=0.95 + 0.05 моль [COOH])
25
42
0
0,2
0,4
0,6
0,8
1,0
46.
СПЕЦИФИЧЕСКИЕ СВОЙСТВА ПОЛИМЕРОВ• Невыполнение закона постоянства состава в
ходе синтеза или химических превращений
полимеров
• Способность кодировать, сохранять и
передавать генетическую информацию (ДНК,
РНК)
• Высокоэластические деформации (~ сотни %)
• Резкое изменение физико-механических
свойств при добавлении небольших количеств
низкомолекулярных веществ (пластификация,
46
сшивание)
47.
Специфические свойства полимеров3131
Невыполнение закона постоянства состава и, как
следствие, полимолекулярность (полидисперсность)
полимеров
Причиной этого являются:
-вероятностный (случайный) характер элементарных стадий
радикальной полимеризации реакций обрыва и передачи
цепи;
-использование инициатора полимеризации (радикальной,
катионной и анионной), инициирующие частицы которого
становятся концевыми группами в макромолекулах, но, как
правило, отличаются по химической природе от мономерных
звеньев макромолекул;
-побочные реакции деструкции, внутри- и межмолекулярной
47
циклизации в реакциях поликонденсации.
48.
Образование очень вязких растворов прималых концентрациях
Способность к набуханию (ограниченное,
неограниченное – раствор)
Способность к образованию анизотропных
структур (волокна, плёнки)
Деструкция (деполимеризация)
Способность макромолекул превращать
химическую энергию в механическую
48
49.
МОЛЕКУЛЯРНО-МАССОВЫЕ ХАРАКТЕРИСТИКИ ПОЛИМЕРОВСРЕДНИЕ МОЛЕКУЛЯРНЫЕ МАССЫ
49
-среднечисловая молекулярная масса Mn
-средневесовая молекулярная масса Mw
Mn
MN
M n
N
i
i
i i
i
Mw
Mz
2
M
i Ni
M i Ni
M i wi
3
M
i Ni
2
M
i Ni
Z-средняя молекулярная масса
Числовая доля
ni
Ni
Ni
Массовая доля
M i Ni
wi
M i Ni
Mn < Mw < Mz
Если все макромолекулы
одной молекулярной
массы – образец
монодисперсный
Mn Mw Mz
Mw Mn 1
Определяется в экспериментах по седиментационно-
50.
Задача2. Образец полимера содержит: 10 молекул с мол. массой 10000050
10000
40
1000
найти средневесовую (Mw) и среднечисловую (Mn) молекулярные массы
Mn
Mw
M i Ni
Ni
i
i
i
2
M
i Ni
M N
Mn
MN
N
i
Mw
M N
M N
2
i
i
i
i
i
10 *105 + 50*10 4 + 40*103
15400
10 + 50 + 40
10*(105 ) 2 + 50* (10 4 ) 2 + 40*(103 ) 2
75000
5
4
3
10*10 + 50*10 + 40*10
Ответ:
среднечисловая молекулярная масса 15400,
средневесовая молекулярная масса 75000
50
51.
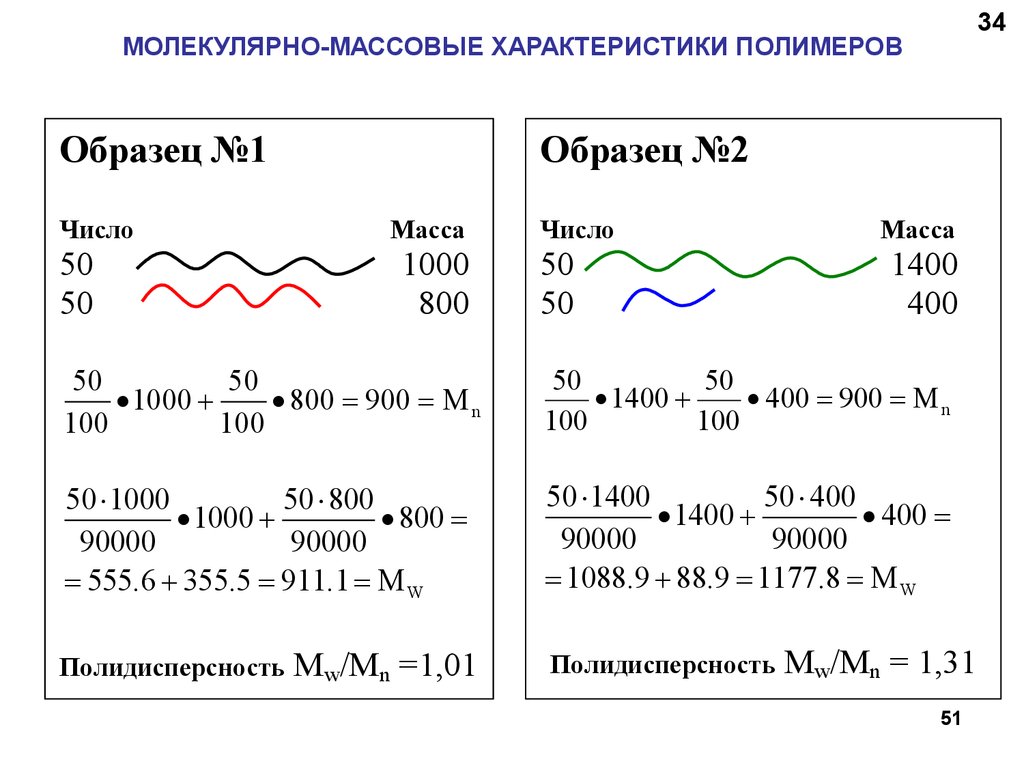
МОЛЕКУЛЯРНО-МАССОВЫЕ ХАРАКТЕРИСТИКИ ПОЛИМЕРОВОбразец №1
Число
50
50
3434
Образец №2
Масса
1000
800
Число
50
50
Масса
1400
400
50
50
1000 +
800 900 M n
100
100
50
50
1400 +
400 900 M n
100
100
50 1000
50 800
1000 +
800
90000
90000
555.6 + 355.5 911.1 M W
50 1400
50 400
1400 +
400
90000
90000
1088.9 + 88.9 1177.8 M W
Полидисперсность
Mw/Mn =1,01
Полидисперсность
Mw/Mn = 1,31
51
52.
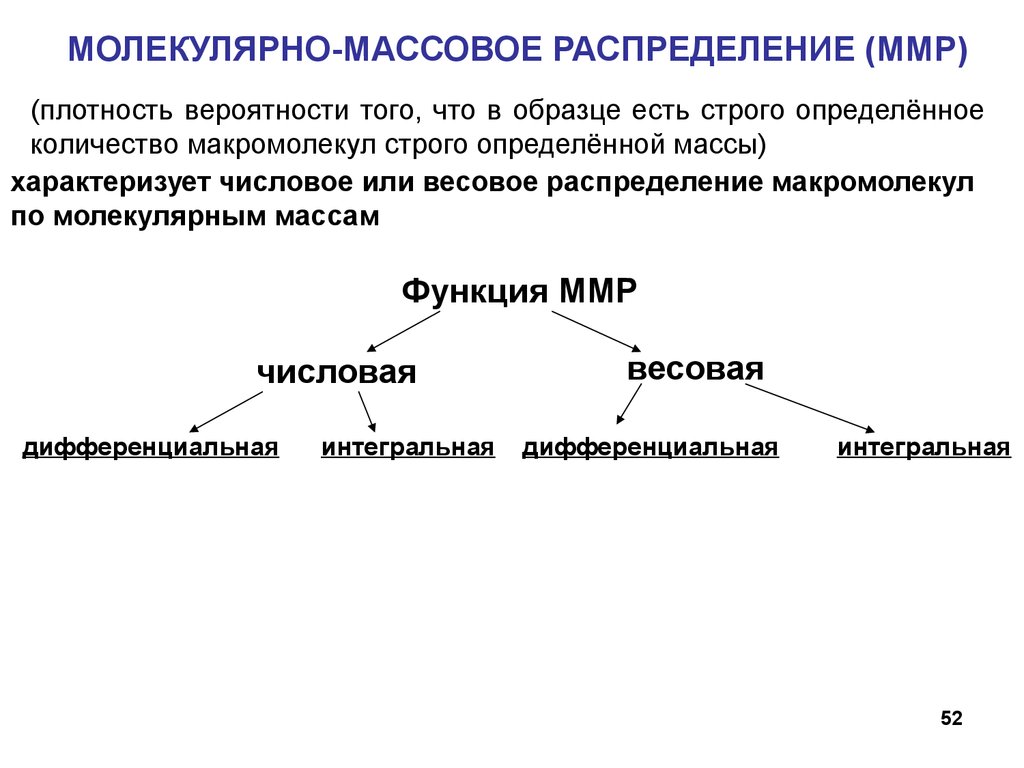
МОЛЕКУЛЯРНО-МАССОВОЕ РАСПРЕДЕЛЕНИЕ (ММР)(плотность вероятности того, что в образце есть строго определённое
количество макромолекул строго определённой массы)
характеризует числовое или весовое распределение макромолекул
по молекулярным массам
Функция ММР
числовая
дифференциальная
интегральная
весовая
дифференциальная
интегральная
52
53.
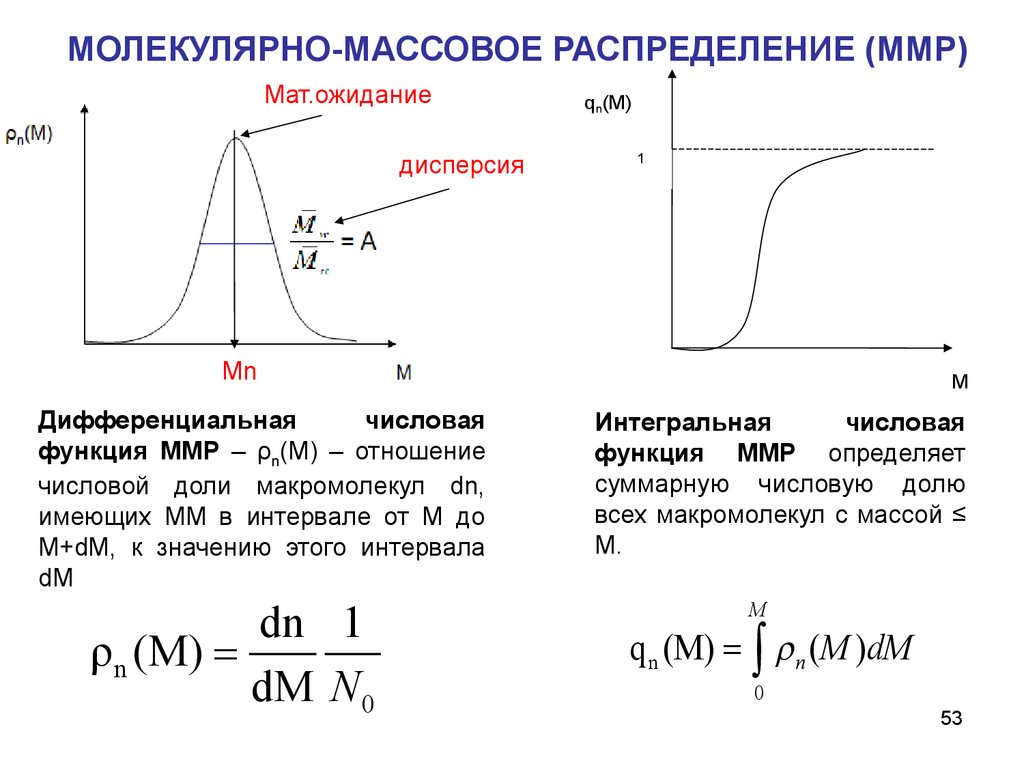
МОЛЕКУЛЯРНО-МАССОВОЕ РАСПРЕДЕЛЕНИЕ (ММР)Мат.ожидание
матмат
ддисперсия
qn(M)
1
МмМn
Дифференциальная
числовая
функция ММР – ρn(М) – отношение
числовой доли макромолекул dn,
имеющих ММ в интервале от М до
М+dM, к значению этого интервала
dM
dn 1
ρ n (M)
dM N 0
M
Интегральная
числовая
функция ММР определяет
суммарную числовую долю
всех макромолекул с массой ≤
M.
M
q n (M) ò n ( M )dM
0
53
54.
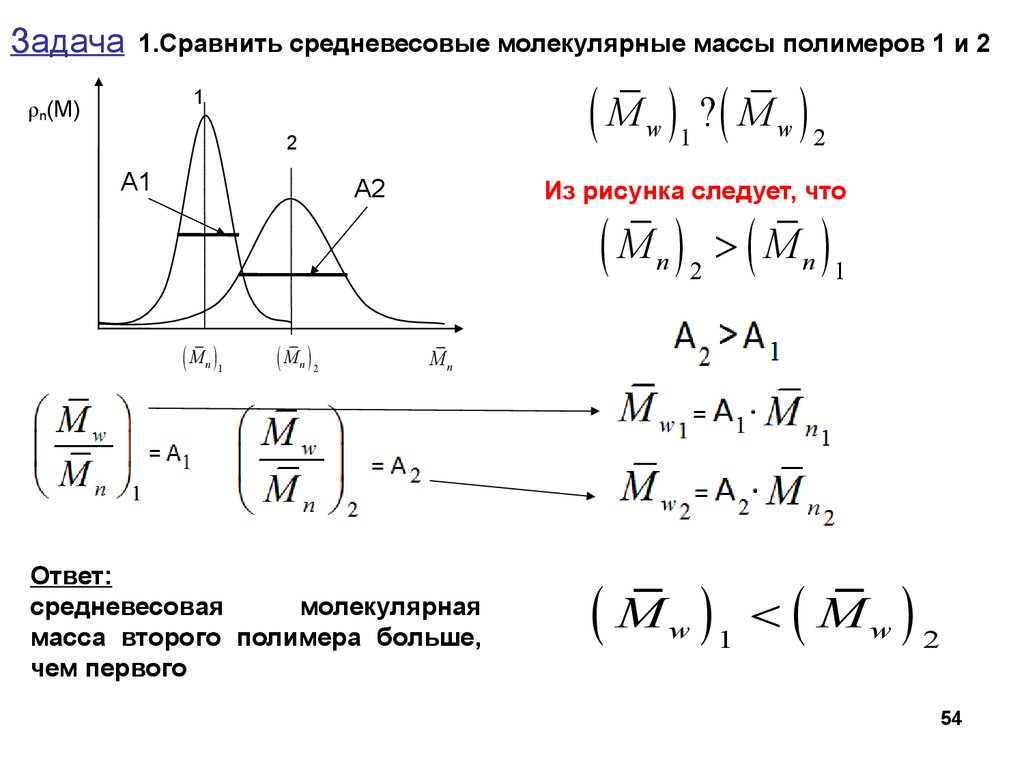
Задача1.Сравнить средневесовые молекулярные массы полимеров 1 и 2
( M ) ?( M )
1
ρn(M)
w 1
2
А1
AAA2
w 2
Из рисунка следует, что
(M ) >(M )
n 2
(M )
n 1
(M )
n 2
n 1
Mn
Ответ:
средневесовая
молекулярная
масса второго полимера больше,
чем первого
(M )
w
1
< ( Mw ) 2
54
55.
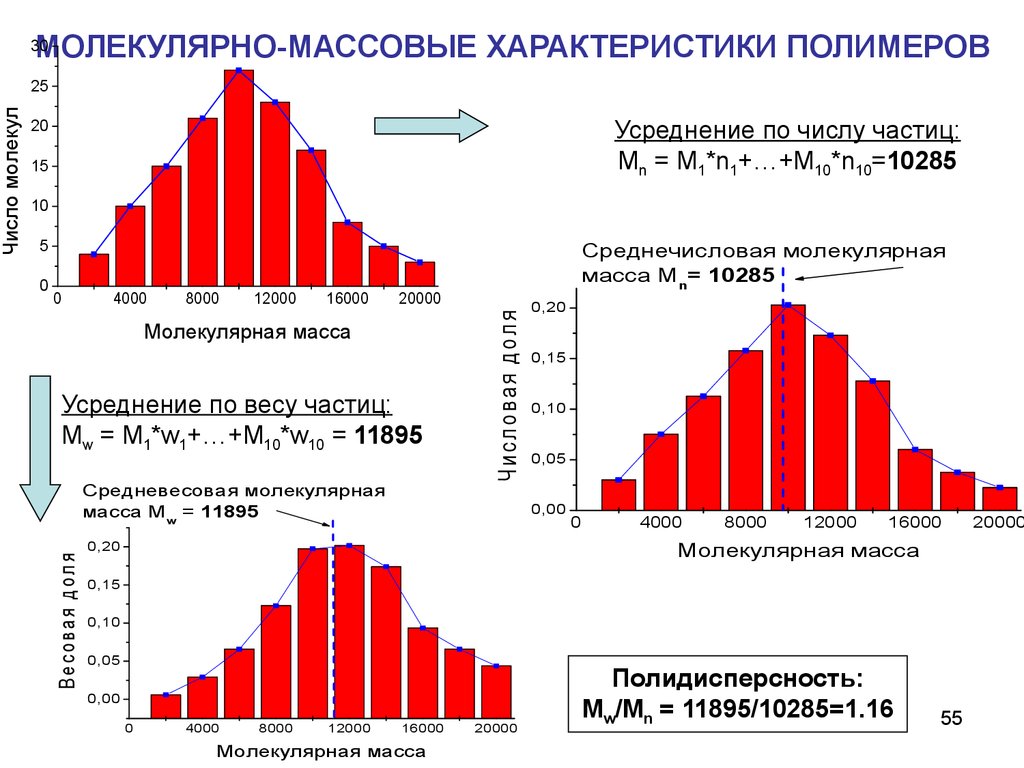
25Усреднение по числу частиц:
Mn = M1*n1+…+M10*n10=10285
20
15
10
5
0
4000
8000
12000
16000
Среднечисловая молекулярная
масса Mn= 10285
20000
Молекулярная масса
Усреднение по весу частиц:
Mw = M1*w1+…+M10*w10 = 11895
Средневесовая молекулярная
масса Mw = 11895
Ч исловая доля
0
В есовая доля
Число молекул
МОЛЕКУЛЯРНО-МАССОВЫЕ ХАРАКТЕРИСТИКИ ПОЛИМЕРОВ
30
0,20
0,15
0,10
0,05
0,00
0,20
0
4000
8000
12000
16000
Молекулярная масса
0,15
0,10
0,05
0,00
0
4000
8000
12000
16000
Молекулярная масса
20000
Полидисперсность:
Mw/Mn = 11895/10285=1.16
55
20000
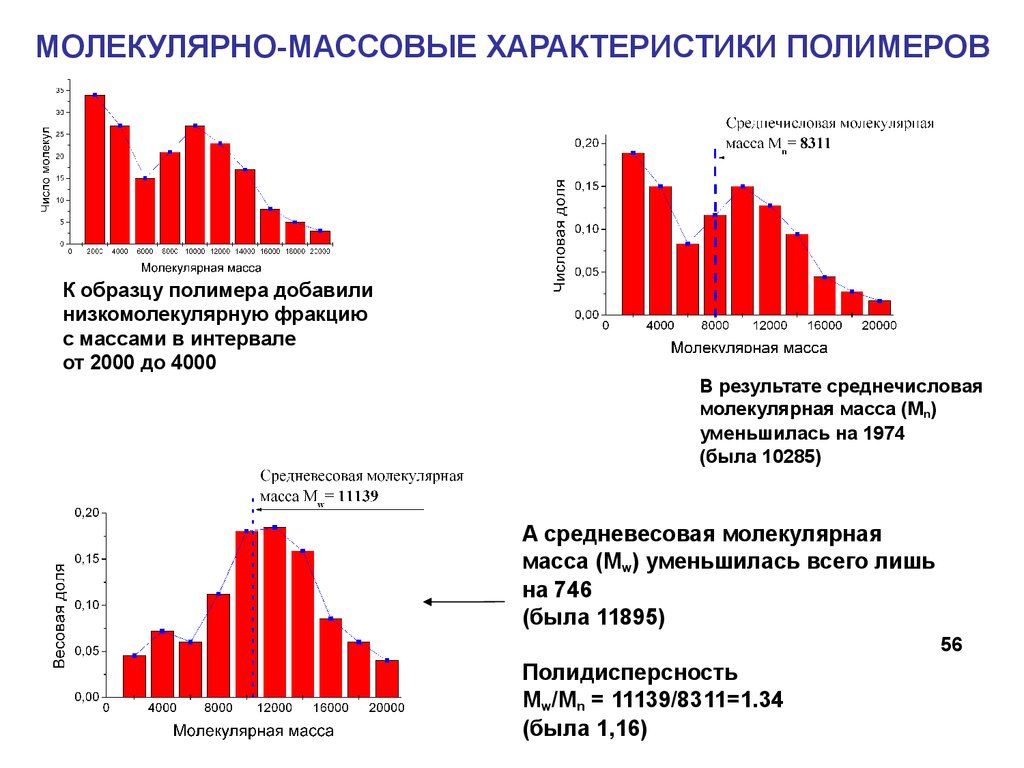
56.
МОЛЕКУЛЯРНО-МАССОВЫЕ ХАРАКТЕРИСТИКИ ПОЛИМЕРОВК образцу полимера добавили
низкомолекулярную фракцию
с массами в интервале
от 2000 до 4000
В результате среднечисловая
молекулярная масса (Mn)
уменьшилась на 1974
(была 10285)
А средневесовая молекулярная
масса (Mw) уменьшилась всего лишь
на 746
(была 11895)
56
Полидисперсность
Mw/Mn = 11139/8311=1.34
(была 1,16)
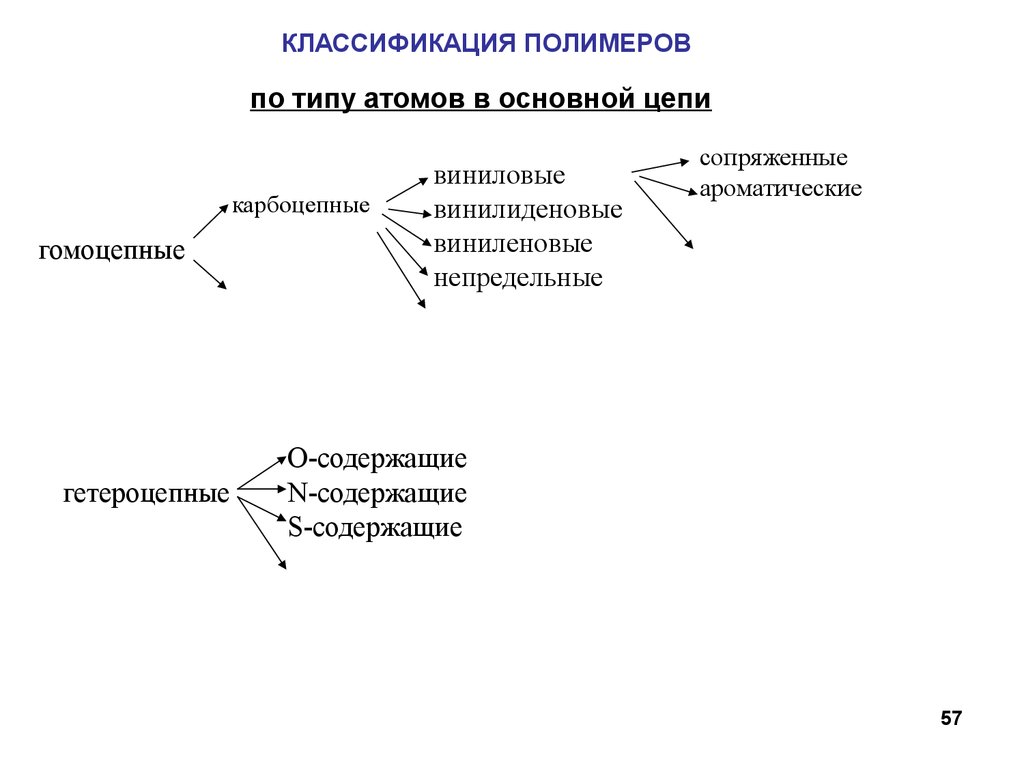
57.
КЛАССИФИКАЦИЯ ПОЛИМЕРОВпо типу атомов в основной цепи
карбоцепные
гомоцепные
гетероцепные
виниловые
винилиденовые
виниленовые
непредельные
сопряженные
ароматические
O-содержащие
N-содержащие
S-содержащие
57
58. задачи
К каким типам полимеров ( с точки зрения классификации) относится
полиамид-6 ?
1. линейный
2. элементоорганический
3. гетероцепной
4. сложный полиэфир
5. гомоцепной
6. полиамид
7. карбоцепной
8. органический
(дайте правильный ответ, который является суммой из предложенных
вариантов классификации)
Ответы: 18
10
14
7
58
59. задачи
Среди перечисленных полимеров выделите гетероцепные:
1. полиметилметакрилат
2. полиамид 6,14
3. целлюлоза
4. полиформальдегид
5. полиэтиленоксид
6. полиакриламид
7. полиакрилонитрил
8. полиэтилентерефталат
Ответ: 22
16
11
все
• (дайте правильный ответ)
59
60.
6061.
6162.
6263.
6364.
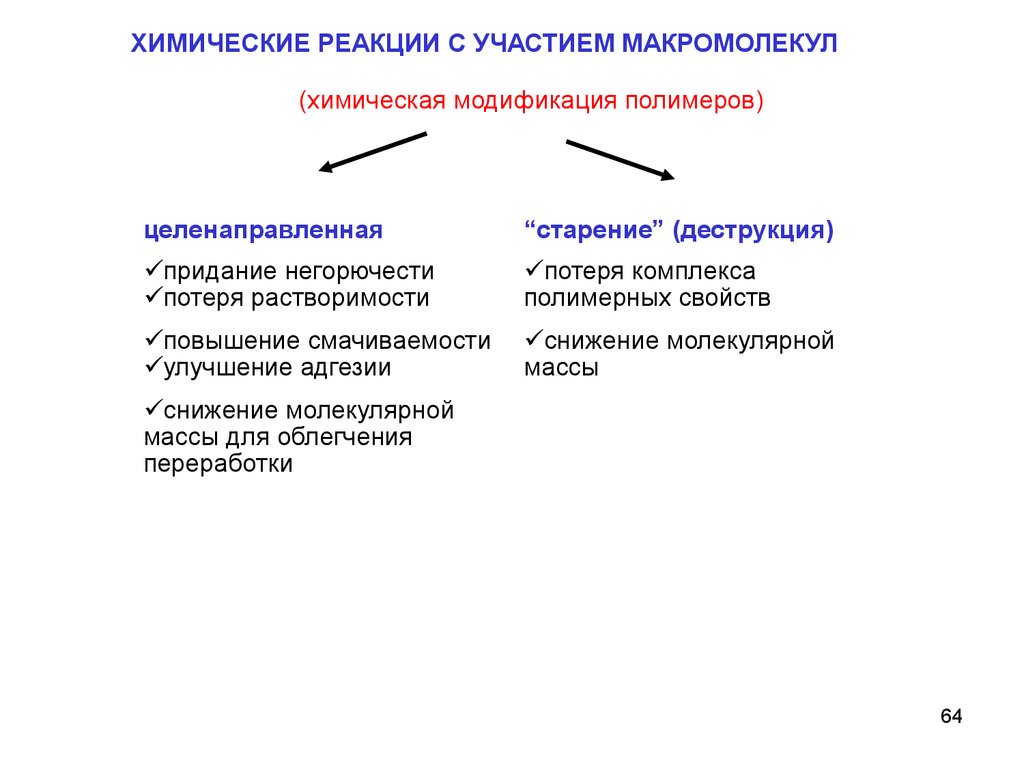
ХИМИЧЕСКИЕ РЕАКЦИИ С УЧАСТИЕМ МАКРОМОЛЕКУЛ(химическая модификация полимеров)
целенаправленная
“старение” (деструкция)
придание негорючести
потеря растворимости
потеря комплекса
полимерных свойств
повышение смачиваемости
улучшение адгезии
снижение молекулярной
массы
снижение молекулярной
массы для облегчения
переработки
64
65.
Изменение свойств ПЭ при хлорировании (Cl2, УФ)CH2
CH2
Cl2,УФ
n
CH2
-HCl
CH
CH2
CH2
Cl
CH
Cl
появление хлора в макромолекулах:
- повышает адгезию пленок к различным поверхностям;
- изменяет смачиваемость
H2O
H2O
ПЭ
ПЭ-Cl
-нарушает регулярность строения исходных макромолекул полиэтилена
нерегулярные молекулы не кристаллизуются!!!
T,˚C
размягчения
0
~ 90
8
~ 70
28
~ 20
40
~ 10
Прочность, кг/см2
% Cl
100
50
10 20 30
% Cl
65
66.
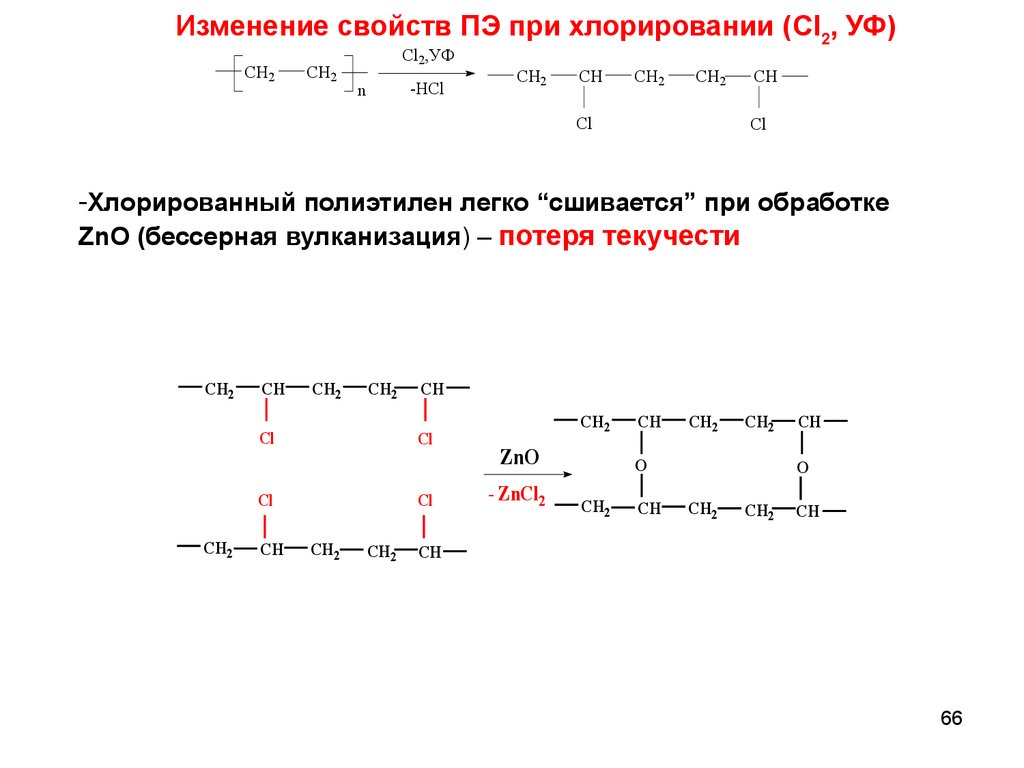
Изменение свойств ПЭ при хлорировании (Cl2, УФ)CH2
CH2
Cl2,УФ
-HCl
n
CH2
CH
CH2
CH2
Cl
CH
Cl
-Хлорированный полиэтилен легко “сшивается” при обработке
ZnO (бессерная вулканизация) – потеря текучести
CH2
CH
CH2
CH2
Cl
Cl
Cl
CH2
CH
CH
Cl
CH2
CH2
CH2
ZnO
- ZnCl2
CH
CH2
CH2
O
CH2
CH
CH
O
CH2
CH2
CH
CH
66
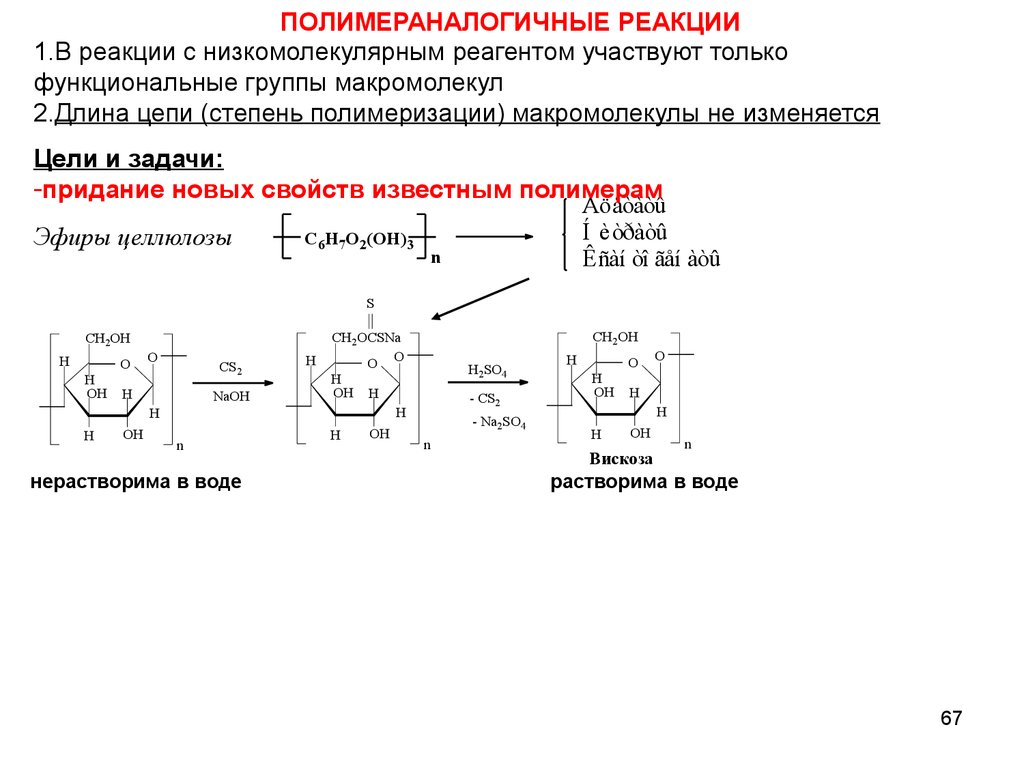
67.
ПОЛИМЕРАНАЛОГИЧНЫЕ РЕАКЦИИ1.В реакции с низкомолекулярным реагентом участвуют только
функциональные группы макромолекул
2.Длина цепи (степень полимеризации) макромолекулы не изменяется
Цели и задачи:
-придание новых свойств известным полимерам
Эфиры целлюлозы
C6H7O2(OH)3
Àöåòàòû
Í èòðàòû
Êñàí òî ãåí àòû
n
S
CH2OH
H
O
H
OH
O
CS2
H
NaOH
H
H
OH
OH
H2SO4
H
- CS2
H
H
H
CH2OH
CH2OCSNa
O O
n
нерастворима в воде
H
OH
- Na2SO4
n
H
O
H
OH
H
H
OH
O
H
Вискоза
n
растворима в воде
67
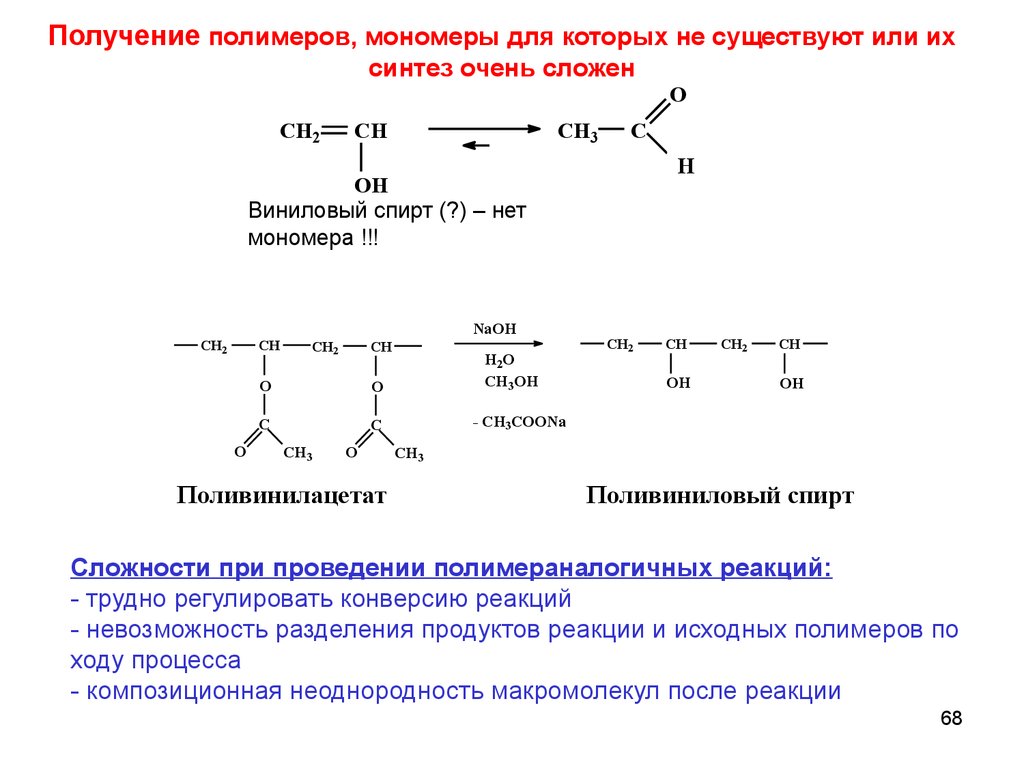
68.
Получение полимеров, мономеры для которых не существуют или ихсинтез очень сложен
O
CH2
CH
CH3
C
OH
H
OH
Виниловый спирт (?) – нет
мономера !!!
NaOH
CH2
CH
O
CH2
CH
O
O
C
C
CH3
O
Поливинилацетат
H2O
CH3OH
CH2
CH
OH
CH2
CH
OH
- CH3COONa
CH3
Поливиниловый спирт
Сложности при проведении полимераналогичных реакций:
- трудно регулировать конверсию реакций
- невозможность разделения продуктов реакции и исходных полимеров по
ходу процесса
- композиционная неоднородность макромолекул после реакции
68
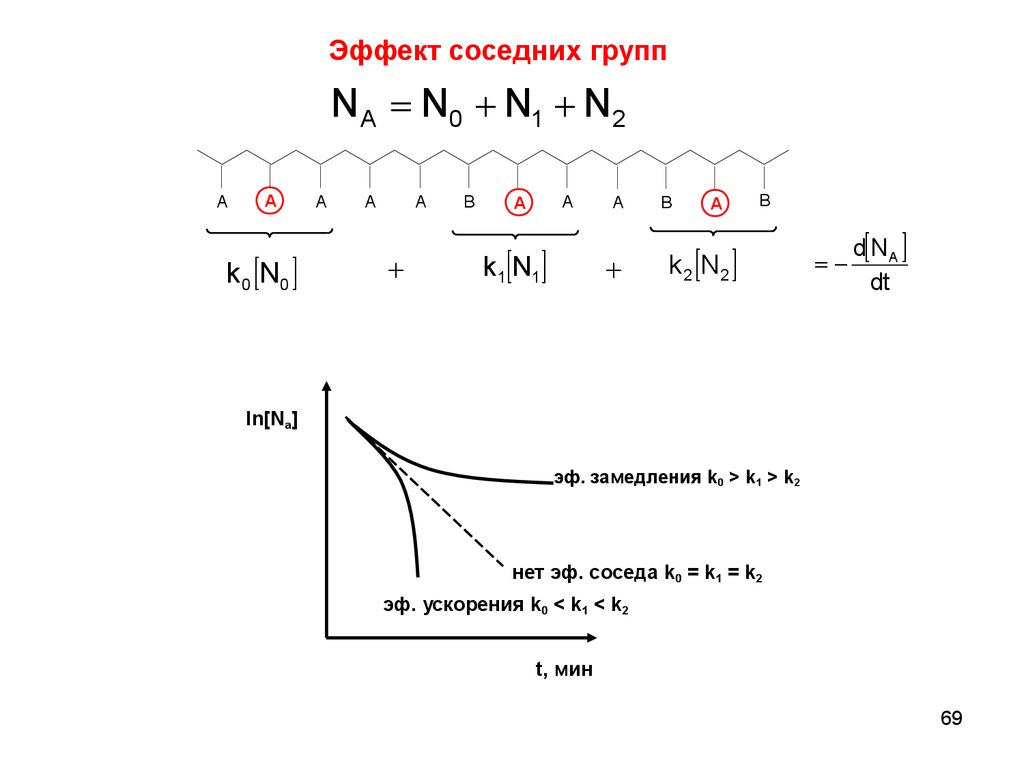
69.
Эффект соседних группN A N0 + N1 + N2
A
A
k 0 N0
A
A
A
+
B
A
A
k1 N1
A
+
B
A
B
k 2 N 2
-
d N A
dt
ln[Na]
эф. замедления k0 > k1 > k2
нет эф. соседа k0 = k1 = k2
эф. ускорения k0 < k1 < k2
t, мин
69
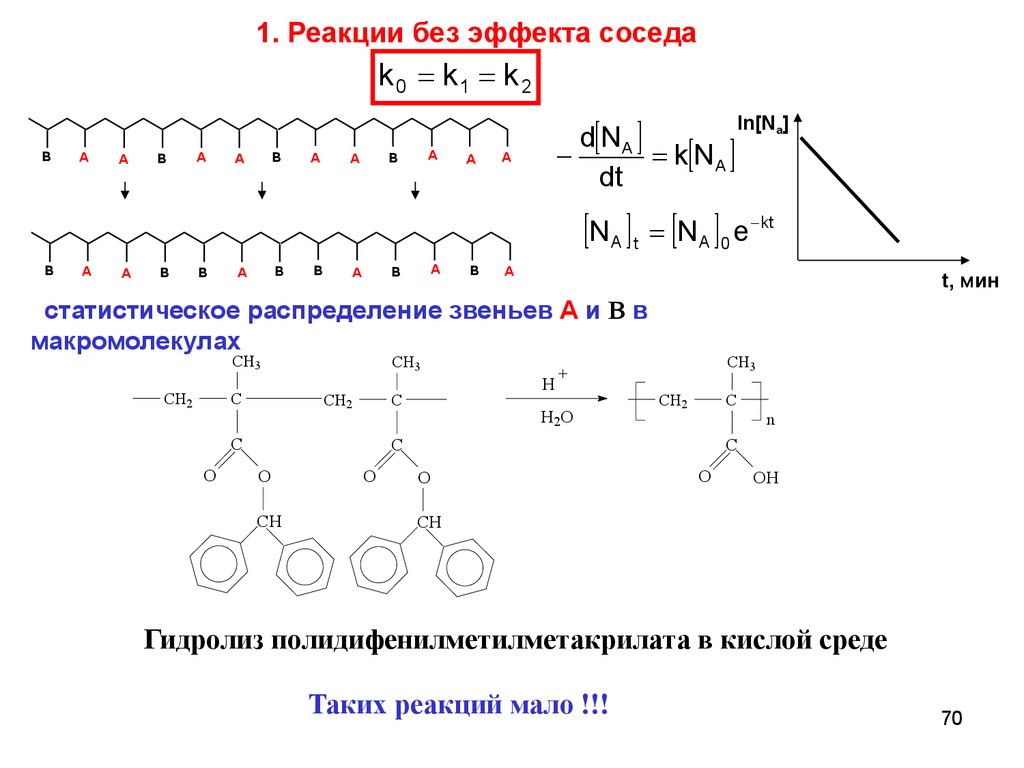
70.
1. Реакции без эффекта соседаk 0 k1 k 2
B
A
A
B
A
B
A
A
A
B
A
A
d N A
k N A
dt
A
ln[Na]
NA t NA 0 e -kt
B
A
A
B
B
B
A
B
A
B
A
B
A
t, мин
статистическое распределение звеньев А и B в
макромолекулах
CH3
CH2
C
CH3
CH2
C
O
H
C
CH3
+
H2 O
CH2
C
n
C
O
CH
O
C
O
O
OH
CH
Гидролиз полидифенилметилметакрилата в кислой среде
Таких реакций мало !!!
70
71.
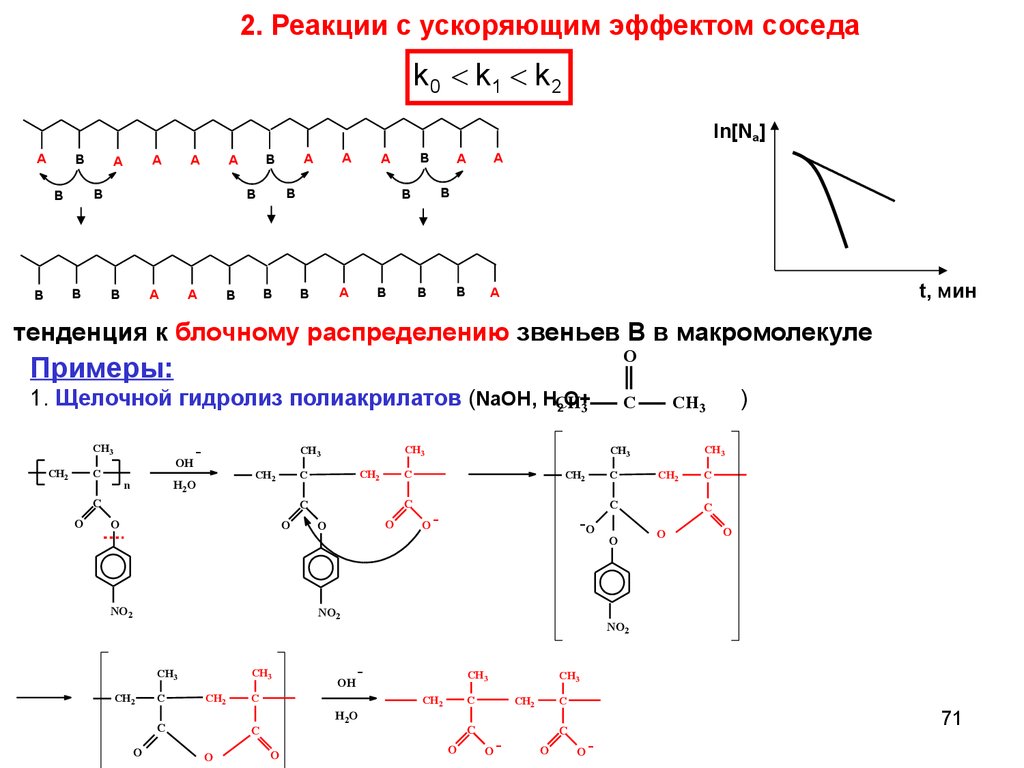
2. Реакции с ускоряющим эффектом соседаk 0 < k1 < k 2
ln[Na]
A
B
A
B
A
A
B
B
B
A
B
B
B
A
A
B
A
B
B
B
A
A
B
B
A
B
B
A
A
B
B
t, мин
A
тенденция к блочному распределению звеньев B в макромолекуле
Примеры:
O
1. Щелочной гидролиз полиакрилатов (NaOH, HCH
O+3
2
C
CH3
CH2
OH
C
CH2
H2O
n
CH2
C
C
O
CH3
CH3
C
C
O
O
NO2
O
O
CH2
CH3
CH2
C
CH2
C
O
-O
-
CH3
CH2
C
H2O
O
CH2
O
C
C
O
O
NO2
C
C
O
OH
C
C
O-
NO2
CH3
CH3
CH3
C
)
CH3
C
O
CH3
CH2
O-
C
C
O
71
O-
72.
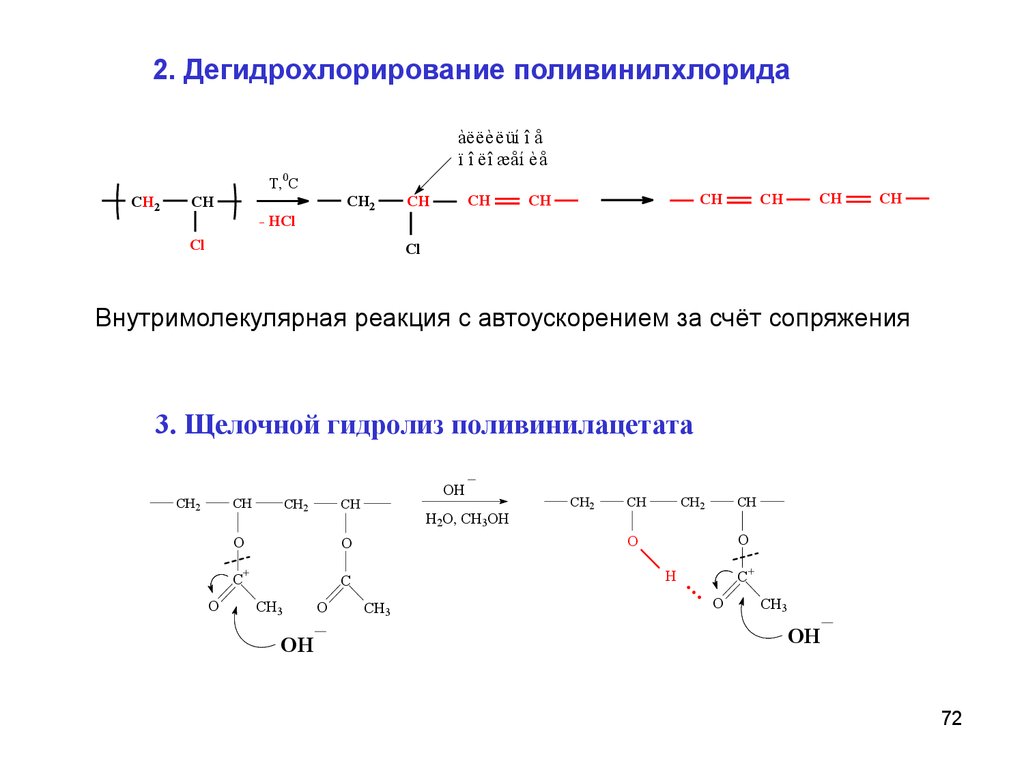
2. Дегидрохлорирование поливинилхлоридаàëëèëüí î å
ï î ëî æåí èå
T,0C
CH2
CH2
CH
- HCl
Cl
CH
CH
CH
CH
CH
CH
CH
Cl
Внутримолекулярная реакция с автоускорением за счёт сопряжения
3. Щелочной гидролиз поливинилацетата
CH2
CH
CH2
O
C
O
OH
CH
H2O, CH3OH
OH
O
CH2
CH
O
C+
H
C
CH3
CH
O
O
+
CH2
CH3
O
CH3
OH
72
73.
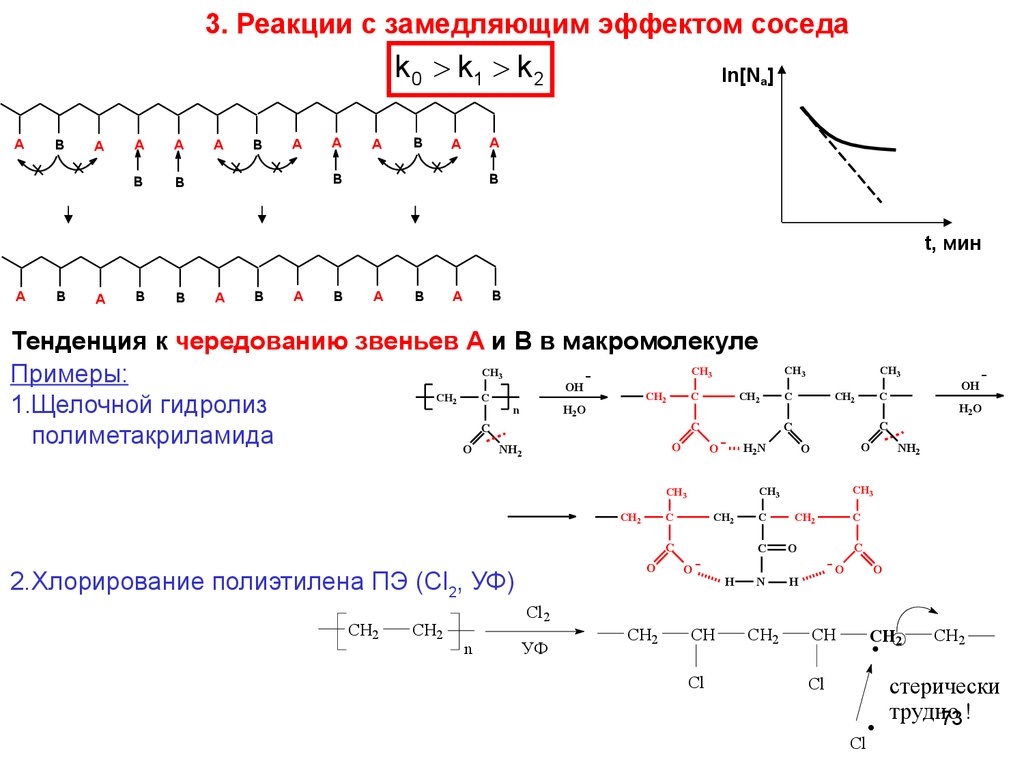
3. Реакции с замедляющим эффектом соседаk 0 > k1 > k 2
A
B
A
A
A
B
B
A
B
A
A
A
B
ln[Na]
A
A
B
B
t, мин
A
B
A
B
B
A
B
A
B
A
B
B
A
Тенденция к чередованию звеньев А и B в макромолекуле
CH
CH
Примеры:
OH
CH
CH
C
CH
C
1.Щелочной гидролиз
n
HO
C
C
полиметакриламида
O
O- H N
O
NH
3
3
2
2
2
CH3
CH3
C
CH2
OH
C
H2O
2
CH2
O
2.Хлорирование полиэтилена ПЭ (Cl2, УФ)
CH2
CH2
C
C
O
O
O-
H
C
NH2
CH3
CH3
CH3
CH2
C
C
2
2
-
CH2
C
O
N
H
C
-O
C
O
Cl2
n
УФ
CH2
CH
Cl
CH2
CH
CH2
CH2
стерически
трудно
73 !
Cl
Cl
74.
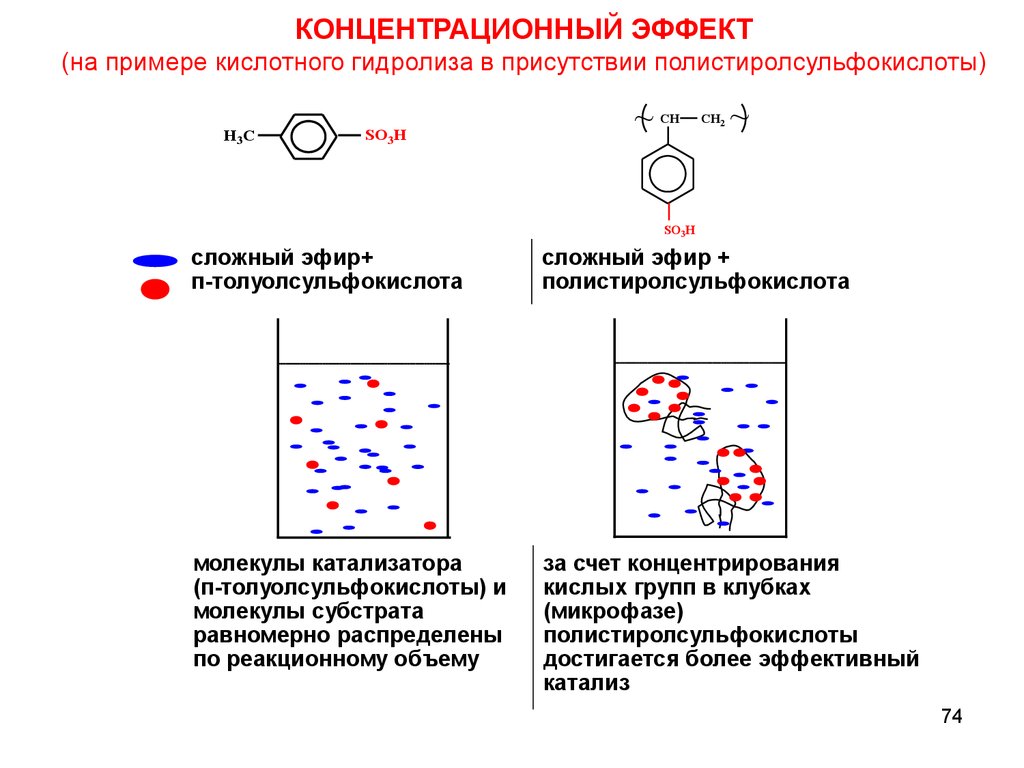
КОНЦЕНТРАЦИОННЫЙ ЭФФЕКТ(на примере кислотного гидролиза в присутствии полистиролсульфокислоты)
H3C
SO3H
~
CH
CH2
~
SO3H
сложный эфир+
п-толуолсульфокислота
сложный эфир +
полистиролсульфокислота
молекулы катализатора
(п-толуолсульфокислоты) и
молекулы субстрата
равномерно распределены
по реакционному объему
за счет концентрирования
кислых групп в клубках
(микрофазе)
полистиролсульфокислоты
достигается более эффективный
катализ
74
75.
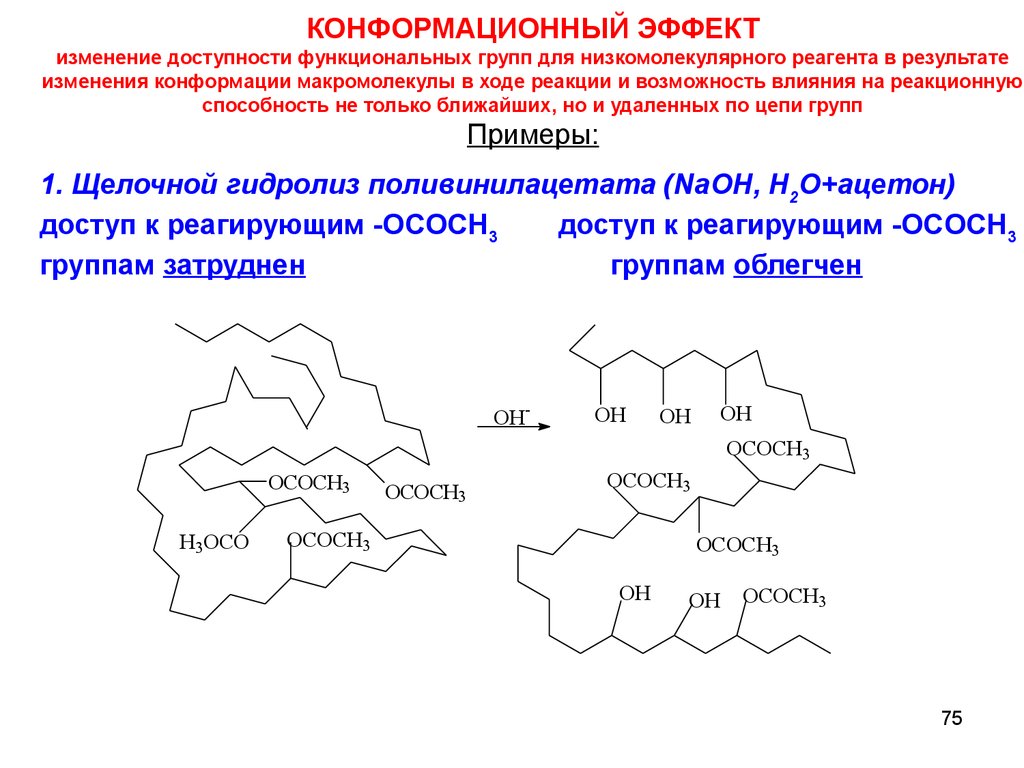
КОНФОРМАЦИОННЫЙ ЭФФЕКТизменение доступности функциональных групп для низкомолекулярного реагента в результате
изменения конформации макромолекулы в ходе реакции и возможность влияния на реакционную
способность не только ближайших, но и удаленных по цепи групп
Примеры:
1. Щелочной гидролиз поливинилацетата (NaOH, H2О+ацетон)
доступ к реагирующим -OCOCH3
доступ к реагирующим -OCOCH3
группам затруднен
группам облегчен
OH-
OH
OH
OH
OCOCH3
OCOCH3
H3OCO
OCOCH3
OCOCH3
OCOCH3
OCOCH3
OH
OH
OCOCH3
75
76.
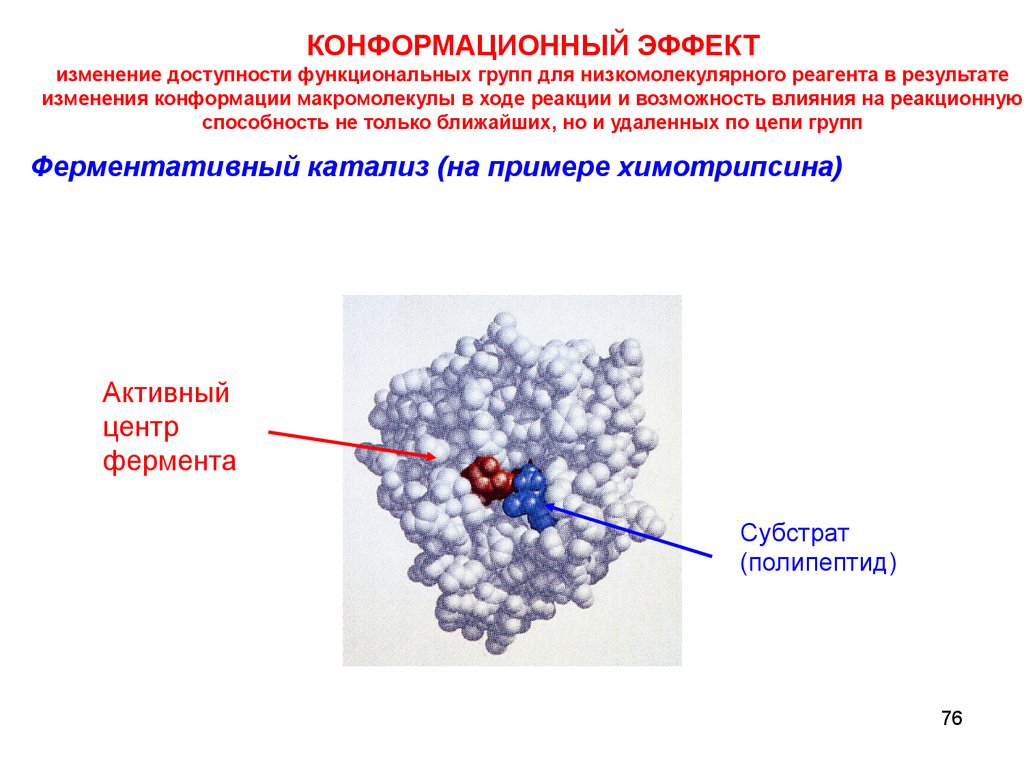
КОНФОРМАЦИОННЫЙ ЭФФЕКТизменение доступности функциональных групп для низкомолекулярного реагента в результате
изменения конформации макромолекулы в ходе реакции и возможность влияния на реакционную
способность не только ближайших, но и удаленных по цепи групп
Ферментативный катализ (на примере химотрипсина)
Активный
центр
фермента
Субстрат
(полипептид)
76
77.
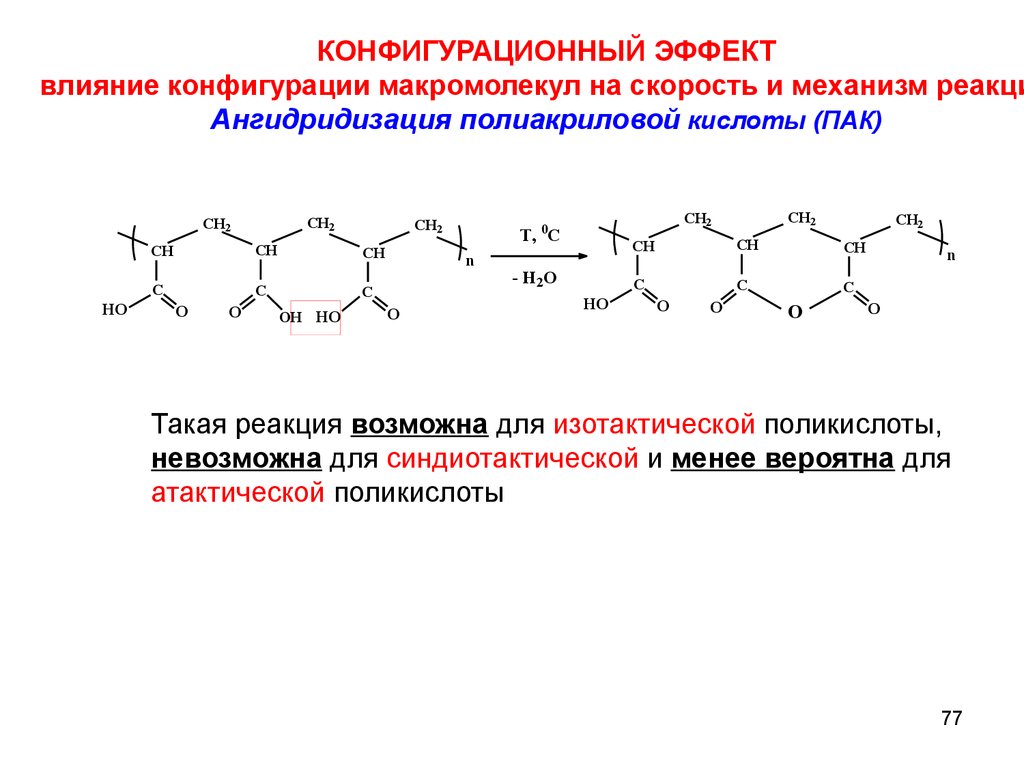
КОНФИГУРАЦИОННЫЙ ЭФФЕКТвлияние конфигурации макромолекул на скорость и механизм реакци
Ангидридизация полиакриловой кислоты (ПАК)
CH2
CH2
HO
CH2
CH
CH
CH
C
C
C
O
O
OH HO
n
O
CH2
CH2
T, 0C
CH
- H2O
C
HO
O
O
CH2
CH
CH
C
C
O
n
O
Такая реакция возможна для изотактической поликислоты,
невозможна для синдиотактической и менее вероятна для
атактической поликислоты
77
78.
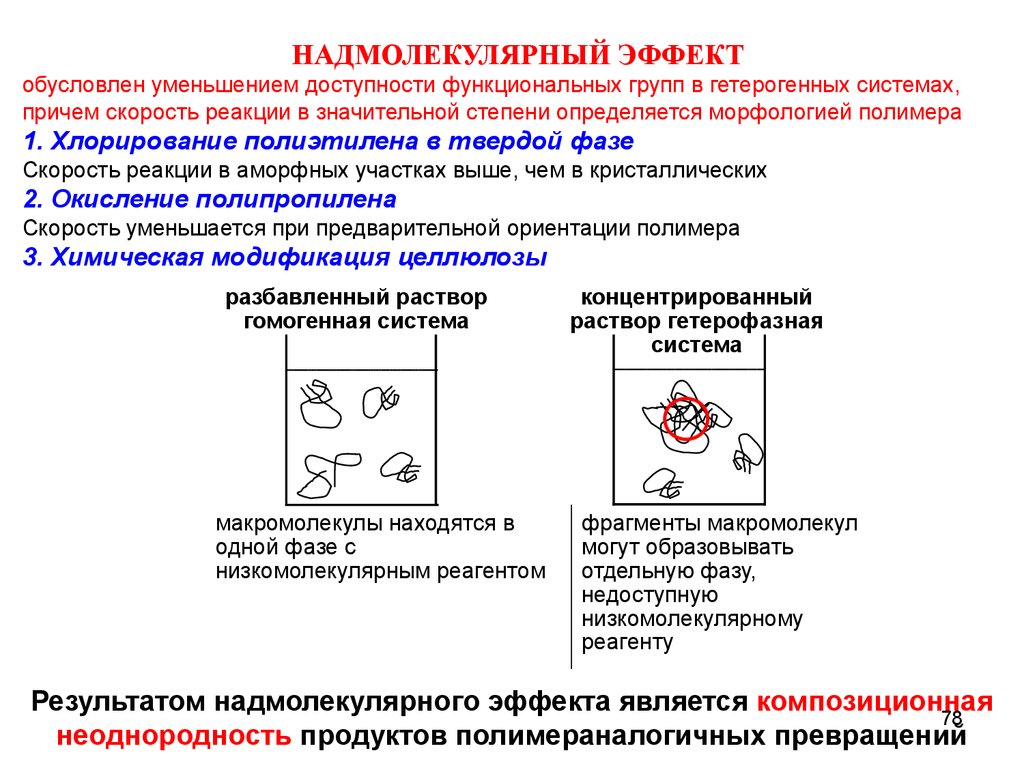
НАДМОЛЕКУЛЯРНЫЙ ЭФФЕКТобусловлен уменьшением доступности функциональных групп в гетерогенных системах,
причем скорость реакции в значительной степени определяется морфологией полимера
1. Хлорирование полиэтилена в твердой фазе
Скорость реакции в аморфных участках выше, чем в кристаллических
2. Окисление полипропилена
Скорость уменьшается при предварительной ориентации полимера
3. Химическая модификация целлюлозы
разбавленный раствор
гомогенная система
макромолекулы находятся в
одной фазе с
низкомолекулярным реагентом
концентрированный
раствор гетерофазная
система
фрагменты макромолекул
могут образовывать
отдельную фазу,
недоступную
низкомолекулярному
реагенту
Результатом надмолекулярного эффекта является композиционная
78
неоднородность продуктов полимераналогичных превращений
79.
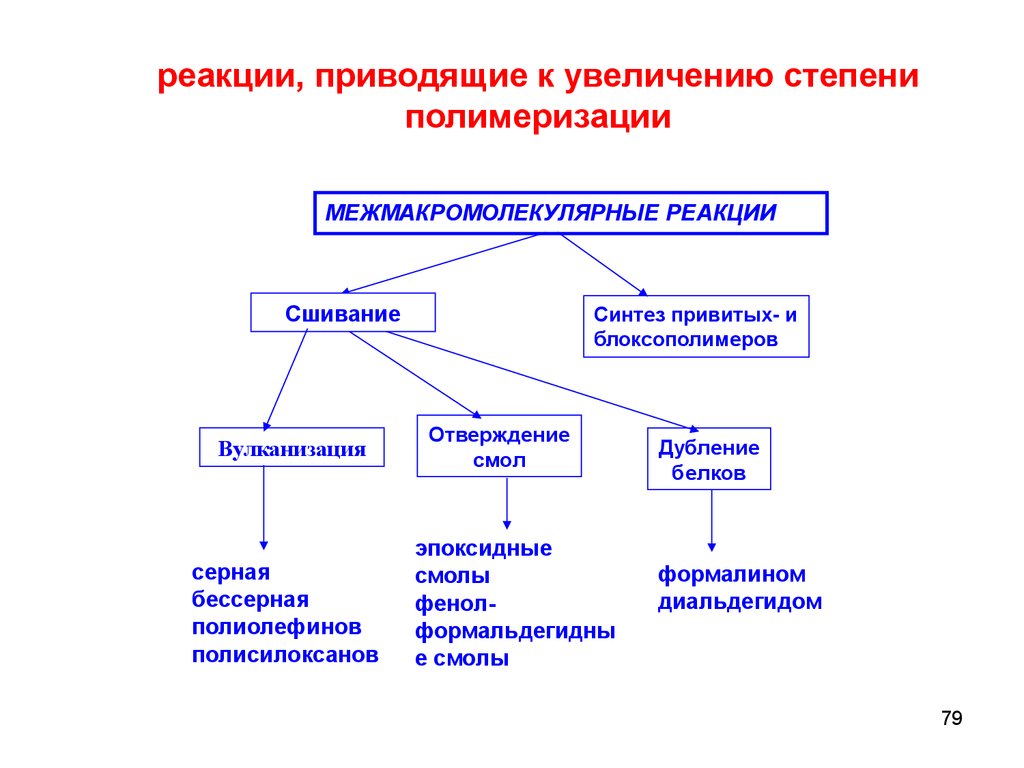
реакции, приводящие к увеличению степениполимеризации
МЕЖМАКРОМОЛЕКУЛЯРНЫЕ РЕАКЦИИ
Сшивание
Вулканизация
серная
бессерная
полиолефинов
полисилоксанов
Синтез привитых- и
блоксополимеров
Отверждение
смол
эпоксидные
смолы
фенолформальдегидны
е смолы
Дубление
белков
формалином
диальдегидом
79
80.
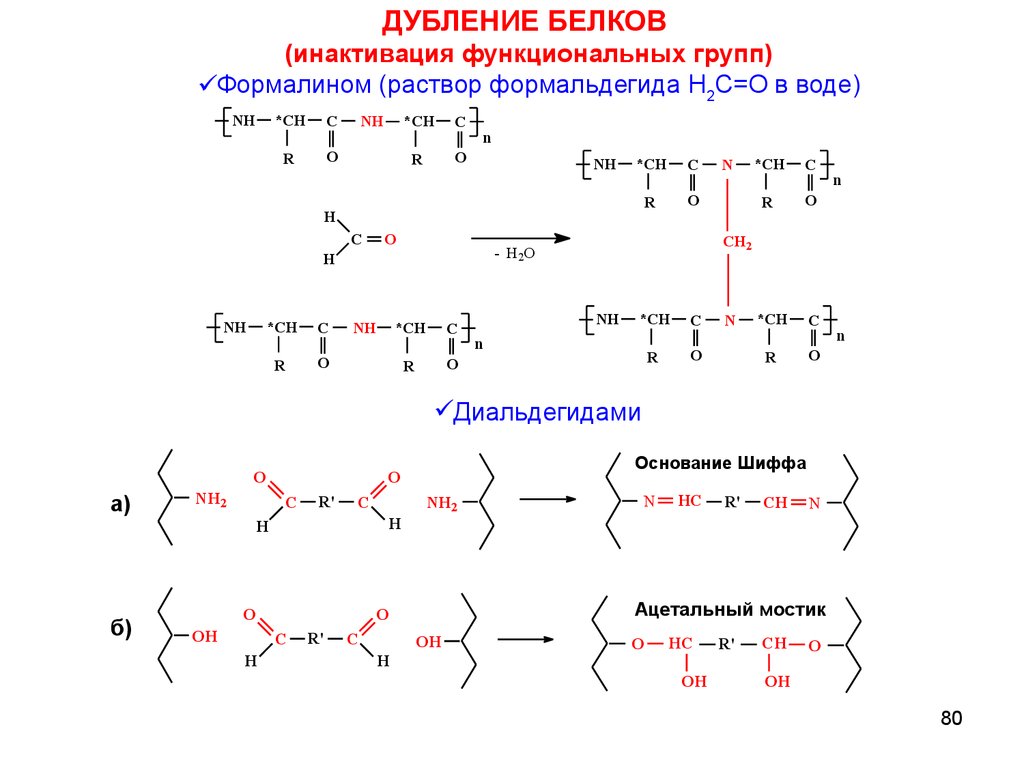
ДУБЛЕНИЕ БЕЛКОВ(инактивация функциональных групп)
Формалином (раствор формальдегида H2C=O в воде)
NH
*CH
C
R
O
NH
*CH
C
R
O
n
NH
*CH
C
R
O
H
С
O
NH
*CH
C
R
O
NH
*CH
C
R
O
*CH
C
R
O
*CH
C
R
O
n
CH2
- H2O
H
N
NH
*CH
C
R
O
n
N
n
Диальдегидами
O
а)
NH2
С
R'
С
O
OH
N
HС
R'
CH
N
Ацетальный мостик
O
С
H
NH2
H
H
б)
Основание Шиффа
O
R'
С
OH
H
O
HС
OH
R'
CH
O
OH
80
81.
ROOR2
2RO
~
+
RO
~
Сшивание полиолефинов
а) под действием перекисей
CH2
CH2
CHR
CH
CHR
~
ROH +
~
CH2
CHR
H
CHR
CH
CHR
~
~
~
CH
CHR
~
~
~
CH2
CHR
CH
CHR
CH2
CHR
CH
CHR
б) хлорирование и обработка ZnO (бессерная вулканизация)
Сшивание полисилоксанов
1. введение двойных связей:
CH3
HO
Si
CH3
CH3
OH
+ HO
Si
CH3
OH
CH=CH2
Si
CH3
CH3
O
Si
CH=CH2
2. обработка полученного полимера
серная вулканизация
обработка радикальными инициаторами
хлорирование и бессерная вулканизация
81
82.
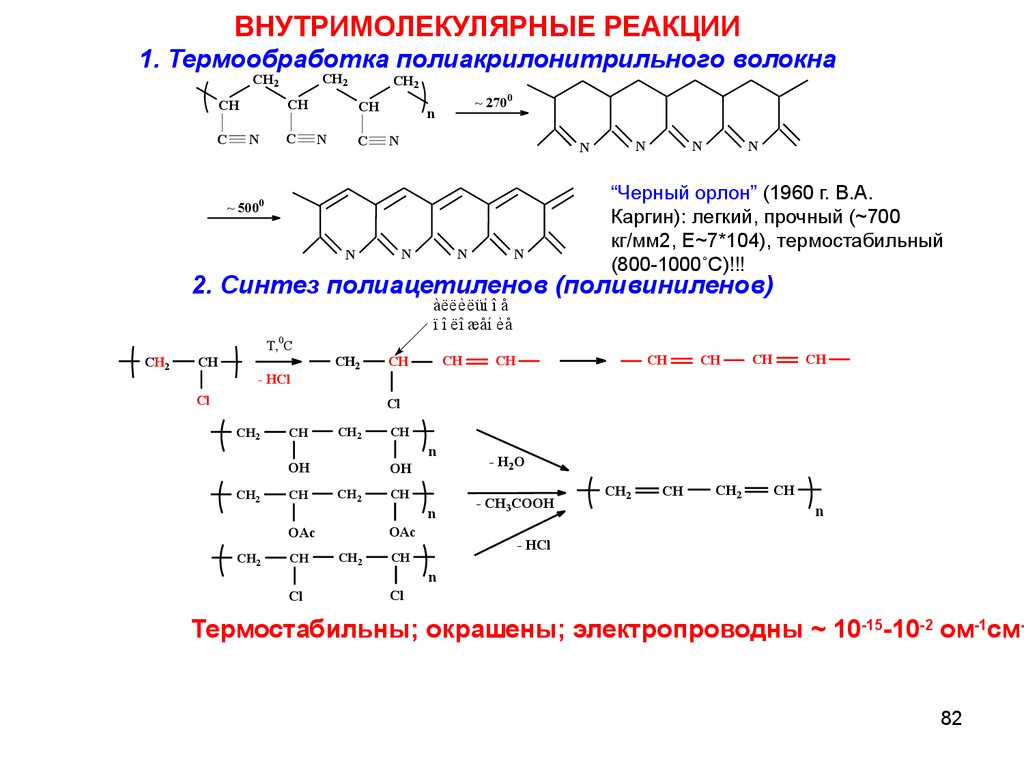
ВНУТРИМОЛЕКУЛЯРНЫЕ РЕАКЦИИ1. Термообработка полиакрилонитрильного волокна
CH2
CH2
CH
CH
C
N
C
CH2
CH
N
C
~ 2700
n
N
~ 5000
N
N
N
N
N
N
N
N
“Черный орлон” (1960 г. В.А.
Каргин): легкий, прочный (~700
кг/мм2, Е~7*104), термостабильный
(800-1000˚С)!!!
2. Синтез полиацетиленов (поливиниленов)
àëëèëüí î å
ï î ëî æåí èå
T,0C
CH2
CH
- HCl
CH2
Cl
CH
CH
CH
CH
CH
CH
CH
Cl
CH2
CH
CH2
CH
n
OH
CH2
CH
OH
CH2
CH
n
OAc
OAc
CH2
CH
CH2
- H2O
- CH3COOH
CH2
CH
CH2
CH
n
- HCl
CH
n
Cl
Cl
Термостабильны; окрашены; электропроводны ~ 10-15-10-2 ом-1см82
83.
ПРИВИТЫЕ И БЛОК-СОПОЛИМЕРЫМИКРОФАЗОВОЕ РАССЛОЕНИЕ
Каждая фаза проявляет свои свойства. Эти фазы обнаруживаются и
структурно, и термодинамически.
В целом свойства блок- и привитых сополимеров суммируются из
свойств компонентов.
83
84.
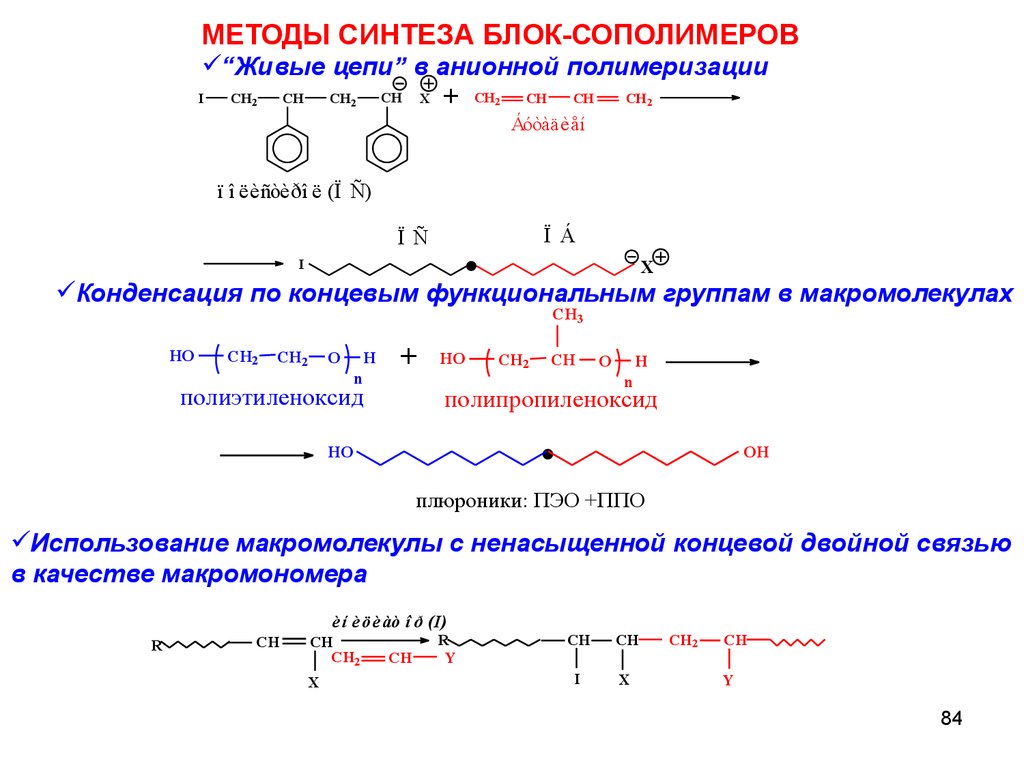
МЕТОДЫ СИНТЕЗА БЛОК-СОПОЛИМЕРОВ“Живые цепи” в анионной полимеризации
CH X + CH2
I
CH2
CH
CH
CH2
CH
CH2
Áóòàäèåí
ï î ëèñòèðî ë (Ï Ñ)
ÏÁ
ÏÑ
I
X
Конденсация по концевым функциональным группам в макромолекулах
CH3
HO
CH2
CH2
O
H
n
+
полиэтиленоксид
HO
CH2
CH
O
H
n
полипропиленоксид
HO
OH
плюроники: ПЭО +ППО
Использование макромолекулы с ненасыщенной концевой двойной связью
в качестве макромономера
è í è öè àò î ð (I)
R
CH
CH
CH2
X
CH
R
Y
CH
CH
I
X
CH2
CH
Y
84
85.
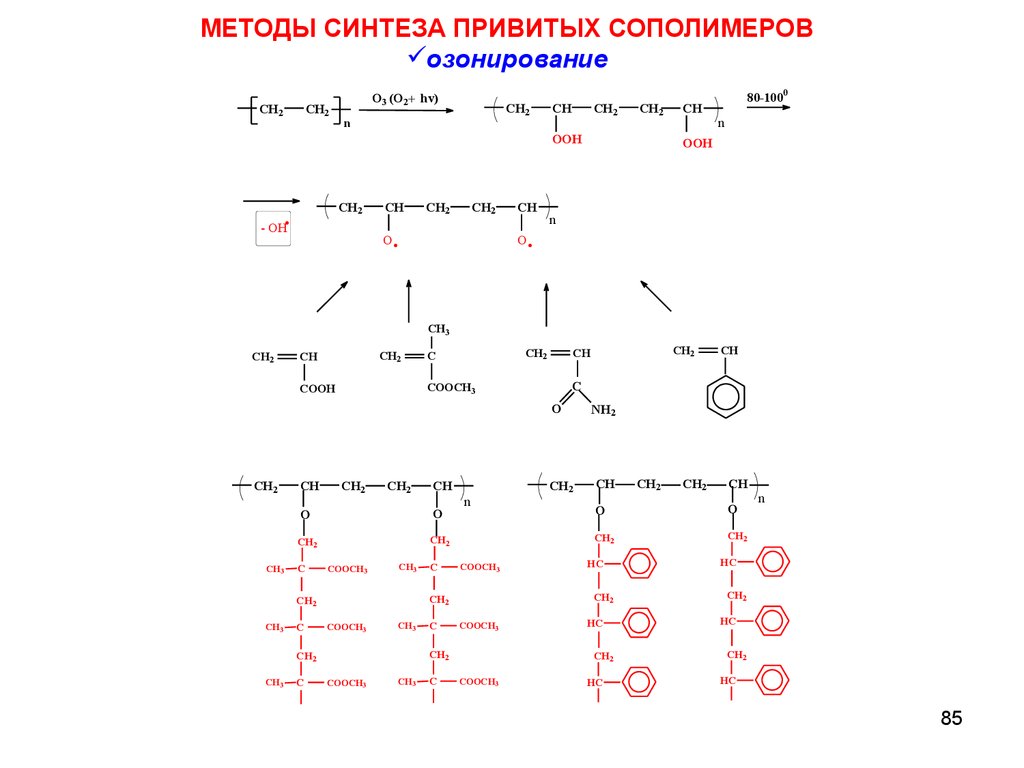
МЕТОДЫ СИНТЕЗА ПРИВИТЫХ СОПОЛИМЕРОВозонирование
CH2
CH2
O3 (O2+ hv)
CH2
n
CH
CH2
CH2
OOH
.
CH2
- OH
CH
.
CH2
CH2
O
CH
.
80-1000
CH
n
OOH
n
O
CH3
CH2
CH2
CH
CH2
C
O
CH2
CH3
CH
CH2
CH2
O
O
CH2
CH2
C
COOCH3
CH3
C
COOCH3
CH3
C
COOCH3
C
COOCH3
CH3
C
CH2
NH2
CH
COOCH3
CH2
CH
O
CH2
CH2
HC
HC
CH2
COOCH3
CH2
O
CH2
CH2
CH2
CH3
C
n
CH2
CH2
CH3
CH
CH
C
COOCH3
COOH
CH2
CH
HC
n
HC
CH2
HC
CH2
HC
85
86.
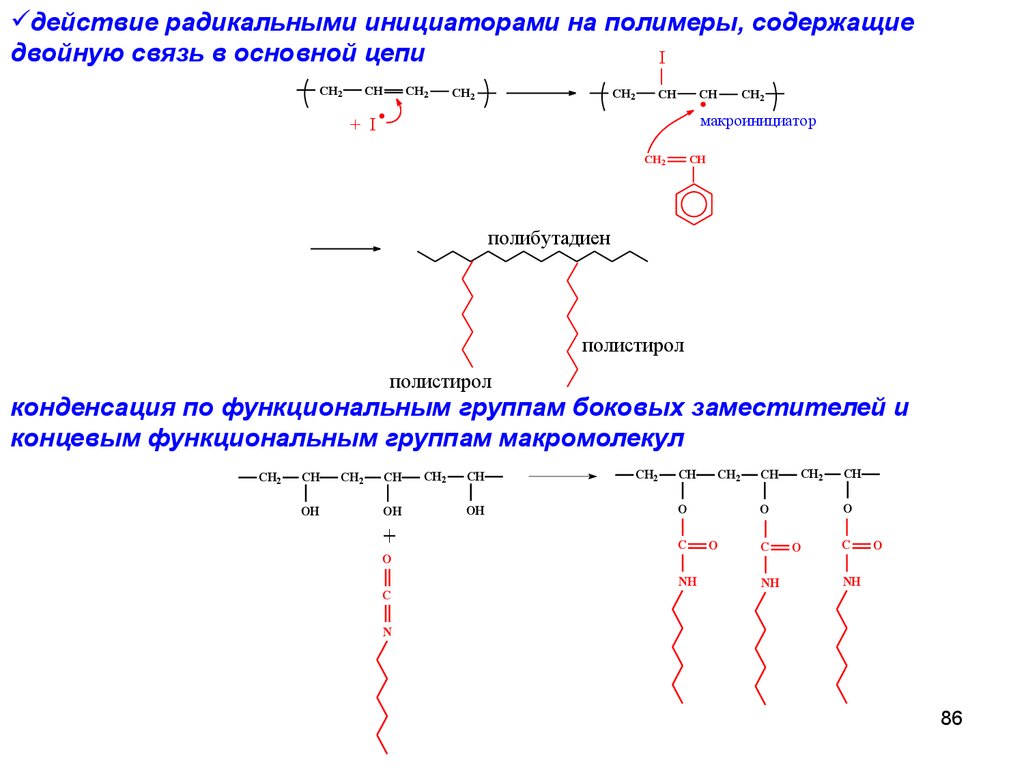
действие радикальными инициаторами на полимеры, содержащиедвойную связь в основной цепи
I
CH2
CH
CH2
CH2
CH2
CH
CH
CH2
макроинициатор
+ I
CH2
CH
полибутадиен
полистирол
полистирол
конденсация по функциональным группам боковых заместителей и
концевым функциональным группам макромолекул
CH2
CH
OH
CH2
CH
OH
+
O
C
CH2
CH
OH
CH2
CH
CH2
O
C
NH
CH
CH2
O
O
O
C
NH
CH
O
C
O
NH
N
86
87.
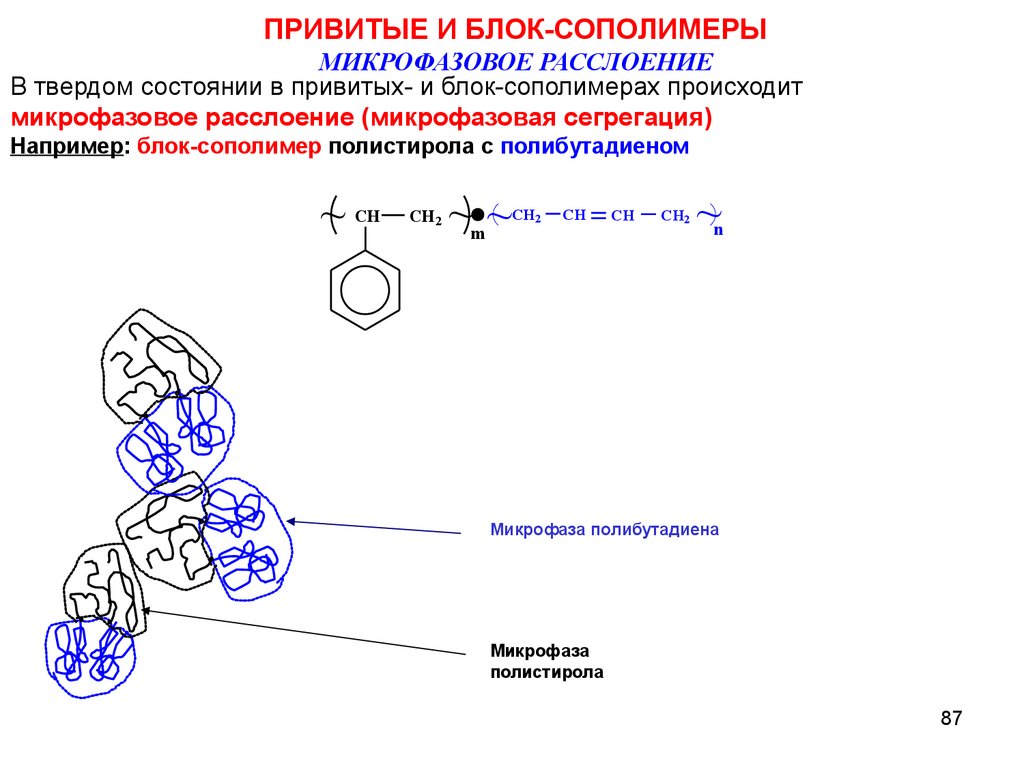
ПРИВИТЫЕ И БЛОК-СОПОЛИМЕРЫМИКРОФАЗОВОЕ РАССЛОЕНИЕ
В твердом состоянии в привитых- и блок-сополимерах происходит
микрофазовое расслоение (микрофазовая сегрегация)
Например: блок-сополимер полистирола с полибутадиеном
~
CH
CH2
~~
m
CH2
CH
CH
CH2
~
n
Микрофаза полибутадиена
Микрофаза
полистирола
87
88.
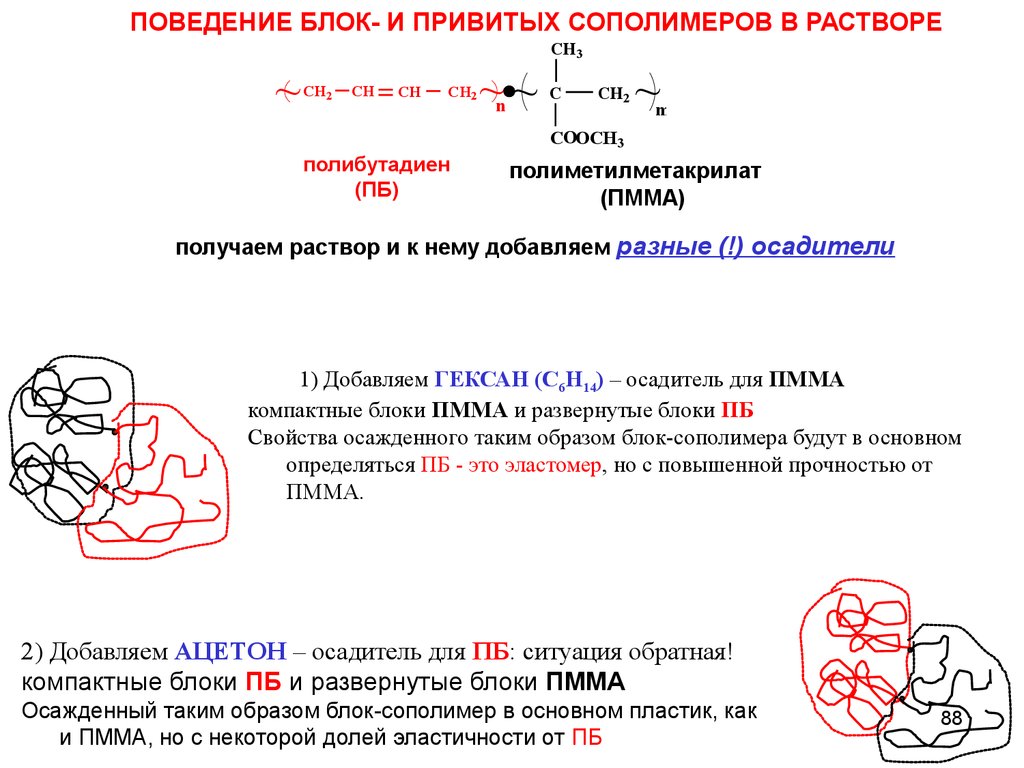
ПОВЕДЕНИЕ БЛОК- И ПРИВИТЫХ СОПОЛИМЕРОВ В РАСТВОРЕ~
CH2
CH
CH
CH2
~~
n
CH3
C
CH2
~
m
COOCH3
полибутадиен
(ПБ)
полиметилметакрилат
(ПММА)
получаем раствор и к нему добавляем разные (!) осадители
1) Добавляем ГЕКСАН (С6H14) – осадитель для ПММА
компактные блоки ПММА и развернутые блоки ПБ
Свойства осажденного таким образом блок-сополимера будут в основном
определяться ПБ - это эластомер, но с повышенной прочностью от
ПММА.
2) Добавляем АЦЕТОН – осадитель для ПБ: ситуация обратная!
компактные блоки ПБ и развернутые блоки ПММА
Осажденный таким образом блок-сополимер в основном пластик, как
и ПММА, но с некоторой долей эластичности от ПБ
88
89.
ДЕСТРУКЦИЯПоложительная роль
(целенаправленная Д.)
Отрицательная роль
(старение полимеров)
снижение молекулярной
массы для облегчения
переработки в расплавах и
растворах
потеря комплекса
полимерных физикомеханических свойств
(эластичночть, упругость,
прочность, ударостойкость)
получение
низкомолекулярных
(мономерных) продуктов
(аминокислоты, глюкоза)
выделение ядовитых или
вредных
низкомолекулярных
веществ (деструкция
поливинилхлорида)
утилизация и переработка
полимерных отходов
получение трековых
мембран (ускорительe
и затем вымывание
низкомолекулярных
продуктов
89
90.
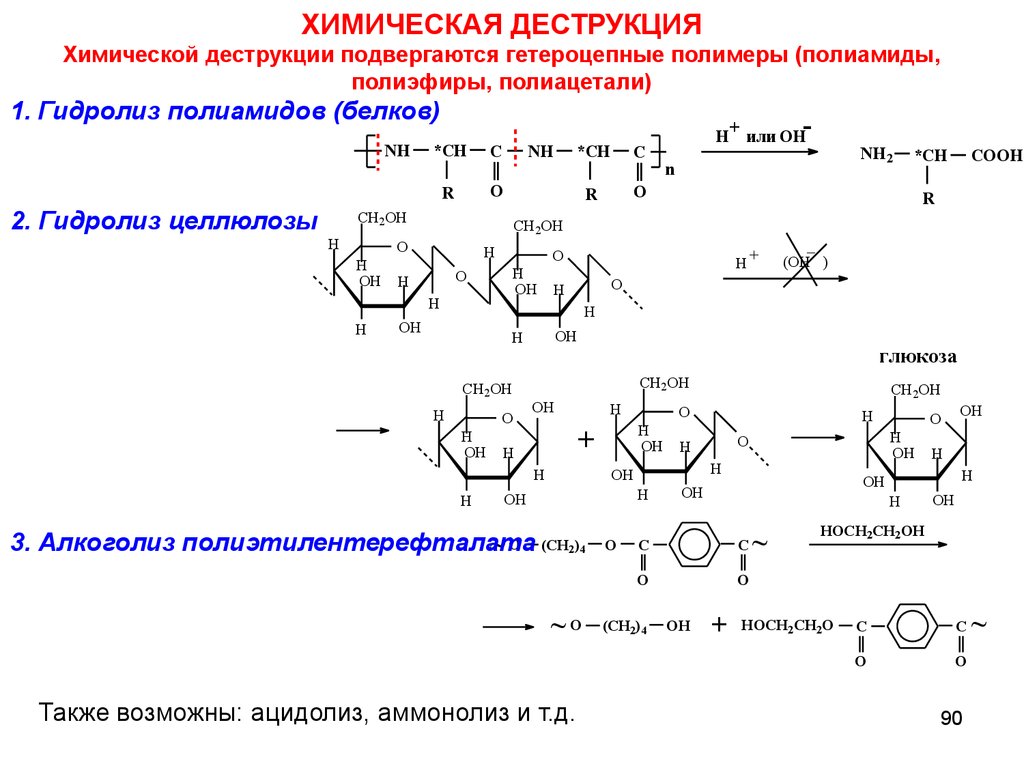
ХИМИЧЕСКАЯ ДЕСТРУКЦИЯХимической деструкции подвергаются гетероцепные полимеры (полиамиды,
полиэфиры, полиацетали)
1. Гидролиз полиамидов (белков)
NH
*CH
C
CH2OH
H
H
O
H
H
H
C
R
O
*CH
COOH
R
O
H
OH
NH2
n
CH2OH
O
H
OH
*CH
O
R
2. Гидролиз целлюлозы
NH
H+ или ОН-
H
+
_
(OH )
O
H
H
OH
OH
H
CH2OH
H
O
H
OH
CH2OH
OH
H
~O
Также возможны: ацидолиз, аммонолиз и т.д.
O
O
O
OH
H
H
C
+
~
OH
H
OH
OH
C
(CH2)4
O
H
OH
O
H
H
3. Алкоголиз полиэтилентерефталата
~ O (CH2)4
H
H
OH
OH
CH2OH
O
H
OH
+
H
H
H
глюкоза
OH
HOCH2CH2OH
HOCH2CH2O
C
C
O
O
90
~
91.
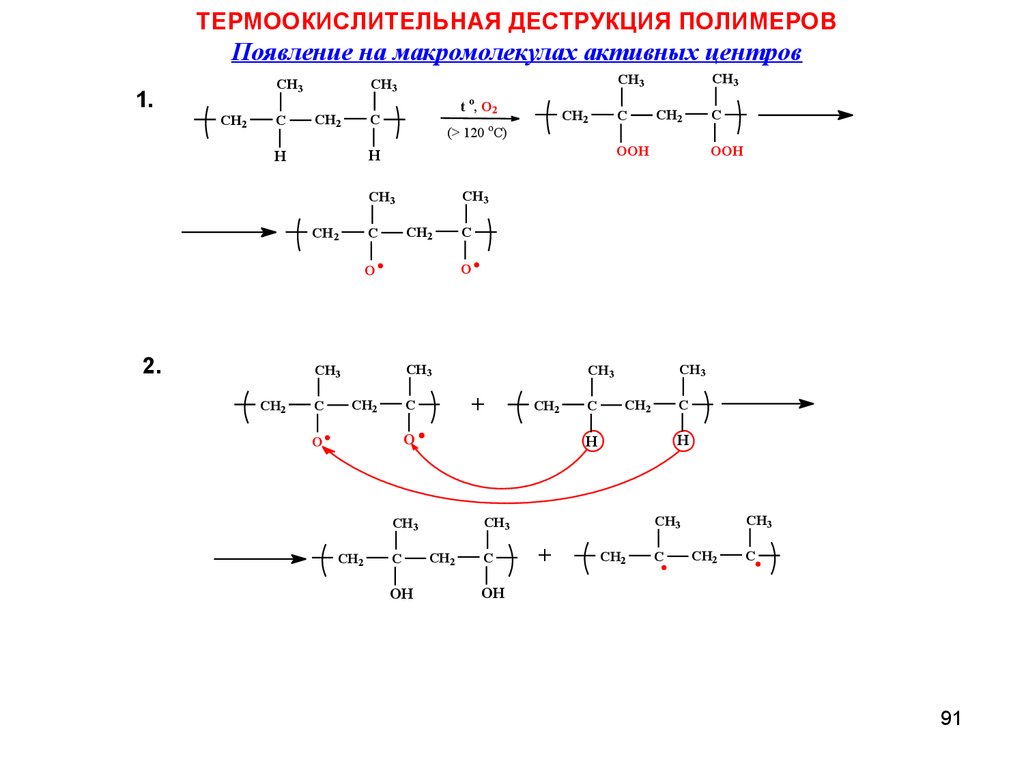
ТЕРМООКИСЛИТЕЛЬНАЯ ДЕСТРУКЦИЯ ПОЛИМЕРОВПоявление на макромолекулах активных центров
1.
CH2
C
CH2
t o, O2
C
CH2
CH2
C
OOH
C
CH3
CH2
CH2
O
OH
C
CH2
C
H
H
CH2
C
CH3
CH3
CH3
CH3
C
CH3
CH3
+
C
O
CH2
C
O
CH3
C
CH2
CH3
O
CH2
C
OOH
CH3
2.
CH2
(> 120 oC)
H
H
CH3
CH3
CH3
CH3
+
CH2
C
CH2
C
OH
91
92.
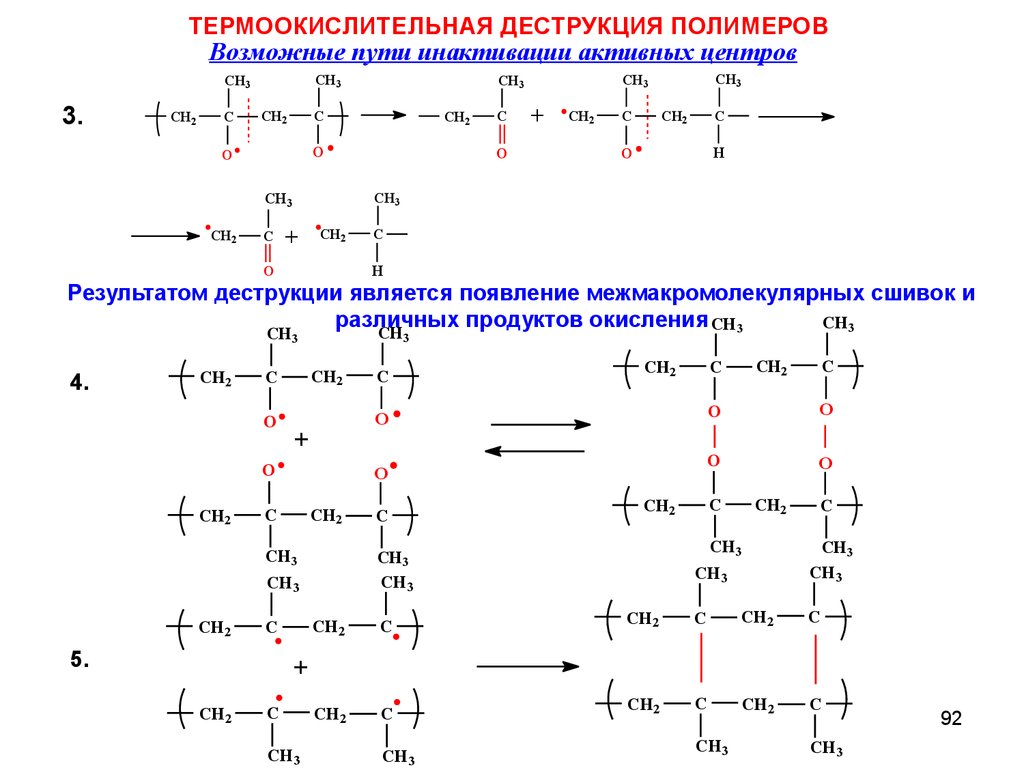
ТЕРМООКИСЛИТЕЛЬНАЯ ДЕСТРУКЦИЯ ПОЛИМЕРОВВозможные пути инактивации активных центров
CH3
CH3
3.
CH2
C
CH2
C
O
O
CH3
CH2
CH2
C
C
O
CH3
CH3
CH3
+
CH2
CH2
C
C
H
O
CH3
+
CH2
C
H
O
Результатом деструкции является появление межмакромолекулярных сшивок и
различных
продуктов окисления CH3
CH3
CH
CH3
4.
CH2
CH2
C
O
3
+
C
CH2
5.
C
O
O
O
O
C
CH2
CH2
CH3
CH3
CH3
CH3
C
C
CH2
C
O
CH3
CH2
CH2
O
O
CH2
C
C
CH3
CH3
CH3
CH2
C
CH2
C
CH2
C
CH2
C
CH2
C
CH2
C
+
CH2
C
CH3
CH3
CH3
CH3
92
93.
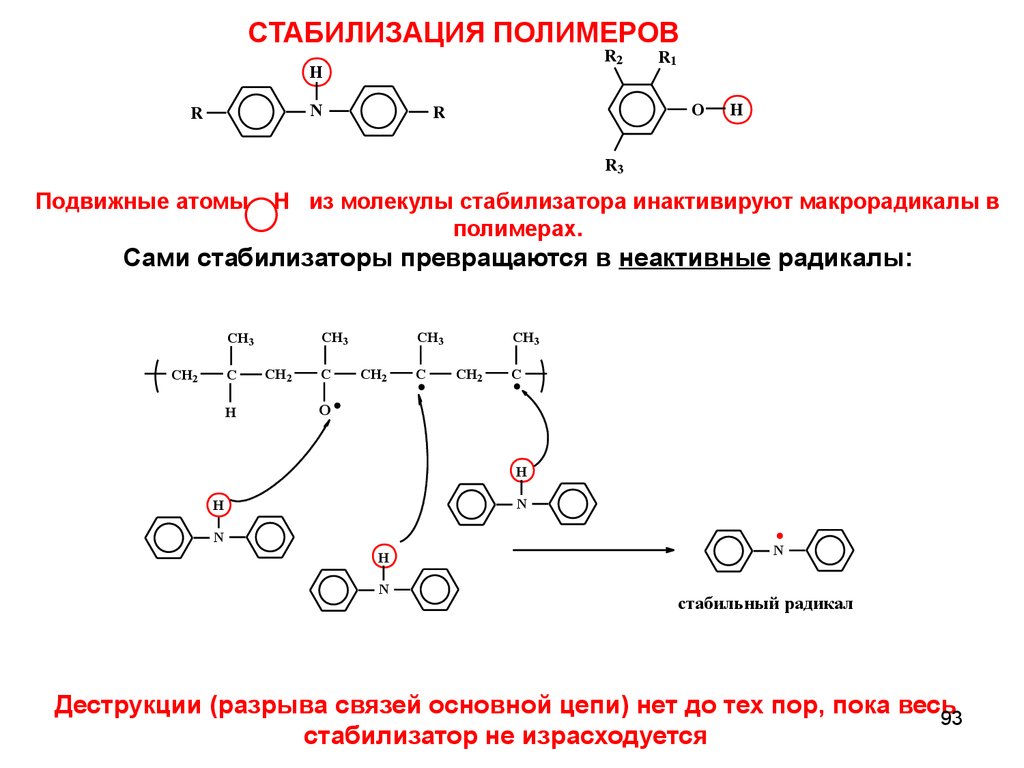
СТАБИЛИЗАЦИЯ ПОЛИМЕРОВR2
H
N
R
R1
O
R
H
R3
Подвижные атомы
H из молекулы стабилизатора инактивируют макрорадикалы в
полимерах.
Сами стабилизаторы превращаются в неактивные радикалы:
CH3
CH3
CH2
C
H
CH2
C
CH3
CH2
C
CH3
CH2
C
O
H
N
H
N
H
N
N
стабильный радикал
Деструкции (разрыва связей основной цепи) нет до тех пор, пока весь
93
стабилизатор не израсходуется
94.
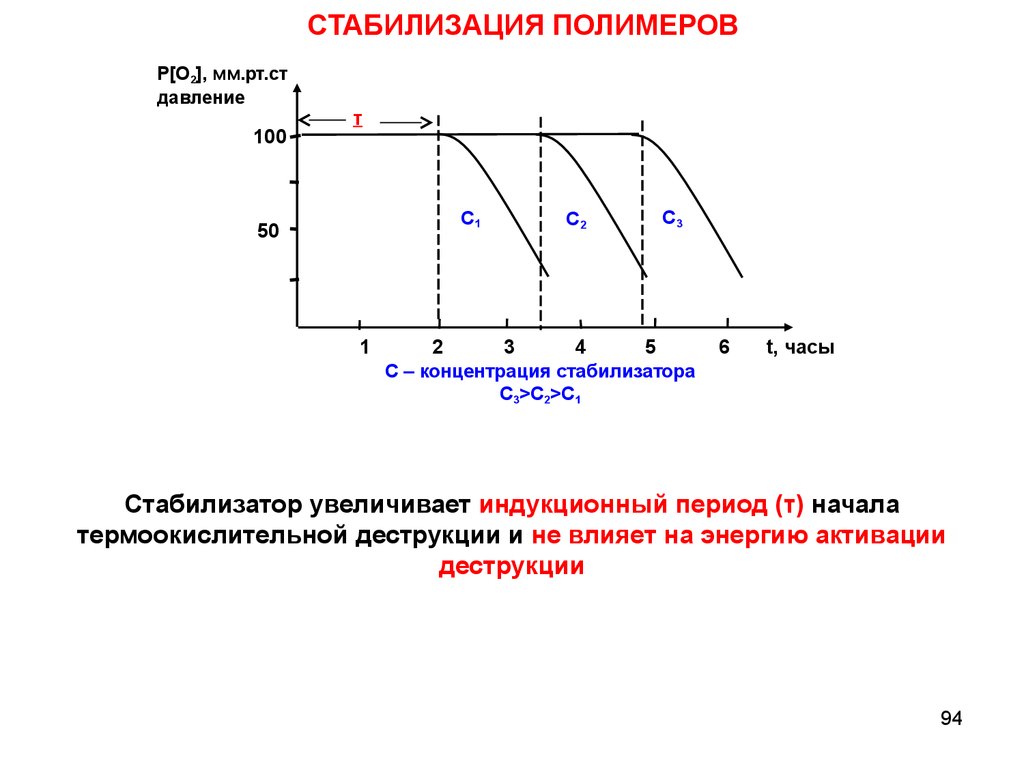
СТАБИЛИЗАЦИЯ ПОЛИМЕРОВP[O2], мм.рт.ст
давление
100
τ
C1
50
1
C2
C3
2
3
4
5
C – концентрация стабилизатора
C3>C2>C1
6
t, часы
Стабилизатор увеличивает индукционный период (τ) начала
термоокислительной деструкции и не влияет на энергию активации
деструкции
94
95.
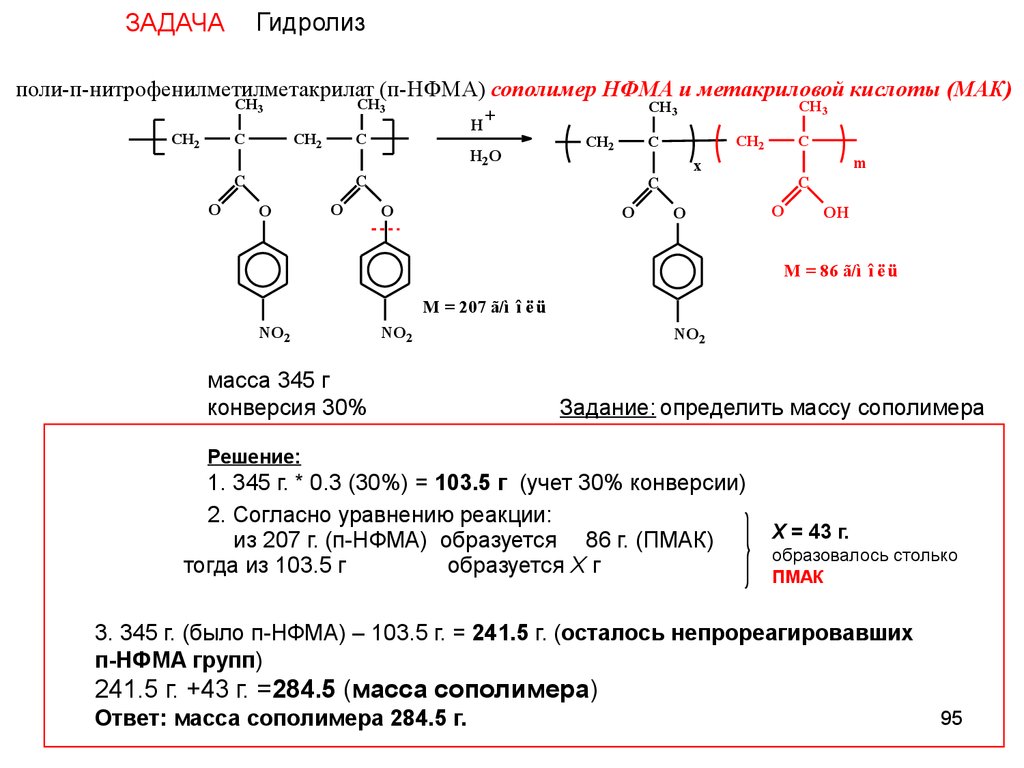
ГидролизЗАДАЧА
поли-п-нитрофенилметилметакрилат (п-НФМА) сополимер НФМА и метакриловой кислоты (МАК)
CH3
CH2
C
CH3
CH2
C
C
O
H
H2O
CH2
O
CH2
C
C
O
CH3
CH3
+
O
m
x
C
O
C
O
C
O
OH
M = 86 ã/ì î ë ü
M = 207 ã/ì î ë ü
NO2
NO2
масса 345 г
конверсия 30%
NO2
Задание: определить массу сополимера
Решение:
1. 345 г. * 0.3 (30%) = 103.5 г (учет 30% конверсии)
2. Согласно уравнению реакции:
из 207 г. (п-НФМА) образуется 86 г. (ПМАК)
тогда из 103.5 г
образуется X г
X = 43 г.
образовалось столько
ПМАК
3. 345 г. (было п-НФМА) – 103.5 г. = 241.5 г. (осталось непрореагировавших
п-НФМА групп)
241.5 г. +43 г. =284.5 (масса сополимера)
Ответ: масса сополимера 284.5 г.
95
96.
ЗАДАЧА80%
20%
CH2
CH
CH2
CH
CH
CH2
+
Cl2
CN
M = 54 ã/ì î ë ü
CH2
CH
CN
CH2
CH
CH
Cl
Cl
CH2
Масса исходно






























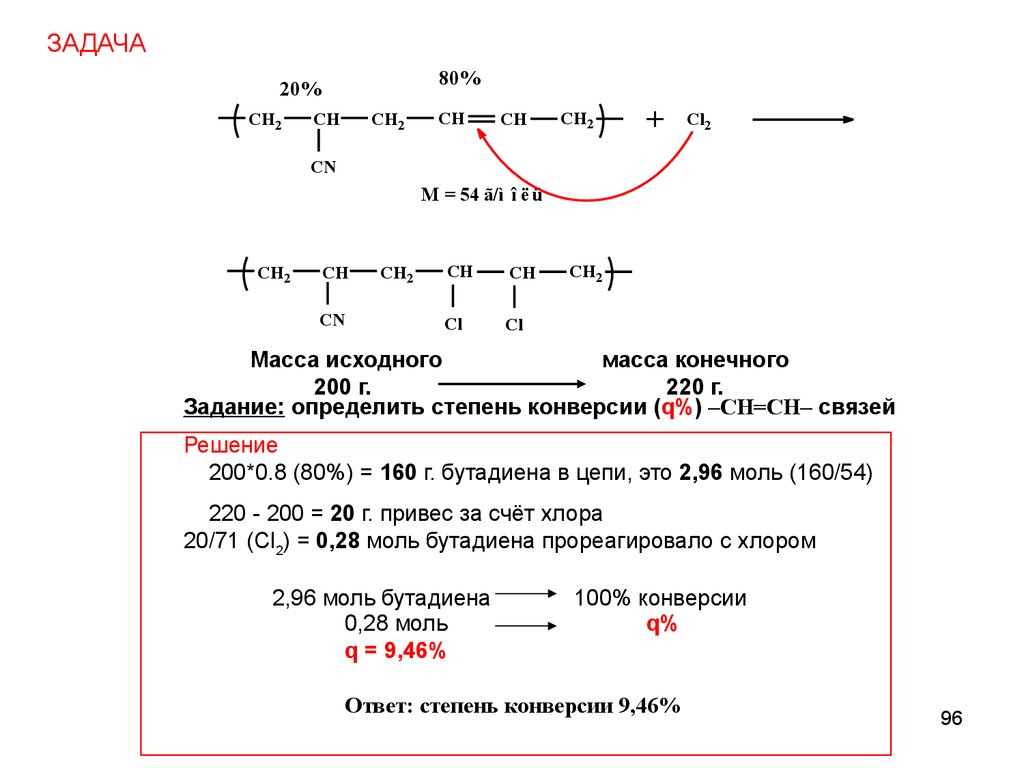



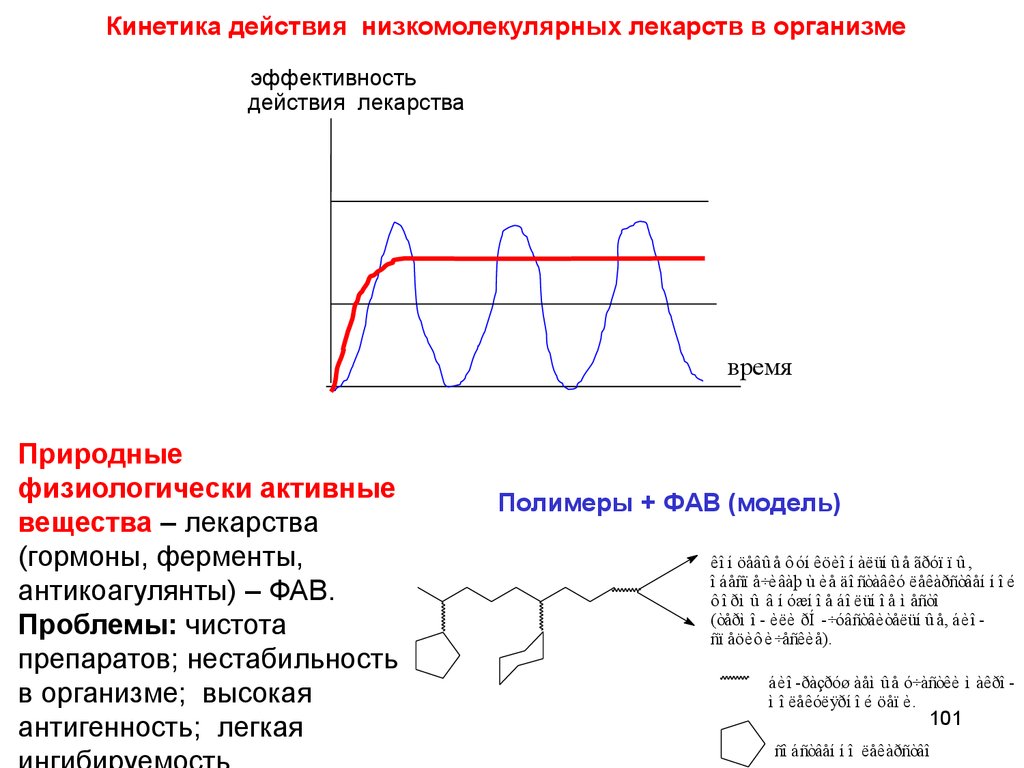
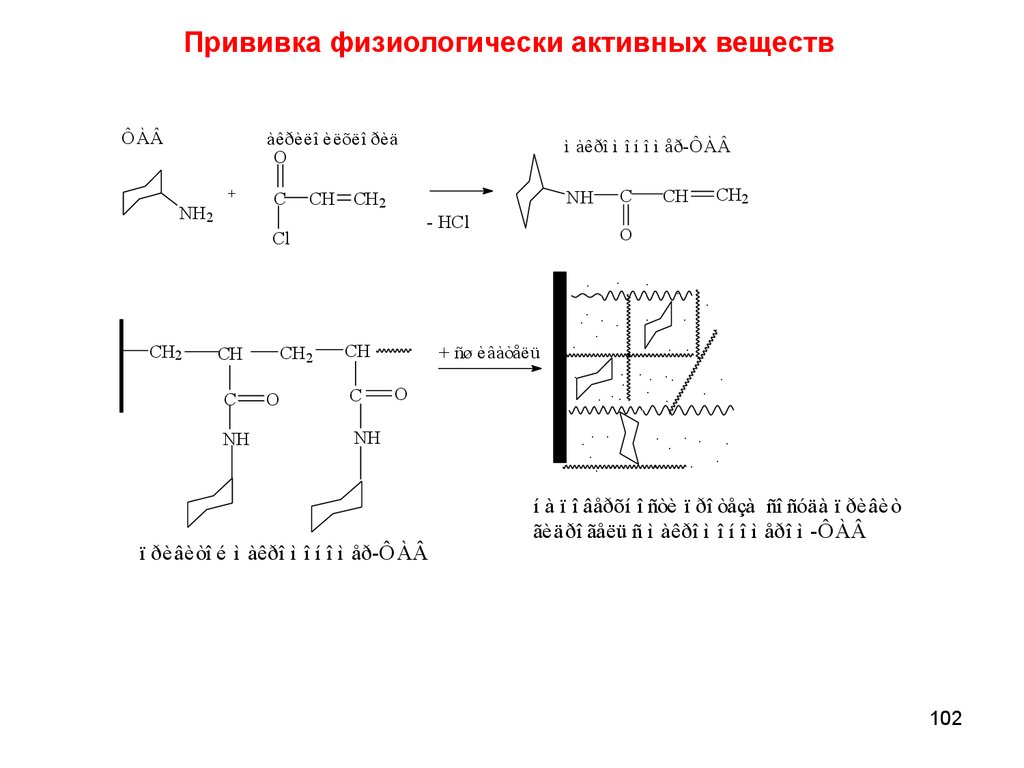
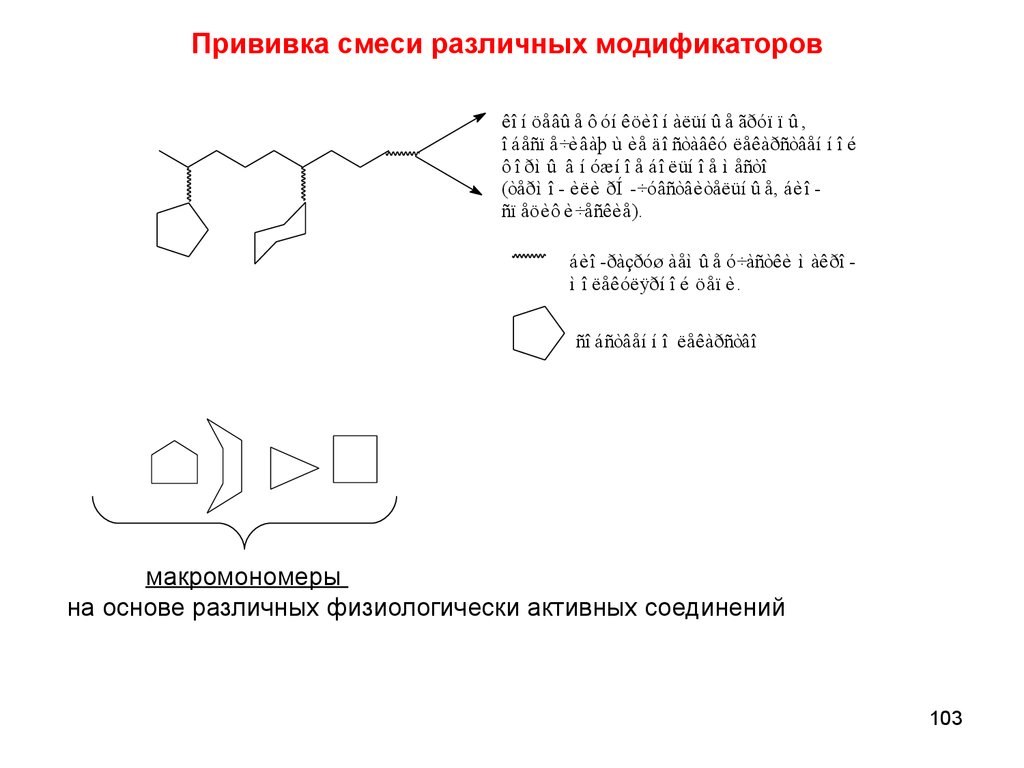

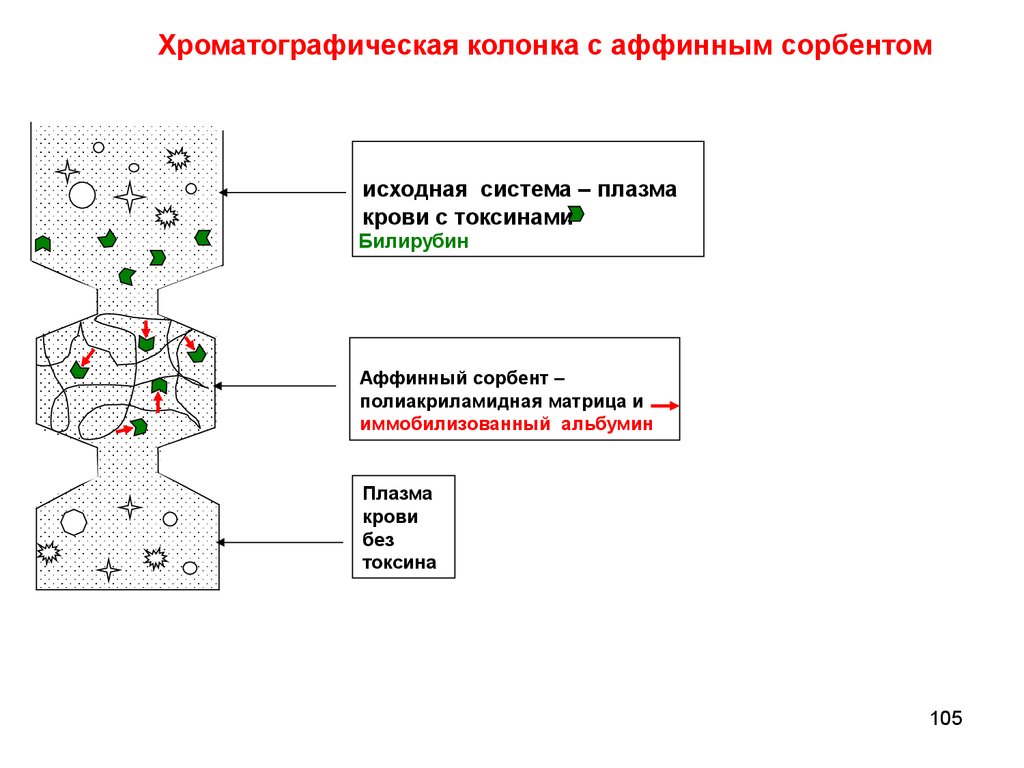







 chemistry
chemistry