Similar presentations:
Химические свойства алкенов
1. Химические свойства Алкенов
ХИМИЧЕСКИЕ СВОЙСТВААЛКЕНОВ
2.
Химические свойства алкеновПрисоединение Полимеризация
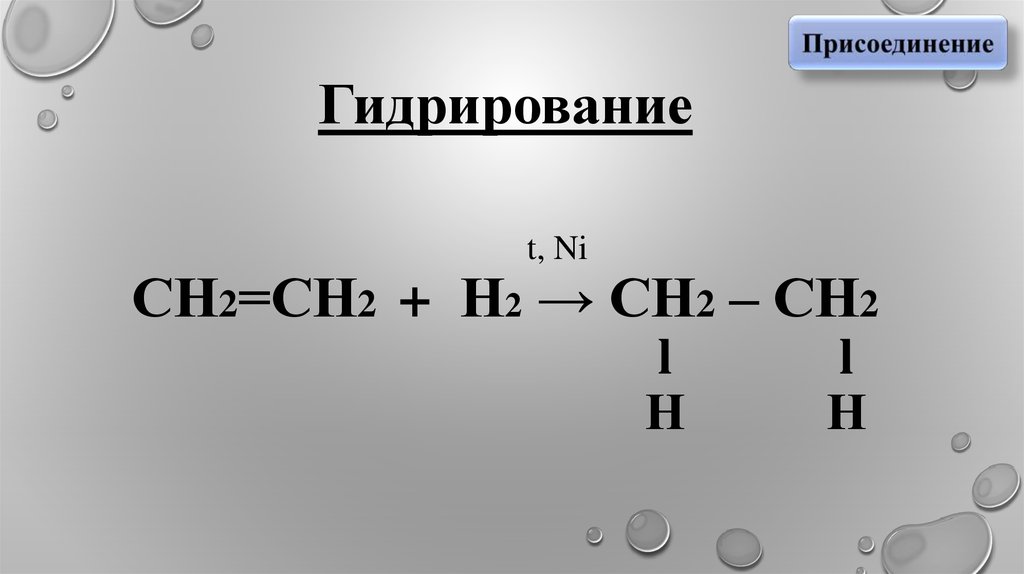
Гидрирование
Окисление
Каталитическое
окисление
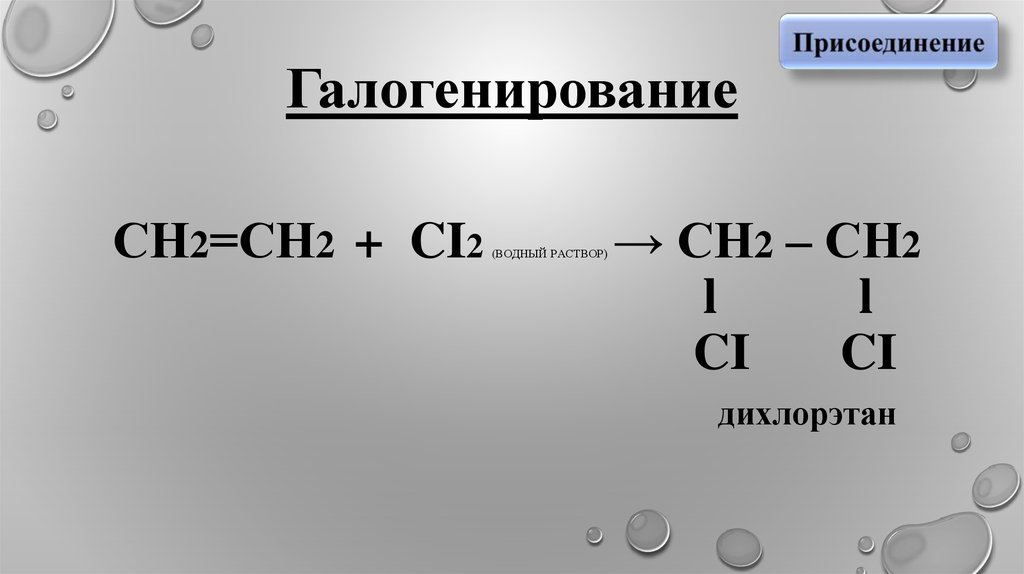
Галогенирование
Горение
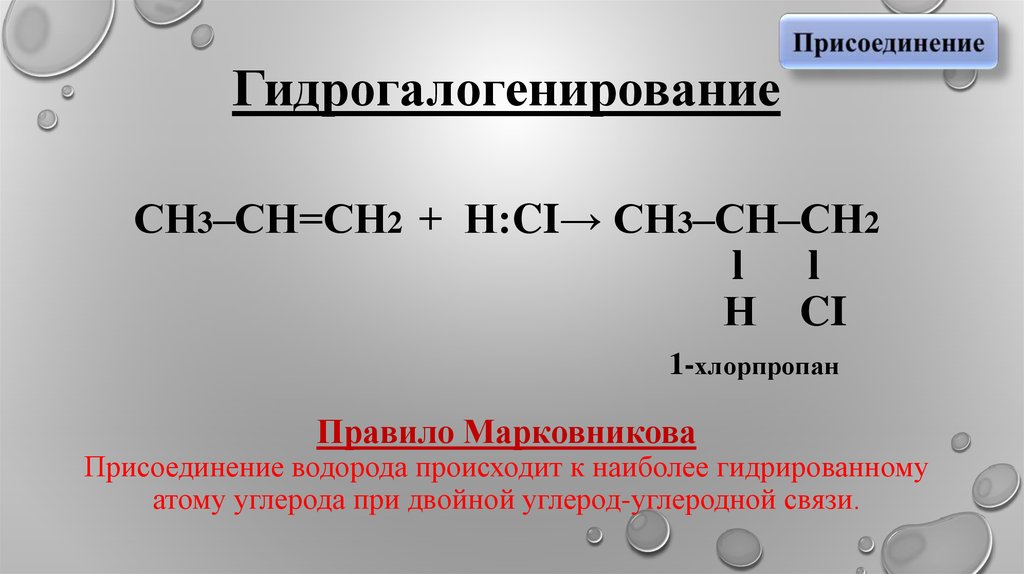
Гидрогалогенирование
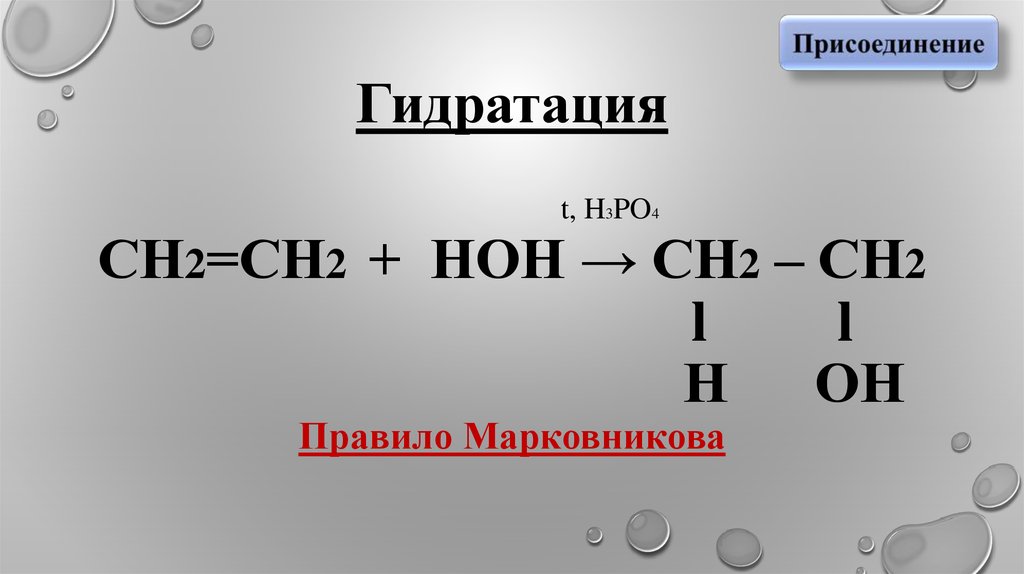
Гидратация
Качественные реакции
3. Гидрирование t, Ni СН2=СН2 + Н2 → СН2 – СН2 l l Н Н
Гидрированиеt, Ni
СН2=СН2 + Н2 → СН2 – СН2
l
Н
l
Н
4. Галогенирование СН2=СН2 + CI2 (водный раствор) → СН2 – СН2 l l CI CI дихлорэтан
ГалогенированиеСН2=СН2 + CI2
(ВОДНЫЙ РАСТВОР)
→ СН2 – СН2
l
l
CI
CI
дихлорэтан
5. Гидрогалогенирование СН3–СН=СН2 + Н:CI→ СН3–СН–СН2 l l Н CI 1-хлорпропан Правило Марковникова Присоединение водорода происходит
к наиболее гидрированномуатому углерода при двойной углерод-углеродной связи.
6. Гидратация t, H3PO4 СН2=СН2 + НОН → СН2 – СН2 l l Н ОН Правило Марковникова
7.
Реакция полимеризациикat,t,p
n(СН2 = СН2) → (- СН2 – СН2 -)n
этилен
полиэтилен
мономер
структурное звено полимера
8. Каталитическое окисление 1. В присутствии хлоридов меди и палладия: Кат. 2 СН2=СН2 + О2 → 2 СН3–СОН 2.В присутствии серебра,
при t 150-350 СКат.
2 СН2=СН2 + О2 → 2 СН2–СН2
О
9. Реакция Вагнера 3СН2=СН2 + 4Н2О + 2KMnO4 3СН2OH-СН2OH +2MnO2 + 2KOH Этиленгликоль Качественная реакция на кратную связь –
обесцвечивание водного раствораперманганата калия
(открыта Е.Е.Вагнером в 1888 г)
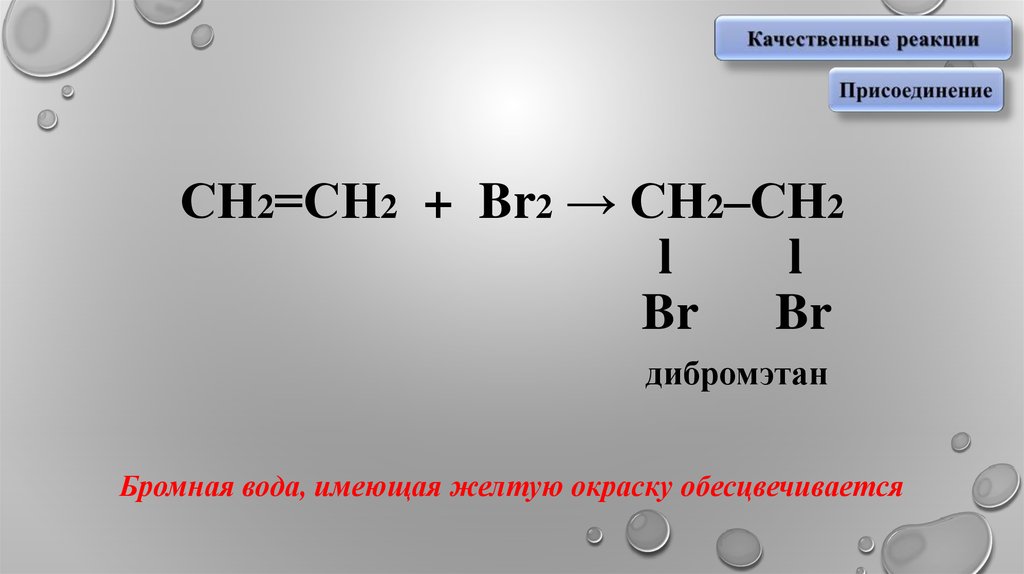
10. СН2=СН2 + Br2 → СН2–СН2 l l Br Br дибромэтан Бромная вода, имеющая желтую окраску обесцвечивается
11.
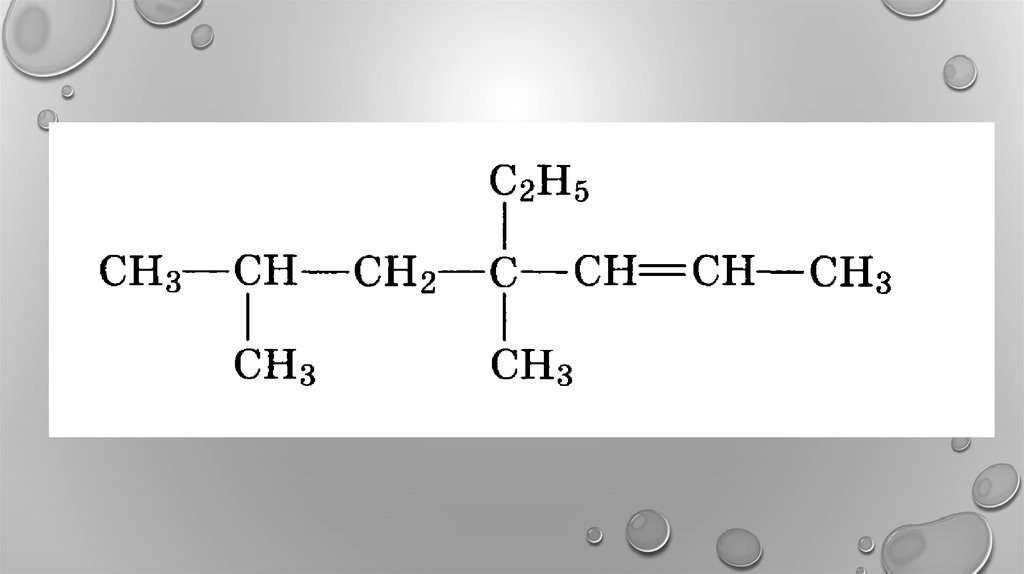
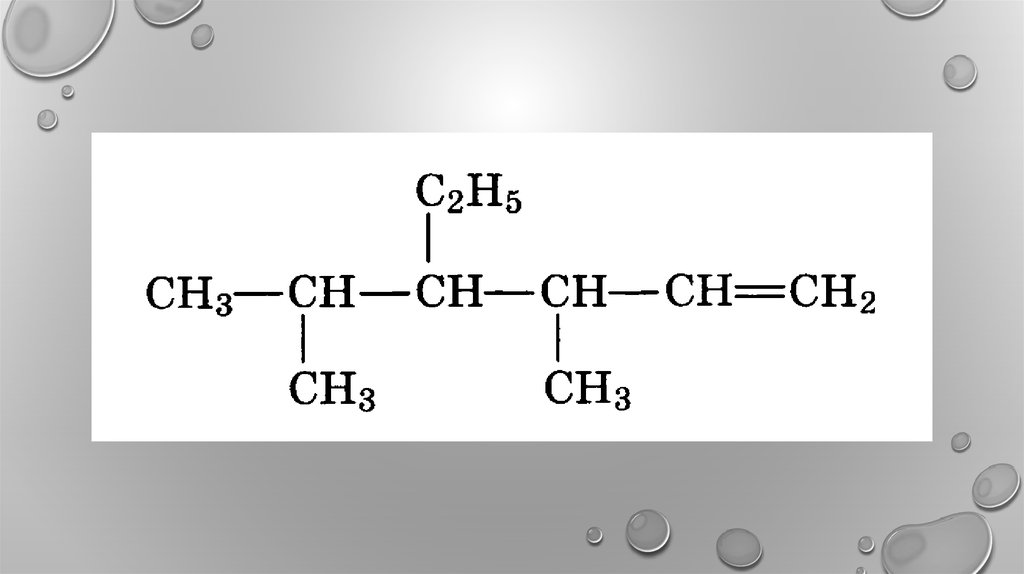
12. 3,3- диметилпентен-1 2,4-диметилгексен-2 2,4,4-триметилпентен-2
13.
14.
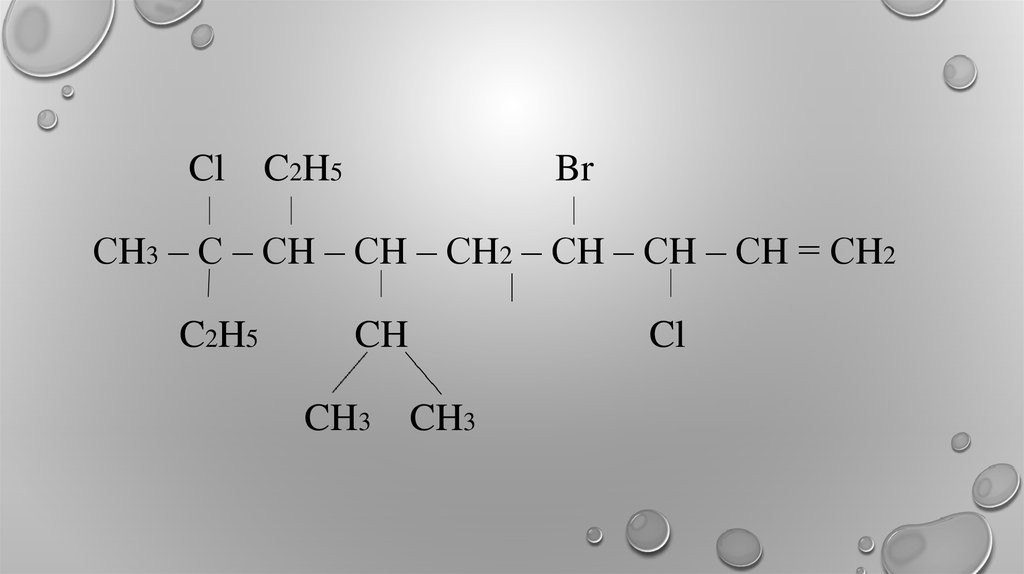
15. 2,3,4,6-тетраметил-2,7-дихлор-5,6-диэтилоктен-4 2,8,8-трибром-3,9,9-триметил-5-изопропил-6-хлордецен-1
2,3,4,6-тетраметил-2,7-дихлор-5,6диэтилоктен-42,8,8-трибром-3,9,9-триметил-5изопропил-6-хлордецен-1
16. Cl C2H5 Br СH3 – с – сH – сH – сH2 – сH – сH – сH = Сh2 C2H5 CH Cl CH3 CH3
ClC2H5
Br
СH3 – С – СH – СH – СH2 – СH – СH – СH = СH2
C2H5
CH
CH3
Cl
CH3









 chemistry
chemistry








