Similar presentations:
Обмен аминокислот. Синтез и распад нуклеиновых кислот
1.
Трансаминированиеаминокислот
2.
Биологическая ценность аминокислотзаменимые
незаменимые
пируват ----------------------→ аланин
треонин
глицерин- ---------------------→ серин
метионин
серин -------------------------→ глицин
валин
аланин-----------------------→ цистеин
лейцин
щук ---------------→ аспарагиновая к-та
изолейцин
оксоглутаровая → глутаминовая к-та
лизин
глутаминовая к-та -----→ пролин
фенилаланин
глутаминовая к-та ----→ гистидин
триптофан
фенилаланин --------------→ тирозин
аргинин
3.
Участие фосфопиридоксаля вреакции трансаминирования
СН3
СООН
СН3
СООН
СНNH2 + C=О ФП-аль С=О +
СНNH2
СООН
СН2
СООН
СН2
СН2
СН2
СООН
СООН
аланин оксоглутарат
пируват
глутамат
4.
1. перенос аминогруппы на коферментСН3
Н
СН-NH2
С
О
НО
+
COOH
Н 3С
СН2О-РО3Н2
N
пиридоксаль-фосфат
СН2-NH2
НО
Н3С
СН2О-РО3Н2
N
пиридоксамин-фосфат
СН3
+
С= O
COOH
5.
2. перенос аминогруппы на кетокислотуСООН
СН2-NH2
С=О
НО
СН2О-РО3Н2
+
СН2
Н3С
СН2
N
пиридоксамин-фосфат
COOH
оксоглутаровая
к-та
Н
С
НО
Н3С
СООН
О
СН2О-РО3Н2
N
пиридоксаль-фосфат
+
СН-NH2
СН2
СН2
COOH
ГЛУ
6.
Динамика повышения активности АсАТ иАлАТ крови при гепатите
Активность
ферментов
АлАТ
АсАТ
1 2
3 4 5
6 7 8 9 10 11 12 13 14 15 16 17 18
Дни болезни
7.
Декарбоксилированиеаминокислот
(образование
биологическиактивных аминов)
8.
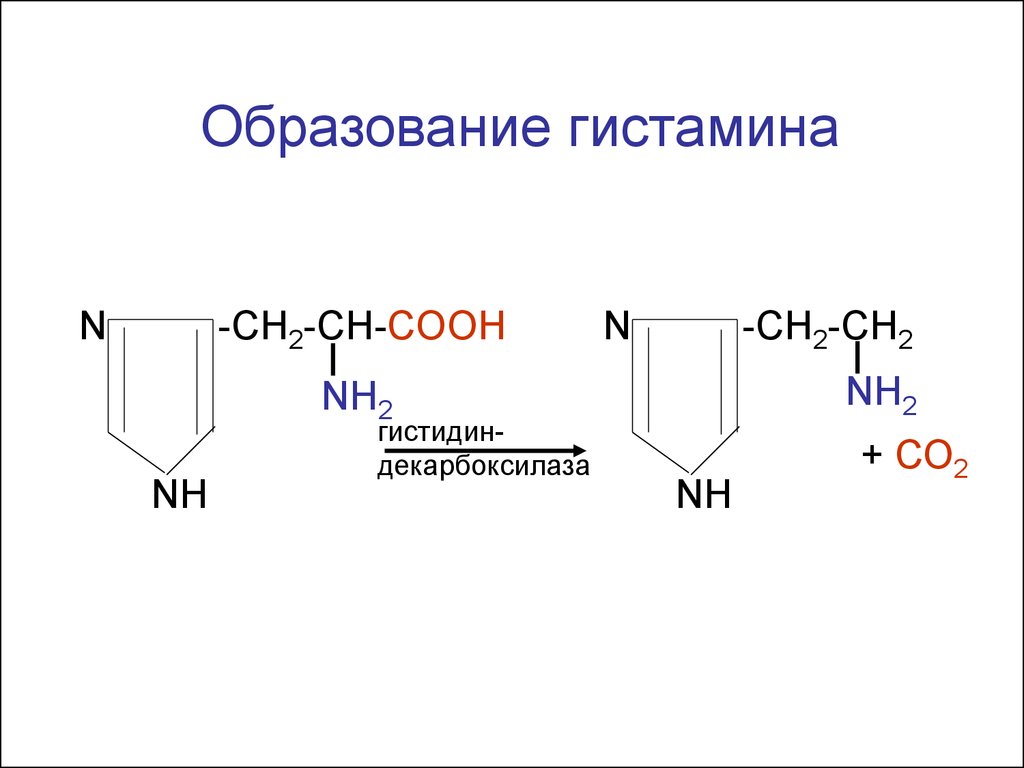
Образование гистаминаN
-CH2-CH-COOH
N
-CH2-CH2
NH2
NH2
NH
гистидиндекарбоксилаза
NH
+ СО2
9.
Окисление гистаминаN
-CH2-CH2
NH2
NH
гистамин
N
-CH2-C=О
Н
O2
моноаминооксидаза
NH3
NH
имидазолацетальдегид
10.
декарбоксилирование триптофана-CH2-CH-COOH
-CH2-CH2
NH2
NH2
+ СО2
NH
триптамин
NH
декарбоксилаза
11.
гидроксилирование триптофана-CH2-CH-COOH
НО
-CH2-CH-COOH
NH2 гидроксилаза
NH
NH2
NH
5-гидрокситриптофан
12.
синтез серотонинаНО
-CH2-CH-COOH
НО
декарбоксилаза
NH2
NH
СО2
-CH2-CH2
NH2
NH
5-гидрокситриптамин
(серотонин)
13.
Декарбоксилирование глутаминовойкислоты
СOOH
CH-NH2
CH2
CH2-NH2
декарбоксилаза
CH2
COOH
глутаминовая
кислота
CH2
CH2
+ CO2
COOH
гамма-аминомасляная
кислота (ГАМК)
14.
Синтез норадреналина и адреналина1 этап: гидроксилирование тирозина
ОН
ОН
гидроксилаза
НАДФН2; О2;
ОН
р450
CH2-CH-COOH
CH2-CH-COOH
NH2
NH2
тирозин
диоксифенилаланин
(ДОФА)
15.
Синтез норадреналина и адреналина2 этап: декарбоксилирование диоксифенилаланина
ОН
ОН
ОН
декарбоксилаза
ОН
+ СО2
CH2-CH-COOH
NH2
CH2-CH2
NH2
диоксифенилэтиламин
(дофамин)
16.
Синтез норадреналина и адреналина3 этап: образование норадреналина
ОН
ОН
ОН
гидроксилаза
НАДФН2; О2;
ОН
р450
CH2-CH2
NH2
CH-CH2
ОН NH2
норадреналин
17.
Синтез адреналинаОН
ОН
ОН
ОН
метил-фолиевая
кислота; вит. В12
метионин
CH-CH2
CH-CH2
ОН NH2
ОН NH – СН3
норадреналин
адреналин
18. Активация адреналином сокращений сердца и обмена веществ
19.
рецепторСа2+
мембрана
клетки
неактивная
протеинкиназа
20.
Адреналинрецептор
Са2+
мембрана
клетки
неактивная
протеинкиназа
21.
Адреналинрецептор
Са2+
мембрана
клетки
неактивная
протеинкиназа
22.
Адреналинрецептор
Са2+
мембрана
клетки
неактивная
протеинкиназа
23.
Адреналинрецептор
Са2+
мембрана
клетки
неактивная
протеинкиназа
24.
Адреналинрецептор
Са2+
мембрана
клетки
неактивная
протеинкиназа
25.
Адреналинрецептор
Са2+
мембрана
клетки
неактивная
протеинкиназа
26.
Адреналинрецептор
Са2+
мембрана
клетки
неактивная
протеинкиназа
27.
Адреналинрецептор
Са2+
мембрана
клетки
неактивная
протеинкиназа
28.
Адреналинрецептор
Са2+
мембрана
клетки
неактивная
протеинкиназа
29.
Адреналинрецептор
Са2+
мембрана
клетки
неактивная
протеинкиназа
30.
Адреналинрецептор
Са2+
мембрана
клетки
неактивная
протеинкиназа
31.
Адреналинрецептор
Са2+
мембрана
клетки
неактивная
протеинкиназа
32.
Са2+АТФ
мембрана
клетки
неактивная
протеинкиназа
33.
Са2+АТФ
мембрана
клетки
неактивная
протеинкиназа
34.
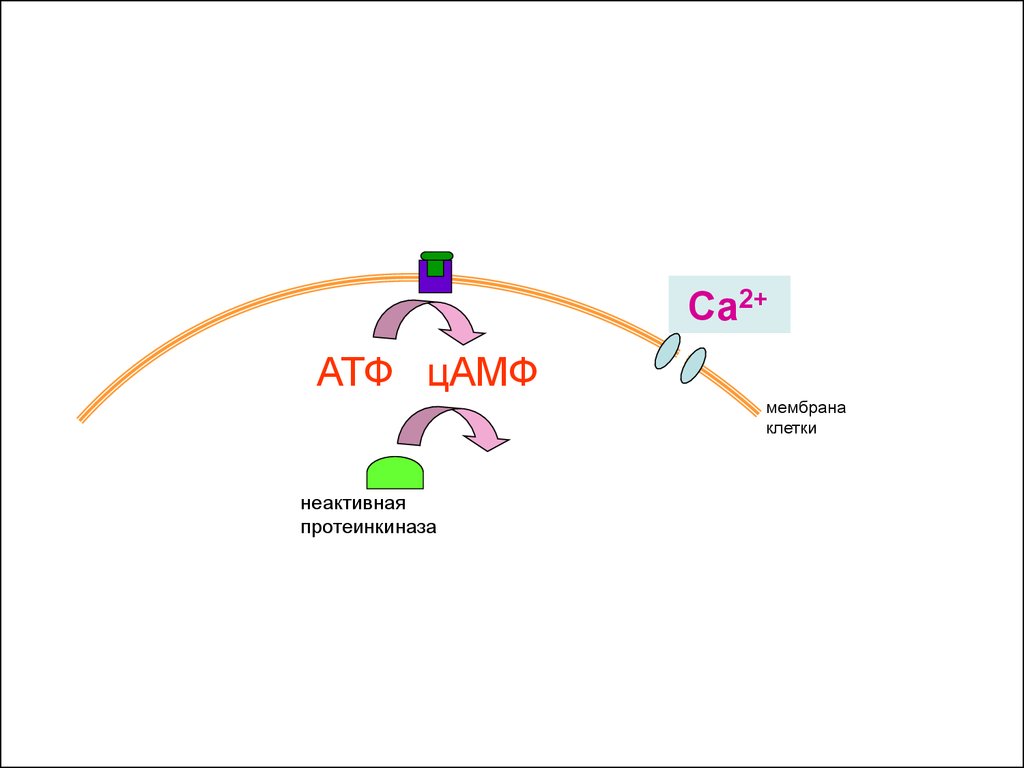
Са2+АТФ цАМФ
мембрана
клетки
неактивная
протеинкиназа
35.
Са2+АТФ цАМФ
мембрана
клетки
неактивная
протеинкиназа
36.
Са2+АТФ цАМФ
мембрана
клетки
неактивная
протеинкиназа
37.
Са2+АТФ цАМФ
мембрана
клетки
неактивная
протеинкиназа
активная
протеинкиназа
38.
Са2+АТФ цАМФ
мембрана
клетки
неактивная
протеинкиназа
активная
протеинкиназа
39.
Са2+АТФ цАМФ
Са2+
неактивная
протеинкиназа
активная
протеинкиназа
мембрана
клетки
40.
Са2+АТФ цАМФ
Са2+
неактивная
протеинкиназа
активная
протеинкиназа
неактивные
ферменты
мембрана
клетки
41.
Са2+АТФ цАМФ
Са2+
неактивная
протеинкиназа
активная
протеинкиназа
неактивные
ферменты
мембрана
клетки
активация
сокращений сердца,
42.
Са2+АТФ цАМФ
Са2+
неактивная
протеинкиназа
активная
протеинкиназа
неактивные
ферменты
мембрана
клетки
активация
сокращений сердца,
активация
ферментов
43.
Окислительноедезаминирование
аминокислот
44.
Реакция окислительногодезаминирования глутаминовой
кислоты
СООН
СООН
СН2
HАД
СН2
СООН
+Н2О
СН2
СН2
СН2
CH-NH2
C = NH
C=О
COOH
COOH
COOH
СН2
HАДН2
+ NH3
45.
Реакция окислительногодезаминирования
аспарагиновой кислоты
СООН
СООН
СН2
HАД
CH-NH2 HАДН
2
COOH
СН2
СООН
+Н2О
СН2
C = NH
C=О
COOH
COOH
+ NH3
46.
Связь трансаминирования с окислительным дезаминированиемаланин
серин
цистеин
метионин
валин
лейцин
изолейцин
фенилаланин
тирозин
триптофан
гистидин
пролин
аргинин
лизин
глицин
трансаминирование
СООН
СН2
СН2
+
оксоглутаровая
кислота
+
CH-NH2
COOH
глу
кетокислота
47.
Связь трансаминирования сокислительным дезаминированием
трансаминирование
окислительное
дезаминирование
СН3
СООН
СНNH2 + C=О
СООН
СН2
СН2
СН3
СООН
С=О + СНNH2
СООН
СН2
СН2
СООН
СООН
аланин
оксоглутарат
пируват
глутамат
+ НАД
НАДН2
48.
окислительное дезаминированиеглутаминовой кислоты
СООН
СООН
С =NH
С =O
СН2
+ Н2О
СН2
CH2
CH2
COOH
COOH
+
NH3
49.
метаболические источники аммиака в организмеокислительное
дезаминирование аминокислот
окисление
биологически
активных аминов
NH3
дезаминирование азотистых
оснований
дезаминирование
аминосахаров
50.
главныймеханизм
обезвреживания
аммиака в
организме
51.
Местом обезвреживания аммиака в организме( 20 г в сутки) является печень
52.
структурные формулы угольной кислоты имочевины
НО – С – ОН
О
NH2 – C – NH2
O
53.
синтезмочевины
54.
Орнитиновый циклO
NH3 + CO2 + 2 АТФ
OH
NH2-C-O~P=O
OH
карбамоил
фосфат
орнитин
фумаровая к-та
мочевина
аргинин
цитруллин
аспарагиновая кислота
55.
образование карбамоилфосфатакарбамоил
-фосфат
синтетаза
ГЛУ
NH3 + CO2 + 2 АТФ
α-кетоглутаровая к-та
O
OH
NH2-C-O~P=O
OH
2АДФ H3PO4
карбамоилфосфат
56.
синтез цитруллинаNH2
NH2
CH2
C=O
+
O
OH
P=O
OH
C=O
NH2
CH2
орнитинкарбамоил
трансфераза
CH2
CH2
CH2
CHNH2
NH
H3PO4
CH2
COOH
CHNH2
орнитин
COOH
цитруллин
COOH
CHNH2
+ CH
2
COOH
57.
синтез аргининаNH2
аргининсукцинат
синтетаза
+ АТФ
АМФ H4P2O7
C=NH
NH
CH2
CH2
COOH
CH2
CH
CHNH2
CH
COOH
COOH
аргинин
фумаровая к-та
58.
образование мочевиныNH2
C=NH
NH2
NH
CH2
Н2О
аргиназа
CH2
CH2
CH2
CH2
CH2
CHNH2
CHNH2
COOH
COOH
аргинин
орнитин
+
NH2
C=O
NH2
мочевина
59.
Вспомогательный, быстрый механизмсвязывания аммиака внутри клеток
NH3 +
АТФ
+
СООН
СОNH2
СН2
СН2
СН2
СН2
CH-NH2
АДФ
Н3РО4
+ H2 O
CH-NH2
COOH
COOH
глутаминовая
кислота
глутамин
60.
Ресинтез глутаминовой кислотыв почках
возвращение в кровь
СОNH2
в почки
СООН
СН2
глутаминаза СН
2
СН2
СН2
CH-NH2
COOH
глутамин
+ H2 O
CH-NH2
COOH
глутаминовая кислота
NH3
моча
61.
органыглу
NH3
глутамин
кровь
NH2
моча NH4CI
глутаминовая
кислота
62.
Содержаниемочевины в крови
2,5 – 8,3 ммоль/л
сыворотки
(За сутки с мочой выделяется 20-35 г)
63.
Регуляцияобмена
белков
64.
Факторы, влияющие на скорость синтеза белкаскорость
синтеза
концентрация
и состав
аминокислот
и-РНК,т-РНК
синтез белка
активность
АРС-аз
регуляция
гормонами
65.
Влияние некоторых факторов наконцентрацию и состав аминокислот
1. Доступность в белковой диете;
2. Наличие полноценных белков в продуктах;
2. Содержание альбумина в крови;
3. Заболевания органов пищеварения;
4. Нарушения всасывания аминокислот;
5. Заболевания почек, печени, поджелудочной
железы;
6. Гиповитаминоз (В6; фолиевой кислоты, В12)
66.
Влияние некоторых факторов наактивность АРС-аз
1.Активность белково-синтезирующей
системы;
2. Кислотно-основное состояние в
организме;
3. Состояние биоэнергетических
процессов.
67.
Факторы, влияющие наскорость синтеза и-РНК и т-РНК
1. Наличие нуклеотидного фонда;
2. Состояние биоэнергетических
процессов;
3. Влияние факторов роста на процесс
транскрипции (индукция и репрессия
генов).
68.
Гормональная регуляция скоростисинтеза белка
1. Соматотропин, половые гормоны (индукторы
транскрипции и биосинтеза белка);
2. Тироксин (активатор транскрипции ферментов,
осуществляющих липолиз и протеолиз);
3. Инсулин (активатор транскрипции ферментов,
участвующих в углеводном обмене);
4. Глюкокортикоиды (репрессоры транскрипции
генов, контролирующие синтез белков и липидов.
Индукторы транскрипции и биосинтеза ферментов
глюконеогенеза).
69.
На скорость дезаминированияаминокислот влияют:
1. Соотношение НАДН2 /НАД. При гипоксии
увеличивается концентрация НАДН2.
Недостаток НАД служит причиной замедления
скорости дезаминирования аминокислот.
2. Концентрация NH3. Увеличение концентрации
аммиака замедляет процесс дезаминирования.
3. Снижение концентрации глутаминовой кислоты
или аспарагиновой кислоты понижает скорость
окислительного дезаминирования.
70.
Взаимосвязьмежду обменом
белков,
углеводов и
липидов.
71.
Взаимосвязь между обменом липидов и углеводовтриглицериды
жирные
кислоты
глюкоза
глицерин
фосфоглицери
новая кислота
фосфоенолпируват
холестерин
пируват
ацетил-КоА
Цикл Кребса
ЩУК
72.
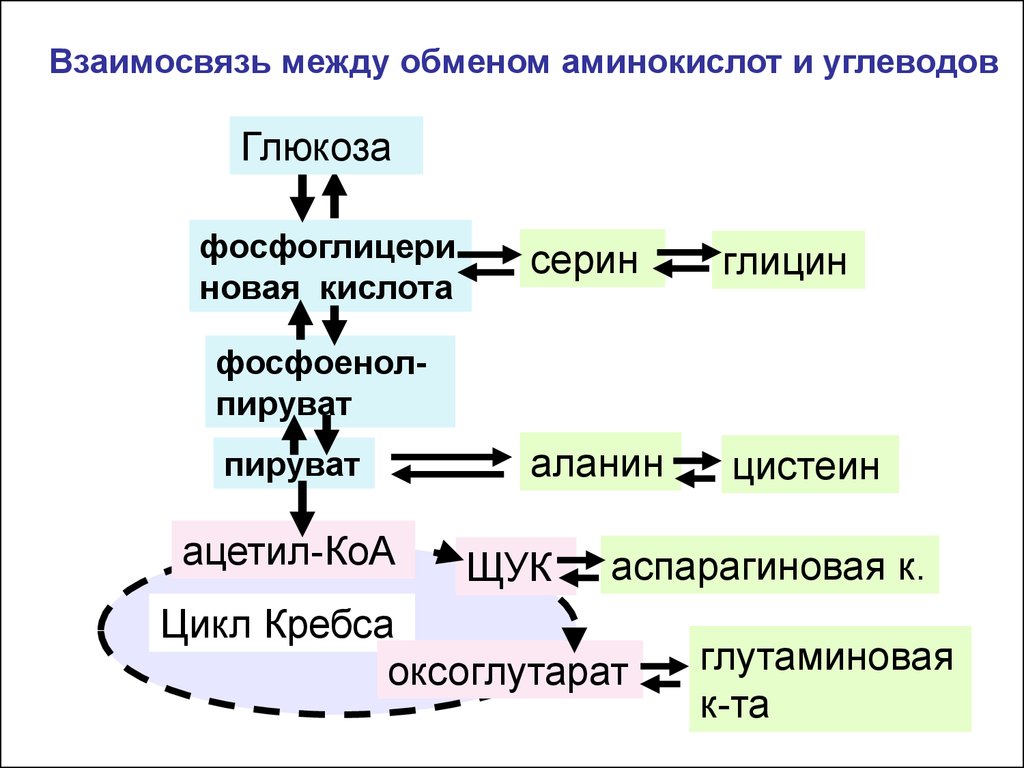
Взаимосвязь между обменом аминокислот и углеводовГлюкоза
фосфоглицери
новая кислота
серин
глицин
аланин
цистеин
фосфоенолпируват
пируват
ацетил-КоА
ЩУК
аспарагиновая к.
Цикл Кребса
оксоглутарат
глутаминовая
к-та
73.
Превращение глицерина в фосфоглицериновыйальдегид
СН2-ОН
СН -ОН
АТФ
глицерин
СН -ОН
фосфоглицерин
НАД
СН -ОН
СН2-ОРО3Н2
СН2-ОН
НАД
СН2-ОРО3Н2
СН2-ОН
Н
С=О
СН2-ОН
НАДН2
фосфоглицериновый
альдегид
С=О
НАДН2
СН2-ОРО3Н2
фосфодиоксиацетон
СООН
СООН
С=О
С=О
СН2-ОРО3Н2 Н3РО4 СН2-ОН
гидроксипируват
74.
получение серинаСООН
СООН
+ СH-NH2
С=О
СН2-ОН
аминотрансфераза
CH2
В6
СООН
СООН
СH-NH2 + С = O
СН2-ОН
CH2
CH2
CH2
COOH
COOH
глутаминовая к-та
серин
оксоглутарат
75.
Обменнуклеиновых
кислот
76.
Динамические равновесие междупроцессом запрограммированной
смерти клетки и ее клонированием
регенерация
апоптоз
77.
Продукты, наиболее богатыенуклеиновыми кислотами
1. икра
2. дрожжи
3. лекарственные препараты
(нуклеинат натрия)
78.
Расщепление нуклеопротеинав кишечнике
ДНК-аза
трипсин,
химотрипсин
79.
Расщепление РНК в кишечникеРНК-аза
РНК
80.
Расщепление динуклеотида в кишечникеО
НN
N
О
N
NH2
О
N
СН2-О – Р- ОН
ОН
NH2
N
N
N
О
О
N
СН2-О – Р-=О
ОН
ОH
ОН
ОН
фосфодиэстераза
81.
Распадпуриновых
нуклеотидов
82.
ферменты, расщепляющие АМФNH2
дезаминаза
N
51-нуклеотидаза
N
N
N
О
О
СН2-О – Р- ОН
ОН
нуклеозидаза
ОH ОН
83.
Продукты гидролиза АМФО
НN
Н3РО4
N
N
NН
гипоксантин
NH3
ОН
О
СН2ОН
ОH ОН
рибоза
84.
Окисление гипоксантинаО
НN
О
N
N
NН
гипоксантин
Н2О + О2
Н2О2
НN
О
N
NH NН
N
ксантин
85.
ферменты, расщепляющие ГМФО
N
НN
NH2
51-нуклеотидаза
нуклеозидаза
N
дезаминаза
N
О
О
СН2-О – Р- ОН
ОН
ОH ОН
86.
Продукты гидролиза ГМФО
НN
О
Н3РО4
N
NН NН
ОН
ксантин
NH3
О
СН2ОН
ОH ОН
рибоза
87.
Окисление ксантинаО
НN
О
О
N
NН NН
N
ксантин
Н2О + О2
Н2О2
НN
О
N
NH
О
NН NН
N
NH
мочевая кислота
88.
Содержание мочевойкислоты в крови
0,24 +0,06 ммоль/л
89.
Распадпиримидиновых
нуклеотидов
90.
ферменты, расщепляющие ЦМФNH2
дезаминаза
51-нуклеотидаза
N
О
О
N
О
СН2-О – Р- ОН
ОН
нуклеозидаза
ОH ОН
91.
ферменты, расщепляющие УМФО
НN
51-нуклеотидаза
О
О
N
О
СН2-О – Р- ОН
ОН
нуклеозидаза
ОH ОН
92.
Продукты гидролиза УМФ и ЦМФО
Н3РО4
НN
О
NН
ОН
урацил
NH3
О
СН2ОН
ОH ОН
рибоза
93.
Расщепление урацилаН2N - СН2 – СН2 -СООН
β-аланин
О
CO2
НN
О
NН
урацил
NH3
94.
Биосинтезпуриновых
нуклеотидов
95.
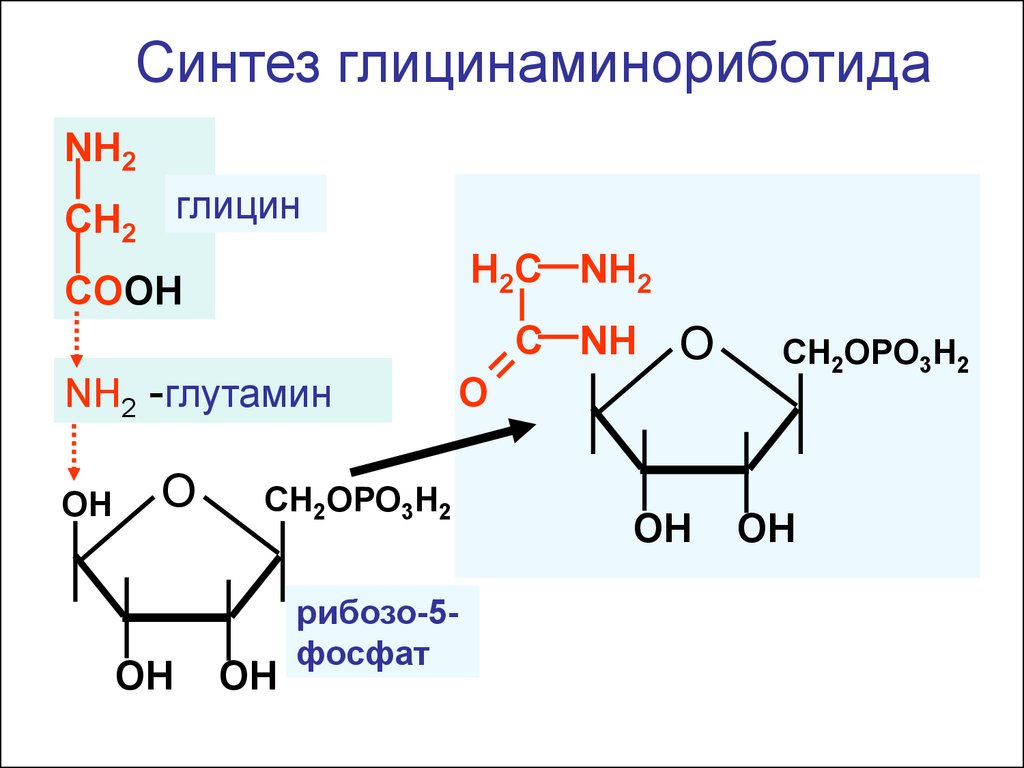
Синтез глицинаминориботидаNH2
CH2 глицин
H2C NH2
COOH
C NH
NH2 -глутамин
ОН
О
ОH
СН2ОPO3H2
O
СН2ОРО3H2
ОН
О
рибозо-5фосфат
ОH
ОН
96.
Синтез аминоимидазолриботидаHC
формил-фолиевая к-та
C N
NH2
С=О
H2C NH2
C NH
O
N
Н
СН
рибозо-5-фосфат
ГЛУ-NH2
рибозо-5-фосфат
97.
Построение пиримидиновогокольца в пуриновом нуклеотиде
биотин-СО2
аспарагиновая к-та
С=О
НN
N
О=С
NН2
формил-фолиевая к-та
N
рибозо-5-фосфат
98.
Синтез АМФАспарагиновая
кислота
NH2
N
N
N
N
О
О
СН2-О – Р- ОН
ОН
ОH ОН
99.
Синтез ГМФО
N
НN
NH2
N
Глутаминовая
кислота
N
О
О
СН2-О – Р- ОН
ОН
ОH ОН
100.
Биосинтезпиримидиновых
нуклеотидов
101.
1. Синтез карбамоил-фосфатаБиотин-СО2
NH3
АТФ
NH2
O=C
+ АДФ
O-PO3H2
102.
2. Синтез оротовой кислотыС=O
HN
СООН
NH2
O=C
O-PO3H2
карбамоил
фосфат
+
O=C
СН2
СН
NH2 COOH
аспарагиновая
кислота
СН
С
NH COOH
оротовая
кислота
103.
Активация пентозы-5-фосфатОН ОН
ОН
О
СН2ОРО3H2
+ АТФ
ОH
ОН
рибозо-5фосфат
О=Р-О-Р=О
ОН
О
О
СН2ОРО3Н2
АМФ
ОH
ОН
фосфорибозилдифосфат
104.
Синтез пиримидиновогонуклеотида
С=O
СН
HN
С
O=C
NH
+ АТФ
+ фосфорибозилдифосфат
СOOH
СО2
105.
Получениеуридинмонофосфата
О
НN
О
О
N
О
СН2-О – Р- ОН
ОН
3 Н3РО4
+ АДФ
ОH ОН
106.
Превращения пиримидиновых нуклеотидовО
НN
О
О
НN
-СН3
О
N
О
СН2-О – Р- ОН
ОН
О
О
N
О
СН2-О – Р- ОН
H
ОН
ОН
дТМФ
NH2
ОH
ОН
УМФ
НN
О
О
N
О
СН2-О – Р- ОН
ОН
ОH
ОН
ЦМФ
107.
Энергизация нуклеотидов1) АМФ + АТФ = 2 АДФ
АДФ + Н3РО4(митохтндрии) = АТФ
2) ГМФ + 2 АТФ = ГТФ + 2 АДФ
3) УМФ + 2 АТФ = УТФ + 2 АДФ
4) ТМФ + 2 АТФ = ТТФ + 2 АДФ
5) ЦМФ + 2 АТФ = ЦТФ + 2 АДФ






































































































 biology
biology








